柳兰鞣质含量动态分析及体外抗氧化作用研究
2014-02-06郝春艳李凤伟
刘 娟,郝春艳,李凤伟
(佳木斯大学药学院,黑龙江 佳木斯 154007)
柳兰(Chamaenerion angustifoliu)为柳叶菜科柳兰属多年生草本植物[1,2],异名糯芋(云南)、大救驾(湖北) 、山麻条(四川) ,又名红筷子。柳兰全草入药,性辛、苦、平,有小毒,具有调经活血及消肿止痛的功效,用于治疗骨折、关节扭伤、月经不调、阴囊肿大等症[3]。目前已经从柳兰中分离出了4个黄酮类化合物和9个鞣质及其小分子多元酚类化合物[4,5]。其提取物具有抗肿瘤和抗炎作用[6,7]。鞣质也称单宁,是一类水溶性的含多酚羟基结构的化合物,其具有较强的化学活性及生理活性,如抗氧化、抗病毒、抗衰老、止血作用等[8]。通过对相关文献的查阅,目前尚未见有对其鞣质含量测定及其所含化学成分鞣质的体外抗氧化活性的相关报道,因此本文以柳兰鞣质含量变化为指标,采用紫外分光光度法测定了不同生长期柳兰中鞣质的含量,研究柳兰中鞣质的动态积累规律,并测定其鞣质成分的体外抗氧化活性,为柳兰的开发利用及药材采收加工提供科学依据。
1 材料、仪器与试剂
1.1 试验材料
柳兰样品分别于2013年5~8月采自黑龙江省佳木斯市汤原县葫芦岛,经佳木斯大学生药学教研室刘娟教授鉴定为柳叶菜科植物柳兰(Chamaenerion angustifoliu)。
1.2 试验仪器
紫外分光光度计 (上海棱光技术有限公司),电子天平(上海恒平科学仪器有限公司),HH - 2.4型恒温水浴锅(郑州长城科工贸有限公司),微型植物粉碎机(天津市泰斯特仪器有限公司)。
1.3 试验试剂
没食子酸标准品(中国药品生物制品检定所,批号:0831-9501);DPPH标准品(Sigma公司);邻苯三酚、丙酮、钼酸钠、硫酸锂、钨酸钠、盐酸、溴、磷酸均为分析纯。干酪素为化学纯。
2 方法与结果
2.1 柳兰鞣质的含量测定
2.1.1 溶液的配制
磷钼钨酸试液的配制:称取钼酸钠25g、钨酸钠100g,加入水700mL将其溶解,再加入磷酸50mL、盐酸100mL,加热回流10h,冷却,继续加入硫酸锂150g、水50mL和液溴0.2mL,加热煮沸约15min以除去残留的溴,用水稀释至1000mL,过滤,收集滤液,即得黄色磷钼钨酸试液。对照品溶液的制备:准确称取没食子酸对照品50mg,置于100mL棕色容量瓶中,加水溶解,稀释至刻度,准确量取上述溶液5mL,置于50mL棕色容量瓶中,以水稀释至刻度,摇匀,即得浓度为0.05mg/mL的对照品溶液。
供试品溶液的制备:精密称取过四号筛的柳兰干燥全草粉末1g于三颈瓶中,以60%丙酮为溶剂,料液比为1:20,70℃水浴回流2h,滤过,定容于25mL容量瓶中,从中精密量取5mL定容于100mL容量瓶中,即为供试品溶液。
2.1.2 标准曲线的绘制
准确移取没食子酸对照品溶液0.5mL、1.0mL、2.0mL、3.0mL、4.0mL、5.0mL,分别置于25mL棕色容量瓶中,再各加入磷钼钨酸试液1mL,分别加入水11.5mL、11mL、10mL、9mL、8mL、7mL,以29%碳酸钠溶液稀释至刻度,摇匀,避光静置30min。以相应的试剂作为空白,照紫外可见分光光度法,在760nm波长处测定吸光度,以浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程为:y=101.7x+0.022。

图1 没食子酸标准曲线
2.1.3 含量测定条件的选择
显色时间:根据2010年版《中国药典》方法,样品溶液中加入显色剂静置30min后,其中的酚酸可与显色剂完全反应,经稳定性考察表明,溶液显色后在3 h内稳定。因此选择显色时间为30 min,并且在3 h内测定吸光度。
干酪素用量:分别准确称取0.4、0.5、0.6、0.7、0.8、0.9g干酪素,沉淀等量的样品(供试品溶液25mL)。结果表明,随着干酪素用量的增加,游离多酚的含量逐渐减少,当干酪素用量达0.8g时,溶液中的游离多酚含量不再减少,说明其中的鞣质已被干酪素吸附完全。由此确定干酪素用量为0.8g。
2.1.4 鞣质含量测定方法
总酚:精密吸取一定量的供试品溶液,置于25mL棕色容量瓶中,按照标准曲线的制备项下的方法,自“加入磷钼钨酸试液1mL”起,再加水补至13mL,以29%碳酸钠溶液稀释至刻度。依法测定溶液吸光度,在标准曲线中读出供试品溶液中没食子酸的量(mg),计算即得。
不被吸附的多酚:准确量取供试品溶液25mL,加于已盛有干酪素0.8g的100mL具塞锥形瓶中,密封,置于30℃水浴中,保温1h,每隔5min振摇一次,取出放冷,摇匀,过滤,弃去初滤液,准确量取续滤液5mL,置于25mL棕色容量瓶中,按照标准曲线制备项下的方法,自“加入磷钼钨酸试液1mL”起,再加水补至13mL,以29%碳酸钠溶液稀释至刻度。依法测定吸光度,在标准曲线中读出供试品溶液中没食子酸的量(mg),计算即得。
按照下式计算鞣质的含量:
鞣质含量=总酚的量-不被吸附的多酚量
2.1.5 方法学考察
精密度试验:准确移取供试品溶液1mL,按照总多酚含量测定的方法,测定样品的吸光度,连续测定6次,RSD为0.19%,表明仪器精密度良好。
稳定性考察:准确移取同一供试品溶液1mL,按照总多酚含量测定方法进行显色,分别在显色后0.5,1,1.5,2,2.5,3 h测定溶液的吸光度。结果表明,随着显色后放置时间的延长,样品溶液的吸光度在逐渐的下降,但在3 h内溶液吸光度的RSD为2.6%(n=6),表明样品显色后至少在3h内稳定。
重复性考察:取6份同一柳兰样品粉末1g,平行制备供试品溶液6份,按“2.1.4”项下方法测定鞣质含量,结果鞣质含量平均为12.07%,RSD为2.3%,结果表明此方法重复性良好。加样回收率考察:取同一柳兰样品粉末9份,每份1g,精密称定,平行制备供试品溶液,分别加入一定量的没食子酸对照品溶液,使得没食子酸的加入量为柳兰样品中总多酚含量的50%(3份)、100%(3份)和150%(3份)。按照总多酚含量的测定方法测定样品中总多酚含量,计算其加样回收率,结果其平均加样回收率为99.03%,RSD为2.55%。
2.1.6 柳兰样品含量测定
取不同采收时期柳兰全草干燥粉末各1g,供制备试品溶液,准确移取供试品溶液1mL,在“2.1.4”项条件下显色,测定其吸光度,每个样品平行测定两次,取平均值,计算鞣质含量。

表1 不同采收期柳兰中鞣质的含量测定(%,n=2)
研究结果表明柳兰中鞣质含量随着生长期不同呈规律性变化,不同时期柳兰中鞣质含量由高到低依次为:花蕾期>花果期>幼苗期>果期。
2.2 柳兰鞣质的纯化
取提取液适量,加入过量1%热明胶溶液,使其充分沉淀,直至沉淀不再产生为止,过滤,将沉淀置于丙酮中,过滤,减压回收溶剂至干,即得柳兰鞣质提取物粉末。
2.3 柳兰鞣质体外抗氧化活性评价
2.3.1 对DPPH自由基的清除作用
分别取不同浓度(0.002、0.004、0.006、0.008、0.01mg/mL)的柳兰鞣质溶液2.0mL于试管中,分别加入DPPH溶液2.0mL,于37℃避光反应30min,在517nm波长处测定其吸光度值(AS)。同时,在517nm处测定不同浓度样品2.0mL加乙醇2.0mL的吸光度值(AC),乙醇2.0mL 加DPPH 2.0mL的吸光度值(A0)。并计算DPPH自由基清除率。以Vc溶液作为阳性对照。其清除率按下式计算:
清除率(%)=[1-(AS-AC)]/A0×100%
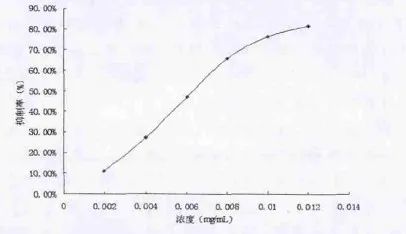
图2 柳兰鞣质对DPPH的清除能力
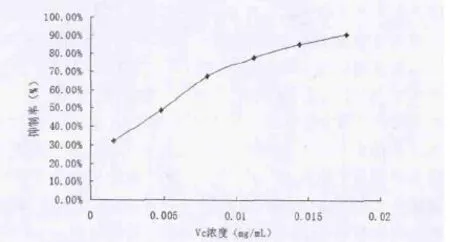
图3 Vc对DPPH的清除能力
维生素C和柳兰鞣质对DPPH自由基均有清除作用,随着浓度升高,清除率增大,其IC50值分别为0.00502mg/L和0.00632mg/mL,二者较为接近,表明柳兰鞣质具有较好的清除DPPH自由基的作用。
2.3.2 对超氧阴离子自由基的清除作用
在试管中准确加入5mL Tris-HC1缓冲溶液(pH=8.2)和2.0mL不同浓度的样品(0.008mg/mL,0.016mg/mL,0.024mg/mL,0.032mg/mL,0.04mg/mL),混匀后在25℃恒温水浴中反应20min,取出后迅速加入50μL经25℃预热的5mmol/L的邻苯三酚,摇匀后立即倒入比色皿中,于325nm处以30s为时间间隔,扫描其在5min内的OD值。以同样操作的2.0mL超纯水代替样品溶液作为平行对照,以同样操作的Vc溶液作为阳性对照组,以pH=8.2的Tris-HC1缓冲溶液为空白对照。根据邻苯三酚每分钟自氧化率计算抑制率,按照下列公式计算:
抑制率(%)=(ΔA0/Δt-ΔA1/Δt)/(ΔA0/Δt)
ΔA0/Δt—平行对照组邻苯三酚在该时段的自氧化率;
ΔA1/Δt—加入样品后邻苯三酚在该时段的自氧化率;
由图可知,维生素C和柳兰鞣质对超氧阴离子自由基清除作用均随着浓度的增加而增强,其IC50值分别为0.01mg/mL和0.028mg/mL,说明柳兰鞣质具有一定抗超氧阴离子自由基的活性,但较维生素C弱。

图4 柳兰鞣质对超氧阴离子自由基的清除作用
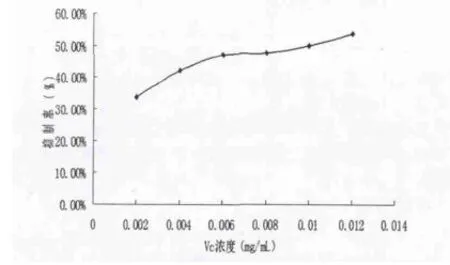
图5 Vc对超氧阴离子自由基的清除作用
3 讨论
采用紫外分光光度法测定柳兰鞣质,经过方法学的验证,其试验稳定性、仪器精密度、加样回收率及方法重现性均达到分析要求,且该方法简便快捷,准确性高,操作简单、省时、取样量少,适用于柳兰鞣质的含量测定。但其干酪素用量对实验结果具有一定影响,因此本实验对干酪素用量进行了考察,将其可吸附多酚完全吸附,确保了结果的准确性。研究结果显示柳兰中鞣质含量随着生长期不同呈规律性变化,在花蕾期含量最高,含量为12.50%,果期含量最低,含量为5.32%,这可能是由于其生长环境、阳光、温度、降水量等条件的改变所致。该结果表明,若以鞣质作为其有效成分之一,柳兰药材的最佳采收期为花蕾期。
本实验通过对柳兰鞣质体外抗氧化活性的研究,表明柳兰鞣质对于DPPH自由基和超氧阴离子自由基均具有一定的清除作用。表明柳兰在医药、保健品等行业的应用具有远大前景。
[1]中国科学院植物研究所.中国植物志[M].北京:科学出版社,2005,53:73-74
[2]中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1980,1021
[3]杜喜春,常瑾.柳兰种子萌发条件研究[J].陕西林业科技,2011,(4):17-18,24
[4]刘延泽,王彩芳,张振中,等.柳兰化学成分研究1柳兰中的黄酮类化合物[J].中草药,2002,33(4):289-291
[5]刘延泽,王彩芳,张振中,等.柳兰化学成分研究2鞣质及多元酚类化合物[J].中草药,2003,34(11):967-969
[6]Hicrmann,Alois,Reidlinger,et al.Isola-tion of the anti phlogistie principle from Epilobium angusti-foium[J].Planta Med,1991,57(4):357-360
[7]余传隆,黄泰康,丁志遵,等编.中药辞海[M].北京:中国医药科技出版,1993,24
[8]张远荣,王锋.翻白草鞣质的体外抗氧化作用研究[J].中国药房, 2011, 11(22):983-985
