柞蚕雄蛾黄酮的提取及其体外抗氧化活性分析
2014-01-17岳喜庆
田 野,岳喜庆*,杨 梅
柞蚕雄蛾黄酮的提取及其体外抗氧化活性分析
田 野,岳喜庆*,杨 梅
(沈阳农业大学食品学院,辽宁 沈阳 110866)
研究柞蚕雄蛾黄酮提取工艺及其体外抗氧化作用,采用超声波乙醇提取柞蚕雄蛾黄酮,利用紫外-可见吸收光谱对其进行鉴定,采用正交试验设计优选柞蚕雄蛾黄酮提取的最佳工艺条件。从还原能力以及清除1,1-二苯基苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基(·OH)、超氧阴离子自由基(O2-·)效果来考察柞蚕雄蛾黄酮的体外抗氧化能力。得到最佳工艺条件为:乙醇体积分数60%、料液比1∶40(g/mL)、提取时间45 min、提取温度70 ℃,在此条件下进行验证实验,柞蚕雄蛾黄酮的一次提取量可达3.72 mg/g。柞蚕雄蛾黄酮对自由基的清除能力较强,均呈现出量效关系,其清除DPPH自由基、·OH、O2-·的IC50值分别为752.4、617.8、813.4 μg/mL,其中清除·OH能力要强于VC和2,6-二叔丁基-4-甲基苯酚,清除O2-·能力大于2,6-二叔丁基-4-甲基苯酚。表明柞蚕雄蛾黄酮具有较强的体外抗氧化活性。
柞蚕雄蛾;黄酮;提取;体外抗氧化活性
柞蚕雄蛾属节肢动物门昆虫纲鳞翅目天蚕蛾科柞蚕(Anfheraea pernyi Guerrin Meneville),是一种在我国具有悠久养殖历史的药食两用经济昆虫,属完全变态昆虫。起源于中国,分布辽阔,南起云南高原,北至黑龙江,东起山东半岛,西至甘肃河西走廊[1]。柞蚕雄蛾营养物质丰富,干物质中含粗蛋白40.49%,氨基酸种类齐全、比例适当,高于世界卫生组织和联合国粮农组织(WHO/FAO)推荐的蛋白质氨基酸记分模式[3],脂肪酸含量中不饱和脂肪酸占78.6%、必需脂肪酸占43%,超过了《食物成分表》中的任何一种动物的脂肪酸含量[4]。柞蚕雄蛾还含有丰富的矿物质、微量元素、维生素、和激素类等其他活性物质[2],特别是柞蚕雄蛾中含有丰富的黄酮类化合物,这在动物中不多见。雄蚕蛾药用功效在《本草纲目》早有记载“雄原蚕蛾益精气,强阴道,交接不倦,亦壮阳事,止泄精、尿血、暖水脏,治暴风、金疮、冻疮、汤火疮,灭瘢痕”[5]。其已被证明具有保肝降酶、增强机体免疫力、降血脂血糖、抗衰老及抗肿瘤等多种功能特性[4]。
研究开发生物源的保健品,一直都是保健食品领域所关注的热点问题。黄酮类化合物已被证明在生物体内具有明显的预防心血管疾病、降血压、抗风湿[6]、抗病毒、抗炎抗菌[7]、调节机体免疫力、抗氧化[8]、防癌抗癌[9]等诸多功效。目前,人们对植物体内黄酮类化合物的研究很多[10-11],而对动物,特别是昆虫体内黄酮类化合物的研究甚少。近年来,对于柞蚕雄蛾的研究主要涉及雄蛾浓缩液[12]、油[13]、蛋白[14]、激素[15]、保健酒[16]等的提取或制备工艺,未见有对柞蚕雄蛾黄酮提取及其抗氧化活性进行研究的报道。本实验利用超声波辅助提取技术,对柞蚕雄蛾黄酮的提取工艺及体外抗氧化活性进行研究,以期探究柞蚕雄蛾抗氧化功能协同作用机制,并为柞蚕雄蛾在食品相关领域的综合开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
新鲜柞蚕雄处女蛾 辽宁省柞蚕研究所。
1.1.2 试剂
芦丁标准品 中国医药上海化学试剂公司。
石油醚(沸程60~90 ℃)、甲醇、无水乙醇、抗坏血酸(VC)、2,6-二叔丁基-4-甲基苯酚(2,6-di-tertbutyl-4-methylphenol,BHT)、亚硝酸钠、硝酸铝、氢氧化钠、邻苯三酚、三羟甲基氨基甲烷(Tris)、磷酸氢二钠、磷酸二氢钠、三氯乙酸、硫代巴比妥、硫酸铁-EDTA 、双氧水(H2O2)、2-脱氧核糖、乙醚、钨酸钠均为分析纯试剂。
1.2 仪器与设备
SHB-III循环水式多用真空泵、RE-52A型旋转蒸发器 上海亚荣生化仪器厂;3-15型台式离心机 德国Sigma公司;U-3010紫外-可见分光光度计 日本日立公司;AS2060B型超声波清洗器 天津奥特赛恩斯仪器有限公司。
1.3 方法
1.3.1 原料处理
新鲜柞蚕雄处女蛾速冻后于恒温(70 ℃)干燥箱中烘干后粉碎备用。
1.3.2 黄酮类物质的提取[17]
将研磨后的柞蚕雄蛾粉置于索氏提取器中,用石油醚溶剂于90 ℃条件下抽提至无色,除去脂肪。旋转蒸发除去石油醚,以乙醇为提取剂,在超声波辅助提取后将提取液用旋转蒸发器在50 ℃条件下减压浓缩,4 500 r/min离心10 min,吸取上清液作为样液,放于4 ℃冰箱中保存备用。
1.3.3 制备标准液
精密称取120 ℃芦丁标准品20 mg,用乙醇溶于100 mL容量瓶,定容至刻度,摇匀。对照液质量浓度为0.2 g/L,置于4 ℃冰箱备用。
1.3.4 柞蚕雄蛾黄酮的鉴定及波长的选择[18]
分别量取1 mL芦丁标准品溶液和柞蚕雄蛾提取液,各用体积分数70%乙醇溶液4 mL,加入至10 mL容量瓶中;再加入0.3 mL质量分数5%的亚硝酸钠溶液,摇匀后静置6 min;然后加入0.3 mL质量分数10%的硝酸铝溶液,在摇匀后静置6 min;最后加入4 mL 1.0 mol/L的氢氧化钠溶液,加体积分数70%乙醇溶液定容。摇匀后静置15 min,在波长400~800nm范围内进行全波长扫描。
扫描结果(图1)所示,柞蚕雄蛾提取液和芦丁标准溶液的可见吸收光谱相一致,且最大吸收峰值均在510 nm波长处左右,由此说明柞蚕雄蛾提取液中含有黄酮类化合物。

图1 标准液与样品液光谱扫描图Fig.1 Absorption spectra of rutin standard solution and sample solution
1.3.5 标准曲线的制定
精密量取0、0.5、1.0、1.5、2.0、2.5 mL上述标准液于10 mL容量瓶中,以下同1.3.4节的步骤进行。于510 nm波长处测定吸光度,用DPS软件处理,绘制标准曲线,得到回归方程为:Y=0.080 5X+0.000 4,相关系数R2=0.999 7。式中,Y为质量浓度/(g/L),X为吸光度。1.3.6 柞蚕雄蛾黄酮含量的测定
将样品提取液用乙醇定容于50 mL容量瓶中,从中取出1 mL样液置容量瓶中。以后添加试剂及处理方法同1.3.4节,在510 nm波长处测定其吸光度。根据标准曲线方程计算样品中黄酮的提取量(mg/g)。
1.3.7 正交试验确定超声波法提取柞蚕雄蛾总黄酮最佳工艺条件

表11 LL9(334)正交试验因素水平表Table 1 Factors and levels used for L9(34) orthogonal desiggnn
在相同原料的基础上,首先确定选择用乙醇溶液作为提取剂,提取次数为2 次。然后选择乙醇的体积分数、料液比、提取时间、提取温度4 个因素作为影响柞蚕雄蛾总黄酮提取率的研究对象,在单因素试验基础之上设计出因素水平表,以柞蚕雄蛾黄酮提取量作为考察的指标,进行正交试验,确定超声波法提取柞蚕雄蛾总黄酮最佳工艺条件。正交试验因素水平见表1。
1.3.8 体外抗氧化活性的测定
将柞蚕雄蛾黄酮配制成不同质量浓度的黄酮溶液,对其体外抗氧化能力进行研究,且与同等条件下VC、BHT的抗氧化能力进行对比。
1.3.8.1 柞蚕雄蛾黄酮还原能力的测定
参照Tsai等[19]的方法,采用氰铁化钾还原法进行评价。
1.3.8.2 柞蚕雄蛾黄酮清除DPPH自由基能力的测定[20-21]
精确吸取等体积的不同质量浓度样品试液及2×10-4mol/L DPPH溶液各2 mL于试管中,摇匀,室温条件下放置30 min,测定其在517 nm波长处的吸光度(Ax);后用无水乙醇加入DPPH溶液作为空白参照组(A0);用2.0 mL不同质量浓度的样品试液与2.0 mL的无水乙醇混合溶液作为样品对照(Ay);用无水乙醇来校正分光光度计零点,阳性对照为VC溶液和BHT溶液,平行测定3 次。DPPH自由基清除率计算见式(1)。

1.3.8.3 柞蚕雄蛾黄酮清除·OH能力的测定[22-23]
取0.2 mL样液、1.0 mL pH 7.4浓度为0.2 mol/L磷酸缓冲液、0.20 mL 10 mmol/L的2-脱氧核糖溶液、0.20 mL 10 mmol/L的硫酸铁-EDTA溶液、0.2 mL去离子水,混匀,放入水浴锅中37 ℃恒温水浴1 h,后加入0.2 mL 10 mmol/L的H2O2,计时1 h后加入1.0 mL 28 mg/mL的三氯乙酸及1.0 mL 10 mg/mL硫代巴比妥结束反应,于100 ℃水浴10 min。然后冰浴至室温,在532 nm波长处测定吸光度。阳性对照为VC溶液和BHT溶液,平行测定3 次。·OH清除率计算见式(2)。

式中:A0表示不添加样品时吸光度;Ax表示样品的吸光度;Ay表示空白的吸光度。
1.3.8.4 柞蚕雄蛾黄酮O2-·清除作用的测定[24-25]
取pH8.2的Tris-HCl缓冲液和50 mmol/L邻苯三酚在25 ℃条件下水浴保温10 min,然后取5.0 mL pH 8.2的Tris-HCl缓冲液,加入5 μL 50 mmol/L邻苯三酚,摇匀,在325 nm波长处立即测定吸光度,每隔1 min测一次吸光度(A),以pH 8.2的Tris-HCl缓冲液为空白,自氧化速率控制在0.060~0.065 A值/min,以测定15 min内平均吸光度计。加入样品后,氧化率的测定:取5.0 mL pH 8.2的Tris-HCl缓冲液,加不同质量浓度的待测样品0.5 mL和5 μL 50 mmol/L的邻苯三酚溶液(样品对照组用pH 8.2的Tris-HCl缓冲液来代替),摇匀,然后按上述方法立即进行测定(用pH 8.2的Tris-HCl缓冲液作为空白对照组)。O2-·清除率计算见式(3)。

2 结果与分析
2.1 超声波提取柞蚕雄蛾黄酮工艺的结果分析
2.1.1 提取溶剂的确定
在料液比1∶30、提取时间60 min、提取温度70 ℃条件下,分别用水、甲醇、乙醇、乙酸乙酯、丙酮作为溶剂进行提取,提取3 次,结果见图2。

图2 溶剂与黄酮提取量的关系Fig.2 Effect of solvents on the extraction yield of flavonoids
图2 表明,在相同条件下,体积分数70%的不同溶剂对柞蚕雄蛾黄酮提取量:70%甲醇(3.09 mg/g)>70%丙酮(3.05 mg/g)>70%乙醇(3.03 mg/g)>70%乙酸乙酯(2.65 mg/g)>水(1.36 mg/g)。若选用甲醇、丙酮作为提取溶剂,虽然提取效果不错,但是有毒。用乙醇作为溶剂的提取量也较高,与甲醇、丙酮提取量差别非常小,且无毒,考虑无害生产及成本的问题,选用70%乙醇作为提取溶剂。
2.1.2 提取次数的确定
在70%乙醇、料液比1∶30、提取时间60 min、提取温度70 ℃条件下,重复提取4 次,测定不同提取次数对柞蚕雄蛾黄酮提取量的影响,结果如表2所示。

表2 提取次数对黄酮提取量的影响Table 2 Effect of number of extraction cycles on the extraction yield of flavonoids
从表2可以看出,超声波对于柞蚕雄蛾黄酮提取效果较好,一次提取就基本可以提取出将绝大部分雄蛾黄酮,两次提取以后提取量增长幅度特别小,且能耗较大,造成浪费,所以综合考虑,确定提取2 次为宜。
2.1.3 溶剂体积分数的确定
在料液比1∶30、提取时间60 min、提取温度70 ℃条件下,分别以35%、50%、65%、80%、95%五个不同体积分数的乙醇溶液进行提取,提取2 次,测定不同乙醇体积分数对柞蚕雄蛾黄酮提取量的影响,结果见图3。
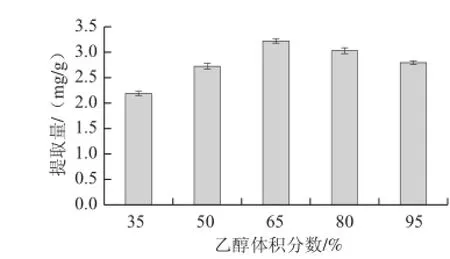
图3 乙醇体积分数对黄酮提取量的影响Fig.3 Effect of ethanol concentration on the extraction yield of flavonoids
由图3可以看出,乙醇体积分数在65%时柞蚕雄蛾黄酮提取量最大,所以选择65%的乙醇作为提取溶剂为宜。
2.1.4 料液比的确定
在65%乙醇、提取时间60 min、提取温度70 ℃条件下,分别以1∶10、1∶15、1∶25、1∶35、1∶45五个不同料液比进行提取,提取2 次,测定不同料液比对柞蚕雄蛾黄酮提取量的影响,结果见图4。
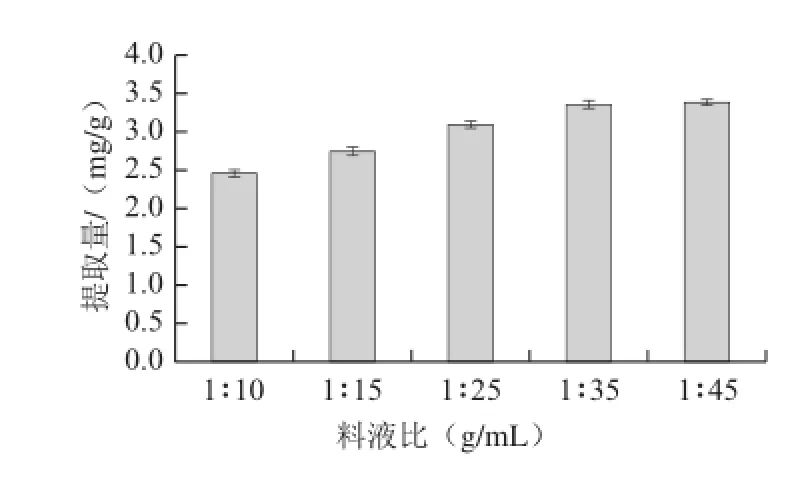
图4 料液比对黄酮提取量的影响Fig.4 Effect of material/liquid ratio on the extraction yield of flavonoids
从图4可知,柞蚕雄蛾黄酮的提取量在同一条件下,随着液体量的增大而逐渐增加,料液比1∶45(提取量3.38 mg/g)与1∶35(提取量3.35 mg/g)相比提取量虽有增长,但差异较小,考虑原料试剂等生产成本,避免浪费,宜选择1∶35作为料液比。
2.1.5 超声波提取时间的确定
在65%乙醇、料液比1∶35、提取温度70 ℃条件下,分别超声波提取15、30、45、60、75 min,提取2 次,测定不同提取时间对柞蚕雄蛾黄酮提取量的影响,结果见图5。

图5 提取时间对黄酮提取量的影响Fig.5 Effect of extraction time on the extraction yield of flavonoids
从图5可以看出,柞蚕雄蛾黄酮提取量随着提取时间的延长而逐渐增长,其中在45 min之前提取量的增长比较显著,随后增长幅度较小,趋于稳定。在提取时间为45 min时雄蛾黄酮的提取量为3.53 mg/g,与60 min(提取量3.55 mg/g)和75 min(提取量3.56 mg/g)时的提取量差异较小,综合考虑减少能耗、减少工时、避免浪费,选择45 min作为提取时间为宜。
2.1.6 提取温度的确定
在65%乙醇、料液比1∶35、提取时间45 min条件下,分别以50、60、70、80、90 ℃五个不同提取温度进行提取,提取2 次,测定不同提取温度对柞蚕雄蛾黄酮提取量的影响,结果见图6。
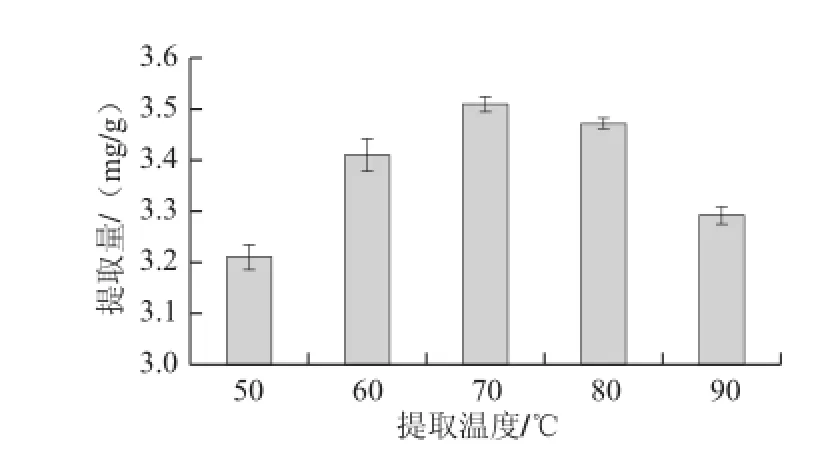
图6 提取温度对黄酮提取量的影响Fig.6 Effect of extraction temperature on the extraction yield of flavonoids
由图6可以看出,提取温度在70 ℃时柞蚕雄蛾黄酮提取量最大,所以选择70 ℃作为提取温度为宜。
2.1.7 正交试验结果分析
从表3正交分析结果可以看出,乙醇体积分数对柞蚕雄蛾黄酮提取起主要作用,其次是料液比,提取时间和提取温度基本无影响,各因素对柞蚕雄蛾总黄酮提取量的影响强弱顺序为乙醇体积分数>料液比>提取时间>提取温度。就提取时间看来,45 min和60 min相比,提取量基本相同,并没有较大差别,为了节约能耗,选择提取时间为45 min。综合考虑,超声波提取柞蚕雄蛾黄酮的最佳工艺组合为A1B3C2D2,即乙醇体积分数60%、料液比1∶40、提取时间45 min、提取温度70 ℃,在此条件下进行放大实验,柞蚕雄蛾总黄酮的一次提取量可达3.72 mg/g。

表3 正交试验设计及结果(n=3)Table 3 Results of orthogonal array design (n=3)
2.2 柞蚕雄蛾黄酮的体外抗氧化活性测定结果
2.2.1 柞蚕雄蛾黄酮还原能力
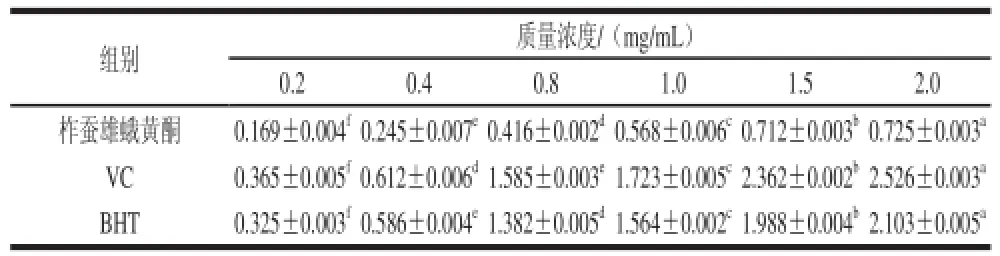
表4 柞蚕雄蛾黄酮还原力的测定结果Table 4 Reducing power of the flavonoids from male tussah moth
从表4可知,随着柞蚕雄蛾黄酮质量浓度的增加,还原力在不断增大,还原力与雄蛾黄酮质量浓度呈正相关。在0.2~1.5 mg/mL的范围内,雄蛾黄酮的还原力增加迅速,后逐渐趋于稳定。但其还原力明显要低于VC和BHT,2.0 mg/mL的雄蛾黄酮的还原力仅为0.725,而0.8 mg/mL的VC和BHT的还原力就已分别达到1.585和1.382。
2. 2.2 柞蚕雄蛾黄酮清除DPPH自由基能力

图7 柞蚕雄蛾黄酮对DPPH自由基清除率Fig.7 Scavenging activity of the flavonoids from tussah male moth against DPPH radical
如图7所示,雄蛾黄酮类对DPPH自由基有较高的清除率,在0.2~1.0 mg/mL质量浓度范围内清除率增加迅速,随着雄蛾黄酮质量浓度的增加,对DPPH自由基的清除能力逐渐增强,呈现出正相关,雄蛾黄酮质量浓度在3.0 mg/mL以后逐渐趋于稳定,能达到82%以上,但在同等条件下,雄蛾黄酮对DPPH自由基的清除率低于BHT和VC,其清除DPPH自由基的IC50值为752.4 μg/mL,由此可表明雄蛾黄酮具有较好的抗氧化性。
2.2.3 柞蚕雄蛾黄酮清除·OH能力

图8 柞蚕雄蛾黄酮对·OH清除率Fig.8 Scavenging activity of the flavonoids from male tussah moth against hydroxyl radical
通过图8可以看出,随着样液质量浓度的增加,对·OH的清除率呈逐渐上升趋势,质量浓度在1.0 mg/mL以前增长速度较快,且质量浓度在1.0mg/mL时,雄蛾黄酮对·OH的清除能力已经超过VC,质量浓度在1.5 mg/mL时,雄蛾黄酮对·OH的清除能力超过BHT,质量浓度在3.0mg/mL以上时,对·OH的清除能力基本趋于稳定。可以看出雄蛾黄酮对·OH有较强的清除能力,在达到一定质量浓度以后要优于BHT和VC,其清除·OH的IC50值为617.8 μg/mL,表明其具有抗氧化能力。
2.2.4 柞蚕雄蛾黄酮清除O2-·能力

图9 柞蚕雄蛾黄酮对·清除率Fig.9 Scavenging activitiy of the flavonoids from male tussah moth against superoxide anion radical
由图9结果显示,雄蛾黄酮对O2-·有较好的清除作用,在0.2~3.0 mg/mL区间内的雄蛾黄酮对O2-·的清除率随着质量浓度的增加逐渐增加,呈现量效关系,3.0 mg/mL时清除率可达到83%,以后随着质量浓度的提高,清除率趋于平稳,同时通过阳性对比可以看出,雄蛾黄酮对O2-·的清除能力要强于BHT,低于VC,但相差不是特别大,其清除O2-·的IC50值为813.4 μg/mL。雄蛾黄酮存在对O2-·的抑制作用,说明它具有体外抗氧化活性。
3 结 论
超声波辅助提取柞蚕雄蛾黄酮的最佳工艺条件为乙醇体积分数60%、料液比1∶40、提取时间45 min、提取温度70 ℃,在此条件下进行放大实验,柞蚕雄蛾总黄酮的一次提取量可达3.72 mg/g。各因素对提取率的影响主次顺序为:乙醇体积分数>料液比>提取时间>提取温度。柞蚕雄蛾黄酮体外抗氧化实验结果表明,柞蚕雄蛾黄酮具有较好的还原力,但稍差于VC和BHT;对DPPH自由基的清除有一定的效果,但能力差于VC和BHT;对·OH有较强的清除能力,当雄蛾黄酮质量浓度在1.5 mg/mL以上时,清除能力优于VC和BHT;对O2-·有明显的清除作用,当雄蛾黄酮质量浓度1.0 mg/mL以上时,清除能力优于BHT。其清除DPPH自由基、·OH、O2-·的IC50值分别为752.4、617.8、813.4 μg/mL,清除能力在一定范围内随雄蛾黄酮质量浓度的升高而升高,均呈现出一定的量效关系。由此可知,柞蚕雄蛾黄酮具有较强的体外抗氧化活性。
科学已证明与自由基有关的疾病有上百种,其中包括对人类威胁最大的心脑血管病和肿瘤[21]。·OH、O2-·等活性氧自由基是在机体的代谢过程中产生的。在正常的生理状态下,活性氧自由基会处于较低的水平,产生和与清除处于一种的动态平衡状态;但在某些病理状态下,这种平衡将会被打破,从而导致机体的损伤,常常是造成细胞膜和生物大分子的损伤。柞蚕雄蛾黄酮清除自由基的原理是该化合物具有酚羟基,能与活性氧自由基发生反应,形成共振稳定的半醌式自由基,从而中断链式反应。通过体外实验,可以直观地验证受试物的作用效果,为体内实验的开展奠定了实验基础,对阐明其作用机制提供相应的帮助和依据。黄酮类化合物在人体中是不能直接合成的,只能从食物中来获得[26]。本实验对柞蚕雄蛾黄酮类物质的提取及体外抗氧化活性研究,为更好的开发动物性黄酮资源提供了理论依据。柞蚕雄蛾黄酮的抗氧化能力可能是柞蚕雄蛾保肝降酶、增强机体免疫力、降血脂血糖、抗肿瘤及抗衰老等其他功能特性的作用机理之一,目前对于柞蚕雄蛾抗氧化功能的研究还基本处于一个表层阶段,柞蚕雄蛾各种活性成分间的协同作用机制、构效关系等均有待去进一步的深入研究,以能够为柞蚕雄蛾功能性的进一步开发利用提供更好的帮助。
[1] 王连珍. 现代中国柞蚕的地理分布[J]. 辽宁丝绸, 2000(4): 25-26.
[2] 顾美儿, 时连根, 傅淑清. 雄蚕蛾开发利用研究进展[J]. 蚕桑通报, 2007, 38(1): 15-18.
[3] 刘军, 廖森泰, 邹宇晓, 等. 雄蚕蛾营养活性成分的提取方法及工艺条件优化[J]. 蚕业科学, 2013, 39(1): 146-151.
[4] 邹德庆. 柞蚕雄蛾浓缩液2号的初步研究[D]. 北京: 中国农业大学, 2005: 3-4.
[5] 李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 1982: 2254-2255.
[6] ZHANG Shouqin, XU Jun, WANG Changzheng. High hydrostatic pressure extraction of flavonoids from propolis[J]. Journal of Chemical Technology and Biotechnology, 2005, 80(1): 50-54.
[7] TANG Baokun, LEE Yujin, LEE Yuri, et al. Examination of 1-methylimidazole series ionic liquids in the extraction of flavonoids from Chamaecyparis obtuse leaves using a response surface methodology[J]. Journal of Chromatography B, 2013, 933: 8-14.
[8] SHENG Zunlai, WAN Pengfei, DONG Chunliu, et al. Optimization of total flavonoids content extracted from Flos Populi using response surface methodology[J]. Industrial Crops and Products, 2013, 43: 778-786.
[9] ROUTRAY W, ORSAT V. Microwave-assisted extraction of flavonoids: a review[J]. Food Bioprocess Technology, 2012, 5(2): 409-424.
[10] SALLEH L M, RAHMAN R A, SELAMAT J, et al. Supercritical carbon dioxide extraction of bioactive flavonoid from Strobilanthes crispus[J]. Food and Bioproducts Processing, 2010, 88(2): 319-326.
[11] TANG Hongmei, CHANG Lixin, DING Cunbao, et al. Process research on the reflux extraction of flavonoids from rubus crataegifolius leaves[J]. Medicinal Plant, 2012, 3(6): 58-63.
[12] 邹德庆, 范作卿, 李智峰, 等. 柞蚕雄蛾浓缩液生产的部分工艺条件改进与产品质量检测[J]. 蚕业科学, 2012, 38(5): 942-948.
[13] 高晓旭. 柞蚕雄蛾油的提取及应用研究[D]. 沈阳: 沈阳农业大学, 2006: 14-15.
[14] 张鹭, 唐道邦, 肖更生, 等. 雄蚕蛾蛋白制备功能性多肽酶解条件优化研究[J]. 食品科学, 2008, 29(12): 417-421.
[15] 都兴范, 李树英, 李亚洁, 等. 柞蚕雄蛾类甾体激素的分析研究[J].辽宁农业科学, 2005(2): 44-45.
[16] 苏明利, 蔡勇, 吴健辉, 等. 雄蚕蛾酒及其生产方法: 中国, 200910265089.3[P]. 2009-12-30.
[17] 藏楠, 王学英, 孙佳, 等. 不同品种不同发育时期的柞蚕幼虫黄酮类化合物的提取及含量变化[J]. 食品研究与开发, 2008, 29(5): 35-38.
[18] 汪璇, 张建新, 孙长江, 等. 响应面法优化黄粉虫黄酮提取工艺[J].食品科学, 2013, 34(4): 11-16.
[19] TSAI S Y, HUANG S J, MAU J L. Antioxidant properties of hot water extracts from Agrocybe cylindracea[J]. Food Chemistry, 2006, 98(4): 670-677.
[20] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4): 1202-1205.
[21] 夏道宗, 王慧铭, 任琪雅, 等. 高良姜总黄酮的超声萃取及其体外抗氧化作用研究[J]. 中国食品学报, 2009, 9(3): 63-68.
[22] 马虎飞, 王思敏, 杨章民. 陕北野生枸杞多糖的体外抗氧化研究[J].食品科学, 2011, 32(3): 60-63.
[23] 周劝娥, 田呈瑞, 关为, 等. 陕西苦菜叶总黄酮的提取及抗氧化活性的测定[J]. 食品工业科技, 2013, 34(9): 97-101.
[24] 古丽巴哈尔·阿巴拜克力. 新疆琐琐葡萄叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(12): 104-108.
[25] 帕尔哈提·柔孜, 阿依姑丽·艾合麦提, 朱昆, 等. 玫瑰花瓣总黄酮和总多糖的体外抗氧化研究[J]. 食品科学, 2013, 34(11): 138-141.
[26] 潘亚平, 张振海, 丁冬梅, 等. 黄酮类化合物肠道细菌生物转化的研究进展[J]. 食品工业科技, 2013, 38(19): 3239-3245.
Ultrasound-Assisted Extraction and Antioxidant Activity in vitro of Flavonoids from Male Tussah Moth
TIAN Ye, YUE Xi-qing*, YANG Mei
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Objective: To investigate the extraction and antioxidant effects of flavonoids from male tussah moth. Methods: Flavonoids were ultrasonically extracted from male tussah moth with ethanol. The extract was analyzed qualitatively by UV-visible absorption spectroscopy. The optimum extraction conditions were determined by orthogonal array design. The antioxidant activity of flavonoids from male tussah moth investigated by comparing the reducing power and radical scavenging effects against DPPH, hydroxyl and superoxide anion radicals with those of VC and BHT in vitro. Results: The optimum extraction conditions were as follows: ethanol concentration 60%, solid/solvent ratio 1:40, extraction time 45 min and temperature 70 ℃. Under the optimized conditions, the yield of total flavonoids from male tussah moth was 3.72 mg/g in one extraction cycle. The extracted fl avonoids had potent radical scavenging activity in a dose-dependent manner against DPPH, hydroxyl and superoxide anion radicals, and its IC50was 752.4, 617.8 and 813.4 μg/mL, respectively. The hydroxyl radical scavenging activity was stronger than that of VC and BHT, and the superoxide anion radical activity was stronger than that of BHT. Conclusion: Flavonoids from male tussah moth had strong antioxidant effects in vitro.
male tussah moth; flavonoids; extraction; antioxidant activity in vitro
S885.1
A
1002-6630(2014)16-0085-06
10.7506/spkx1002-6630-201416016
2013-10-23
田野(1988—),男,硕士研究生,研究方向为动物性食品科学利用技术。E-mail:tianye74123@126.com
*通信作者:岳喜庆(1966—),男,教授,博士,研究方向为畜产品加工。E-mail:yxqsyau@126.com
