龙眼成花与抗氧化防御体系关系研究
2014-01-16杨子琴陈星星李松刚洪继旺张蕾
杨子琴,陈星星,李松刚,洪继旺,张蕾
(1.中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点开放实验室,海南 儋州 571737;2.河南农业职业学院园艺园林系,郑州 451450)
龙眼成花与抗氧化防御体系关系研究
杨子琴1,陈星星2,李松刚1,洪继旺1,张蕾1
(1.中国热带农业科学院热带作物品种资源研究所/农业部华南作物基因资源与种质创制重点开放实验室,海南 儋州 571737;2.河南农业职业学院园艺园林系,郑州 451450)
以石硖龙眼为材料,通过低温诱导、氧化胁迫、自然低温+药剂处理试验,探讨龙眼成花和抗氧化防御之间的相关性。结果表明,氧化胁迫处理或低温+NO/H2O2促进剂处理均有利于龙眼早花。NO促进剂可抑制成花后期龙眼顶芽POD活性,H2O2清除剂可促使POD和SOD活性大幅上升,表明氧化胁迫信号正调控龙眼成花,而氧化防御体系负调控龙眼成花。
龙眼;成花;低温诱导;氧化胁迫;氧化防御
龙眼(Dimocarpus longanLoureiro)正常情况下(即正造龙眼)成花需经冬季低温诱导,但龙眼可在非花季通过催花药剂处理诱导成花,并形成产量,使经典花芽分化理论面临新挑战。诱导成花药剂中含有强氧化剂氯酸钾,会造成胁迫。对于龙眼而言,低温诱导以及氧化胁迫存在共同特征——都会导致活性氧累积,使植物处于胁迫状态[1-2]。
活性氧信号在调节植物发育和应对胁迫反应方面具有重要作用,但活性氧如何调节花芽分化则鲜有报道。Lokhande等发现,拟南芥开花前抗坏血酸过氧化物酶活性越高,其开花越迟;氧化胁迫越强,则开花越早。为此,提出活性氧是诱导开花的一个因子[3];另有证据表明,活性氧的形成与花发育过程中转录因子表达的上调有关[4]。Zafra等发现油橄榄成花过程有赖于H2O2的参与[5]。由此推测,活性氧可能也参与龙眼成花调控。但环境胁迫所诱导氧化胁迫及氧化防御信号在龙眼成花中的作用,尚待进一步探索。本研究立足龙眼正造及反季节成花的实际情况,针对胁迫在龙眼成花中的作用,通过胁迫信号的发生、促进及阻断措施,探讨胁迫所产生的抗氧化防御体系与成花之间的关系,旨在挖掘龙眼成花的诱导机理,同时为其他热带果树周年生产研究提供理论基础。
1 材料与方法
1.1 试验材料
试验材料为8年生石硖龙眼(Dimocarpus lon⁃ganLoureiro)植株。
1.2 试验方法
人工低温胁迫:采用低温/高温,即8~10℃(12 h)/18~22℃(12 h),光照模拟自然光,在末次冬梢成熟后进行人工低温诱导,胁迫后42 d侧花原基形成。低温诱导试验系统以单株为试验单元,5次重复。每隔7 d采集样品(叶片与顶芽)1次。
氧化胁迫:采用正造季节摘除花序的龙眼树(在正常开花时摘除花序,以保证龙眼在催花时能蓄积足够养分),在新梢抽生3次后进行催花,催花药剂为:土施氯酸钾+氯化钾,诱导成花(w氯酸钾∶w氯化钾=6∶4,0.5 kg·m-1树冠直径),催花后28 d侧花原基形成。氧化胁迫试验以单株为试验单元,5次重复。每隔7 d采集样品(叶片与顶芽)1次。
药剂处理:冬季自然低温下,龙眼树末次冬梢成熟后20 d,对梢芽喷施药剂,以单株为试验单元,5次重复。每种药剂处理对每株树喷施15个枝梢,每天采集样品(顶芽)1次,至侧花原基形成为止。药剂处理包括:ABA 100 mg·L-1;ABA阻断剂—钨酸钠(STD)5 mmol·L-1;H2O2清除剂—二甲基硫脲(DMTU)1 g·L-1;H2O2发生剂—百草枯(MV) 20 mg·L-1;NO发生剂—硝普酸钠(SNP)0.1 mmol·L-1;NO合酶抑制剂(L-NNA)0.1 mmol·L-1;以喷施水为对照。
SOD和POD活性测定:酶液提取参照李玲方法[6];SOD活性测定参照李合生方法[7];POD活性测定参照高俊凤方法[8]。
2 结果与分析
2.1 不同药剂处理对龙眼成花的效果分析
施药12 d后,各药剂处理间表现出很大差异:SNP、MV和ABA可显著促进龙眼形成早花,而L-NNA及DMTU对龙眼成花有抑制作用,STD对龙眼成花影响不显著(见图1)。
2.2 龙眼成花与SOD活性的关系
在人工低温诱导情况下,龙眼叶片和顶芽均出现SOD活性的上升高峰,且顶芽出峰时间早于叶片。在冬季末梢成熟时,叶片SOD活性为130.13 U·g-1,随后活性变化并不大,直至蟹眼期(枝梢成熟后42 d)叶片中SOD活性突然出现上升并达到峰值(430.37 U·g-1),随后迅速下降到枝梢成熟时水平。顶芽SOD活性较叶片略高,在枝梢成熟时顶芽中SOD活性为196.51 U·g-1,在枝梢成熟后14 d达到高峰572.30 U·g-1;并在枝梢成熟后小幅下降到401.70 U·g-1,随后下降到枝梢成熟初期水平(见图2)。由此推测,在龙眼成花前期,叶片中有稳定自由基产生,而在侧花原基形成时(42 d)叶片不需要丰富的自由基。顶芽在诱导初期,迅速出现SOD分解自由基,但在侧花原基形成前后SOD活性降低,可能是为顶芽聚集自由基做准备。
氧化胁迫龙眼催花后,叶片SOD活性变化并不大,徘徊在82.90~142.61 U·g-1;但是顶芽SOD活性出现上升,由催花之前的209.07 U·g-1上升到304.12 U·g-1(7 d),侧花原基形成时(28 d)下降到催花前水平。在氧化胁迫龙眼侧花原基形成前,顶芽的SOD活性始终高于叶片(见图3)。可见,龙眼成花过程中,在胁迫环境形成初期,SOD活性在顶芽迅速上升,并在侧花原基形成之时下降到胁迫前水平。因此,可以推测植物在应对外界胁迫时会打破植物体固有的酶平衡,而在侧花原基形成前后,由于需要自由基刺激顶芽成花,故SOD活性恢复到胁迫前水平,有利于胁迫状态下自由基的增加。

图1 不同药剂处理对龙眼成花的效果Fig.1 Effect of different agents treatments on longan flower
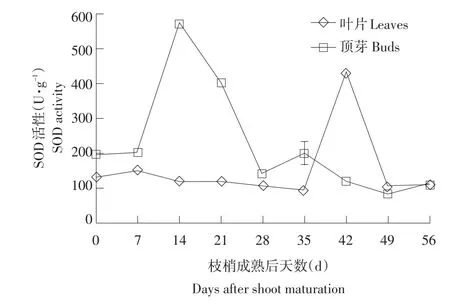
图2 低温诱导龙眼树成花过程中SOD活性的变化Fig.2 Changes of SOD activity in various parts of low temperature induced longan trees during flower bud formation
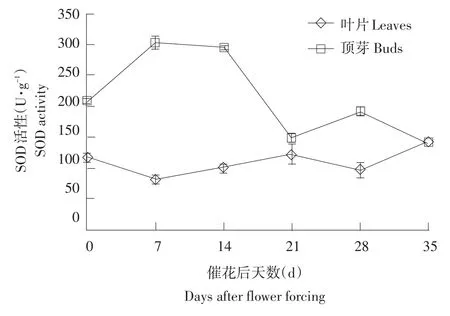
图3 氧化胁迫龙眼树成花过程中SOD活性的变化Fig.3 Changes of SOD activity in various parts of oxidative stress longan trees during flower bud formation
ABA、H2O2、NO为胁迫环境下诱发的信号物质,为探究ABA、H2O2、NO信号在龙眼成花过程中的作用,试验中采用信号加强和信号清除剂手段,从正反两方面验证其在成花过程中的作用。试验结果表明,在药剂处理之后均诱发SOD活性迅速上升,尤其以DMTU和SNP最为明显(见图4)。DMTU处理可显著增加顶芽SOD活性,由处理前的149.57 U·g-1上升至674.92 U·g-1,随后下降,并在侧花原基形成时(7 d)再次上升至高峰686.89 U·g-1;SNP处理导致顶芽SOD活性由初期的149.57 U·g-1上升至498.85 U·g-1,随后下降,与DMTU有相同趋势,在侧花原基形成时(7 d)再次上升至高峰472.70 U·g-1;STD处理后导致顶芽SOD活性小幅上升,仅由149.57 U·g-1上升至252.07 U·g-1,随后下降至111.64 U·g-1,低于5 d时对照水平(177.42 U·g-1);ABA在处理1 d后顶芽SOD活性即上升至367.27 U·g-1,随后下降至与对照相似水平;MV处理同样造成龙眼顶芽SOD活性迅速上升至430.01 U·g-1,随后下降至300.12 U·g-1,并在侧花原基形成前(处理后5 d)再次上升;L-NNA处理1 d后导致龙眼顶芽SOD活性上升至413.89 U·g-1,随后下降,并在侧花原基形成时再次上升至372.49 U·g-1(见图4)。
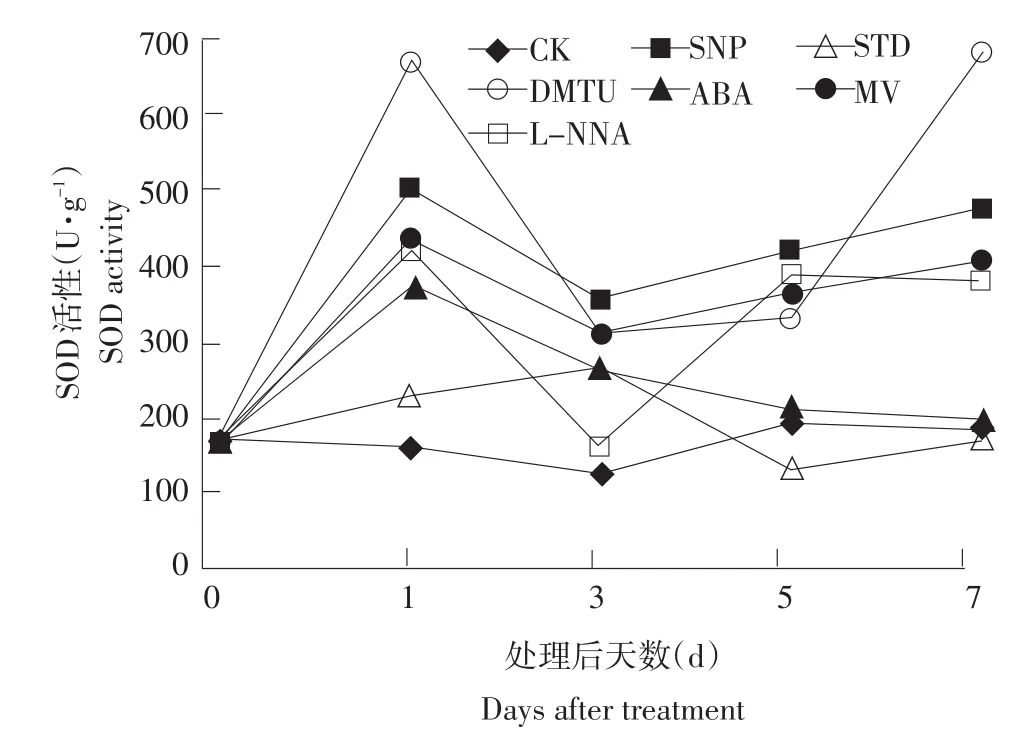
图4 低温诱导龙眼树成花过程中不同药剂处理对SOD活性的影响Fig.4 Effects of different agents treatments on SOD activity in bud of low temperature induced longan trees after during flower bud formation
龙眼顶芽对氧自由基的感应量应有一定适应范围,因此在应对不同药剂处理后,表现出不同的SOD活性变化,其中尤以H2O2清除剂处理后对SOD活性影响最大,这可能是由于外施DMTU导致H2O2锐减,而龙眼成花需要较多H2O2,因此SOD活性增强分解了自由基,并实现这一转变向H2O2发生。而NO发生剂SNP处理也导致SOD活性的上升,这可能是由于NO在H2O2胁迫信号通路的上游,NO对H2O2的产生具有促进作用。SNP处理导致NO大量产生,从而促进其下游氧自由基的量相应增加,因而诱发SOD活性上升,进而降低自由基在组织中的含量。
2.3 龙眼成花与POD活性的关系
在成花过程中,低温诱导龙眼各部位POD活性表现不同,叶片POD活性远低于顶芽活性(见图5)。在整个花芽发育过程中,叶片POD活性变化不大,徘徊在273.16~557.16 U·g-1,枝梢成熟时叶片POD活性为340.26 U·g-1,并在侧花原基形成之前上升至最高活性557.16 U·g-1;在枝梢成熟时(0 d),顶芽POD活性为1 264.23 U·g-1,在枝梢成熟后14 d跌进低谷(546.43 U·g-1),并在枝梢成熟后21 d再次上升(1 160.94 U·g-1),随后在侧花原基形成时(42 d)再次跌到低谷(544.96 U·g-1)。
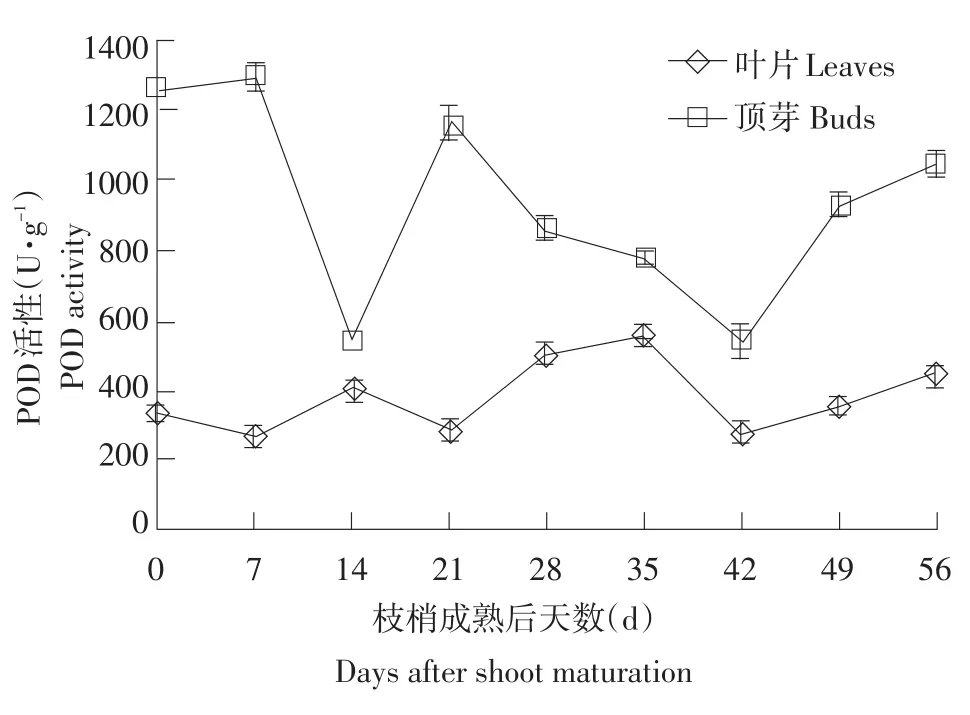
图5 低温诱导龙眼树成花过程中POD活性的变化Fig.5 Changes of POD activity in various parts of low temperature induced longan trees during flower bud formation
氧化胁迫龙眼催花之前,叶片中POD活性高于顶芽。催花之后,叶片中POD活性迅速下降,由催花前的716.12 U·g-1下降到386.83 U·g-1,并在21 d跌至低谷(188.58 U·g-1);顶芽中POD活性在催花后变化不大,始终在316.13~442.52 U·g-1上下波动(见图6)。
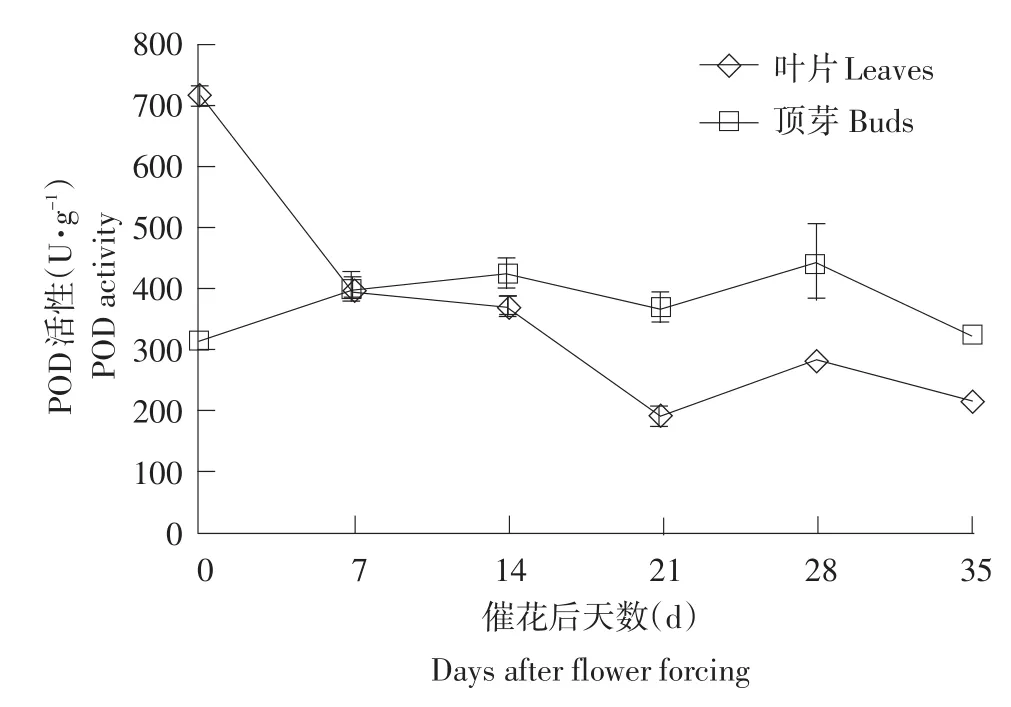
图6 氧化胁迫龙眼树成花过程中POD活性的变化Fig.6 Changes of POD activity in various parts of oxidative stress longan trees during flower bud formation
药剂处理1 d后,除STD处理之外,其他各处理均导致POD活性上升,尤以SNP处理在施药1 d后的活性上升幅度最大,达954.71 U·g-1;施药3 d后,STD、ABA、L-NAA的POD活性均与对照相持平(443.87 U·g-1),此时SNP处理POD活性为636.59 U·g-1,DMTU处理为686.61 U·g-1,MV处理为523.71 U·g-1;施药5 d后,仍以SNP、DMTU处理POD活性最高,分别达727.16和751.90 U·g-1,其他处理均略高于对照水平(516.01 U·g-1);而在施药7 d后,DMTU、ABA和L-NNA的POD活性最高,分别达641.78、609.16和647.64 U·g-1其次为SNP、STD及MV,有相近POD活性,分别为484.97、430.48和480.68 U·g-1,均高于对照的262.74 U·g-1(见图7)。

图7 低温诱导龙眼树成花过程中不同药剂处理对POD活性的影响Fig.7 Effects of different agents treatments on POD activity in bud of low temperature induced longan trees during flower bud formation
前期试验已证实顶芽在龙眼成花过程中对氧自由基的含量有较高要求,而其精密的调控模式也绝非SOD一种酶可独立完成。通过加强NO信号的手段发现POD活性剧烈上升,而POD的作用为催化H2O2形成H2O和O2。因此,进一步确定NO在H2O2胁迫信号通路的上游调控龙眼成花。
3 讨论与结论
3.1 胁迫信号与龙眼成花
环境胁迫会干扰细胞正常代谢,诱发活性氧(ROS)积累,产生氧化胁迫。因而,氧化胁迫是次级胁迫,是环境胁迫共有的组成部分[9];而植物对氧化胁迫适应能力是其种群延续的重要部分[10]。本研究发现任何氧化胁迫产物或产物促进剂处理,均可导致龙眼早花,氧化胁迫阻断剂处理可导致龙眼成花延迟。这说明H2O2、NO参与龙眼成花信号调控过程,与Zhou等荔枝研究结果相同[11]。
3.2 SOD活性变化与龙眼成花
SOD主要功能是清除超氧阴离子自由基(O2-·),并防御活性氧或其他过氧化物自由基对细胞膜系统的伤害,减少自由基对有机体的毒害。拟南芥晚花突变体的保水能力和SOD活性均高于野生型,说明SOD活性越高开花越晚[10],与本研究结果一致,在龙眼成花过程中,经DMTU处理的龙眼顶芽SOD活性远高于MV处理,表现为SOD活性与龙眼成花呈负相关,SOD在成花中作用有赖于其对顶芽中H2O2调控实现。
3.3 POD活性变化与龙眼成花的关系
植物细胞内存在的清除自由基的酶保护系统主要包括SOD、CAT、POD,该系统的SOD能够歧化超氧化物阴离子自由基(O2-·),而POD和CAT则催化H2O2形成H2O和O2。SOD、CAT、POP的协同作用可降低氧自由基的积累及阻碍自由基(O2-·)、H2O2向破坏性极强的-OH转化,避免或减轻自由基对生物大分子如核酸、蛋白质等的降解破坏,对生物膜损伤[12]。SNP处理导致NO大量产生,导致H2O2的量骤增,进而诱发POD活性上升,分解H2O2。
综上,认为H2O2和NO在龙眼成花过程中具有重要作用,NO在H2O2上游调节龙眼成花,但其深层作用机理有待深入研究。
[1]Pastori G,Foyer C H,Mullineaux P.Low temperature-induced changes in the distribution of H2O2and antioxidants between the bundle sheath and mesophyll cells of maize leaves[J].Journal of Experimental Botany,2000,342(51):107-113.
[2]Airaki M,Leterrier M,Mateos R M,et al.Metabolism of reactive oxygen species and reactive nitrogen species in pepper(Capsicum annuumL.)plants under low temperature stress[J].Plant,Cell& Environment,2012,35(2):281-295.
[3]Lokhande S D,Ogawa K,Tanaka A,et al.Effect of temperature on ascorbate peroxidase activity and flowering ofArabidopsis thali⁃anaecotypes under different light conditions[J].Journal of Plant Physiology,2003,160(1):57-64.
[4]Balazadeh S,Jaspert N,Arif M,et al.Expression of ROS-respon⁃sive genes and transcription factors after metabolic formation of H2O2in chloroplasts[J].Frontiers in Plant Science,2012(3):234.
[5]Zafra A,Rodríguez-García M I,Alché J D.Cellular localization of ROS and NO in olive reproductive tissues during flower devel⁃opment[J].BMC Plant Biology,2010(10):36.
[6]李玲.植物生理学模块实验指导[M].北京:科学出版社,2009.
[7]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[8]高俊凤.植物生理学实验技术[M].北京:世界图书出版公司, 2000.
[9]Smirnoff N.Plant resistance to environmental stress[J].Current Opinion in Biotechnology,1998,9(2):214-219.
[10]汪本勤,陈曦,向成斌.SOD活性增高的拟南芥晚花突变体具有增强的非生物胁迫耐受性[J].植物学通报,2007,24(5): 572-580.
[11]Zhou B,Li N,Zhang Z,et al.Hydrogen peroxide and nitric oxide promote reproductive growth in Litchi chinensis[J].Biologia Plan⁃tarum,2012,56(2):321-329.
[12]杨东霞.不同浓度Na2SO3处理对大花惠兰叶片内SOD、CAT活性的影响[J].辽东学院学报,2007,14(2):77-79.
Relationship between longan flower and oxidative defense system
YANG Ziqin1,CHEN Xingxing2,LI Songgang1,HONG Jiwang1,ZHANG Lei1
(1.Tropical Crops Genetic Resources Institute,Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Crop Gene Resources and Germplasm Enhancement in Southern China,Danzhou Hainan 571737,China;2. Department of Horticulture,Henan Vocational College ofAgriculture,Zhengzhou 451450,China)
To study whether a correlation exists between longan flower and oxidative defense,low temperature induction,oxidative stress,natural low temperature combined medicament spraying in‘shixia’longan buds and leaves were tested.The results showed that oxidative stress and low temperature combined NO/H2O2generator treatment displayed significantly effect to longan early flower.NO promoter could inhibit POD activity of longan buds in the late flower period,and H2O2scavenger treatment had led to a POD and SOD activity increased sharply.All the results showed that longan flower signals were positive regulated by oxidative stress,and oxidative defense system negative regulation of longan flowers.
longan;flower;low temperature induction;oxidative stress;oxidative defense
S667.2
A
1005-9369(2014)11-0037-06
2014-05-13
中央级公益性科研院所基本科研业务费专项资金项目(1630032014017);现代农业产业技术体系专项资金项目(CARS-33-25)
杨子琴(1981-),女,助理研究员,博士,研究方向为果树栽培生理。E-mail:yangziqin1@163.com
时间2014-11-21 16:42:32[URL]http://www.cnki.net/kcms/detail/23.1391.S.20141121.1642.013.html
杨子琴,陈星星,李松刚,等.龙眼成花与抗氧化防御体系关系研究[J].东北农业大学学报,2014,45(11):37-42.
YANG Ziqin,CHEN Xingxing,LI Songgang,et al.Relationship between longan flower and oxidative defense system[J]. Journal of Northeast Agricultural University,2014,45(11):37-42.(in Chinese with English abstract)
