农杆菌介导稻瘟病菌绿色荧光蛋白(GFP)遗传转化研究
2014-01-16张俊华刘烨韩雨桐潘春清王中业张淋淋崔凯旋
张俊华,刘烨,韩雨桐,潘春清,王中业,张淋淋,崔凯旋
(东北农业大学农学院,哈尔滨 150030)
农杆菌介导稻瘟病菌绿色荧光蛋白(GFP)遗传转化研究
张俊华,刘烨,韩雨桐,潘春清,王中业,张淋淋,崔凯旋
(东北农业大学农学院,哈尔滨 150030)
稻瘟病是水稻生产中的主要病害,抗病品种选育和利用是控制稻瘟病最有效措施。研究稻瘟病菌与水稻品种互作机制是培育抗病品种的基础。GFP(Green fluorescent protein)基因因其具有片段小、易与多种不同蛋白质N端或C端融合等特点,广泛应用于病菌与寄主植物互作研究中。研究以pBGgHg作为转化载体,根癌农杆菌C58C1作为转化介体,转化稻瘟病菌的强致病菌株py1022。研究发现,250 μg·mL-1潮霉素B能完全抑制稻瘟病菌生长,利用根癌农杆菌介导稻瘟病菌遗传转化的最佳条件为:稻瘟病菌分生孢子浓度为1×105个·mL-1,共培养时间为4 d,共培养AS浓度为200 μmol·mL-1,共培养温度为28℃。随机挑取8个转化子分别进行PCR扩增后测序、荧光显微镜下观察、致病力及稳定性测定,结果表明GFP成功转化到稻瘟病菌中,可为稻瘟病菌与水稻品种的互作机制研究提供技术支撑。
稻瘟病菌;农杆菌介导遗传转化;绿色荧光蛋白(GFP)
稻瘟病是当前水稻生产中主要病害,严重影响水稻产量,稻瘟病在整个水稻生育期均有发生,流行年份一般发病田块损失10%~40%,如不及时防治,局部田块会颗粒无收[1]。稻瘟病菌生理分化明显,变异速度快,抗病品种推广后3~5年就丧失抗病性,特别是目前单一抗病品种大面积种植,造成稻瘟病菌定向选择,导致产生新的致病力强的稻瘟病菌生理小种,造成稻瘟病大面积流行,给水稻生产带来经济损失。因而明确稻瘟病抗病机制及稻瘟病菌致病机制迫在眉睫,建立一套简单、快速、高效的稻瘟病菌转化体系是研究稻瘟病菌分子致病机制及致病相关基因克隆的基础。微生物遗传转化方法有多种,通过PEG介导的原生质体法、REMI(Restrictioenzyme mediated in⁃tegration)和根癌农杆菌介导(Agrobacterium tumefa⁃ciens-mediated transformation,AtMT)等方法已成功实现多种丝状真菌遗传转化,为植物病原真菌分子致病机制研究提供有效工具。根癌农杆菌介导的转化系统,直接以真菌孢子或菌丝为受体,免除PEG介导和REMI等转化方法中原生质体制备的复杂过程,减少转化过程中其他因素的影响,增加转化稳定性和效率。同时根癌农杆菌介导的遗传转化由于具有外源基因整合机制比较清楚、拷贝数较低、遗传稳定等诸多优点而得到广泛应用。农杆菌介导的遗传转化最初主要用于植物遗传转化的研究,并在拟南芥[2]、烟草[3]、水稻[4]等作物中都成功得到农杆菌的转化株系。这种方法已应用到真菌遗传转化中,目前已在Fusarium oxysporum[5]、Aspergillus awamori[6]、Colletotrichum lagenarium[7]、Magnaporthe grisea[8-12]等真菌中转化成功。农杆菌转化产生的真菌转化子很容易发生表型以及致病性突变,表型与T-DNA共分离几率较高,为研究真菌的功能基因提供可能,农杆菌介导的植物病原真菌转化方法现已成为植物病理学研究重要技术手段。
研究病原菌与植物互作的传统方法有组织印迹法、放射性标记核酸探针法和GUS染色法等,这些均为非活体检测,因此有一定局限性。而绿色荧光蛋白(Green fluorescent protein,GFP)能有效克服上述传统方法不足,可直观、实时监测病原菌发生、定殖和侵染过程,目前已成为研究病原菌与植物互作的有效方法。国内外对于利用农杆菌介导稻瘟病菌遗传转化报道较多[8-12],但将GFP转化到稻瘟病菌报道不多。本研究以一种农杆菌C58C1及携带潮霉素抗性的质粒pBGgHg为介导,以强致病力菌株py1022为出发菌株,产生稻瘟病菌的T-DNA插入转化子,旨在建立一种简单、快速、高效的稻瘟病菌转化体系,并将GFP成功转化到稻瘟病菌中,为稻瘟病菌功能基因组研究奠定基础,为稻瘟病菌致病机制和水稻品种抗病机制研究提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 供试菌株和质粒
Magnaporthe grisea菌株:py1022,2010年8月在东北农业大学香坊实验实习基地采集病株,并进行分离,经过鉴定为强致病性菌株。
质粒:pBGgHg由美国宾夕法尼亚州立大学植病系提供。
农杆菌菌株:C58C1由东北农业大学大豆研究所提供。
1.1.2 培养基
PDA培养基:马铃薯200 g,葡萄糖15 g,琼脂20 g,加水定容至1 000 mL;
燕麦片培养基:燕麦片50 g,琼脂20 g,加水定容至1 000 mL;
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl10 g,加水定容至1 000 mL;
YEB培养基:细菌培养用胰化蛋白胨(Bacto⁃tryptone)10 g,细菌培养基酵母提取液(Bactoyeast-extract)10 g,NaCl 5 g,加水定容至1 000 mL,pH 7.0;
MM培养基:磷酸氢钾缓冲液10 mL(K-buf⁃fer:200 g·L-1K2HPO4,145 g·L-1KH2PO4,pH 7.0),硫酸镁-氯化钠溶液20 mL(M-N buffer:30 g·L-1MgSO4·7H2O,15 g·L-1NaCl),20%葡萄糖(W/V)10 mL,1%CaCl2·2H2O(W/V)1 mL,0.01% FeSO4(W/V)10 mL,20%(NH4)2SO4(W/V)2.5 mL,pH 7.0,加水定容至1 000 mL[8]。
IM液体培养基:K-buffer(pH 4.9)0.8 mL,M-N buffer 20 mL,1%CaCl2·2H2O(W/V)1 mL,20%葡萄糖(W/V)10 mL,20%(NH4)2SO4(W/V)2.5 mL,50%甘油(W/V),10 mL,0.01%FeSO4(W/ V)10 mL,1 mg·mL-12-(N-吗啉基)乙磺酸钠(MES)10 mL,加水定容至1 000 mL。用于稀释农杆菌和稻瘟病菌分生孢子。
IM固体培养基:在1 000 mL IM液体培养基基础上加卡拉胶23 g,用于诱导农杆菌侵染稻瘟病菌。
1.1.3 抗生素及生化试剂
各种抗生素(潮霉素B、卡那霉素、头孢噻肟钠、利福平、链霉素)均购自Sigma公司;限制性内切酶、TagDNA聚合酶购自NEB公司;其他试剂为国产分析纯,购自哈尔滨莱博赛斯科技发展有限公司。
1.2 农杆菌转化和培养
质粒pBGgHg采用冻融法转化到农杆菌C58C1中,从LB平板(含50 μg·mL-1卡那霉素)挑选农杆菌单斑接种于7 mL LB液体培养基(含50 μg·mL-1卡那霉素)中,240 r·min-1,28℃过夜培养,第2天用MM液体培养基(含200 mmol·L-1乙酰丁香酮,AS)稀释到OD660大约0.15,继续震荡培养6 h,至OD660为0.6~0.8。
1.3 稻瘟病菌分生孢子培养
将经纯化鉴定的野生型稻瘟病菌强致病菌株py1022接种到燕麦片培养基中,采用蓝黑色照射,26℃培养7~10 d,待其产生大量分生孢子时,用灭菌棉签轻刷菌体表面,洗下孢子,用双层灭菌纱布过滤分生孢子,用血球计数板计数孢子浓度,用灭菌ddH2O调整孢子浓度为1×107个·mL-1备用。
1.4 稻瘟病菌对潮霉素B敏感性测定
配置含有潮霉素不同浓度梯度(0、50、100、150、200、250、300 μg·mL-1)的PDA平板,将活化后的稻瘟病菌打成菌饼(直径为5 mm)接种在平板中央,26℃培养7 d,观察菌落生长情况,并测量菌落直径,每个处理设置4次重复。
1.5 农杆菌介导稻瘟病菌遗传转化
取100 μL培养好的农杆菌(含GFP)菌液和100 μL稀释好的稻瘟病菌孢子悬浮液混合,将混合液(200 μL)均匀涂于IM平板上的硝酸纤维素膜表面,22℃共培养48 h,然后将硝酸纤维素膜转移到含潮霉素和抗生素的选择平板上,将平板置于22℃下培养到转化子出现。
1.6 不同条件对转化效率的影响
影响稻瘟病菌转化效率主要因子包括:稻瘟病菌分生孢子浓度(103、104、105、106、107个·mL-1)、共培养时间(1、2、3、4、5、6 d)、AS浓度(0、50、100、150、200、250、300 μmol·mL-1)、共培养温度(22、24、26、28、30℃),逐一进行单因子条件试验。后续因子优化是在前面因子已确定的最优条件下进行,每个处理设3个重复。
1.7 转化子遗传稳定性测定
为测定转化子的遗传稳定性,随机挑选8个转化子,接种到不含潮霉素B的PDA培养基中,26℃下培养1周后,选取平皿边缘的菌丝转接新的PDA培养基中,按以上方法重复4次,将第5代转化子接种到含潮霉素B(250 μg·mL-1)的PDA培养基中,挑取转化子的菌丝和分生孢子制成玻片,在Nikon90i荧光显微镜下进行荧光观察和照相,同时以野生原始菌株为对照。
1.8 转化子的致病性测定
参照刘明娟等方法[9],采用离体叶片接种进行致病性测定。在培养皿(直径为9 cm)中铺3层吸水纸,用水浸透后保湿。再将出苗后10 d的水稻(品种为丽江新团黑谷水稻品种)叶片剪成长约4 cm小段,放在吸水纸上,每个平皿放3片叶片,然后用蘸过水的手指轻轻擦一下水稻叶片表面,以将孢子液滴留在叶片表面。将待测的8个转化菌株和野生菌株的分生孢子分别配成2×104个·mL-1的悬浮液,取10 μL分生孢子液滴在叶片上,每个处理3个平皿,26℃下光照培养5 d,对比该稻瘟病菌转化前后致病性的变化。
1.9 转化子验证
1.9.1 转化子PCR验证
参考张俊华等方法提取DNA[13]。步骤如下:将真菌菌丝用液氮快速研磨,取25 mg菌丝粉末置于1.5 mL离心管,加入500 μL真菌DNA提取液(50 mmol·L-1Tris-HCl;150 mmol·L-1NaCl;100 mmol·L-1EDTA)震荡混匀;加入50 μL 10%SDS,小心震荡后37℃水浴1 h;然后加入75 μL 5 mol·L-1NaCl,轻柔混匀;再加入65 μL CTAB/NaCl混合液(浓度为0.7 mol·L-1NaCl溶液中加入10%CTAB),混匀后65℃水浴15 min;加入等量氯仿/异戊醇(24∶1),剧烈震荡混匀后12 000 r·min-1离心10 min;将上层水相转移到干净离心管,加入0.6倍体积的异丙醇,-20℃放置2 h;离心收集沉淀并用70%乙醇洗涤两次,待沉淀干燥后用100 μL无菌ddH2O溶解;加RNA酶H至终浓度50 μg·mL-1,37℃保温2 h消化RNA,-20℃保存备用。
根据载体中含有潮霉素序列设计引物,PCR进行扩增,以验证转化子中是否含hygromycin基因。引物序列为:Forward:5′GTGCTTTCAGCTTCGATG 3′,Reverse:5′AACCAAGCTCTGATAGAG 3′。反应体系为:10×PCR buffer 2.5 μL,MgCl2(25 mmol·L-1)2 μL,dNTP(10 mmol·L-1)0.5 μL,上游引物(20 mmol·L-1)0.5 μL,下游引物(20 mmol·L-1)0.5 μL,模板DNA 0.5 μL,Taq酶(5 U·μL-1)0.2 μL,加ddH2O 25 μL,混合后稍离心。反应程序为94℃预变性3 min,94℃,45 s;52℃,30 s;72℃,1 min,共30个循环,72℃,延伸7 min。取8 μL扩增产物用1.0%琼脂糖电泳进行检测。
1.9.2 转化子荧光显微镜观察鉴定
将转化子分别用PDA培养基培养菌丝和燕麦培养基进行菌丝和分生孢子培养,挑取转化子分生孢子和菌丝样品制片,Nikon 90i荧光显微镜下进行荧光观察,照相。
2 结果与分析
2.1 农杆菌介导稻瘟病菌遗传转化
2.1.1 稻瘟病菌对潮霉素B的敏感性
将稻瘟病菌菌丝接种到含不同浓度潮霉素B的PDA培养基平板上,培养7 d后测量菌落直径,结果如下:50~200 μg·mL-1潮霉素B对稻瘟病菌生长有不同程度抑制作用。但在此范围内不能完全抑制菌丝生长;250 μg·mL-1潮霉素B能完全抑制稻瘟病菌生长。因此本研究选择250 μg·mL-1潮霉素B进行阳性转化子筛选,如图1所示。
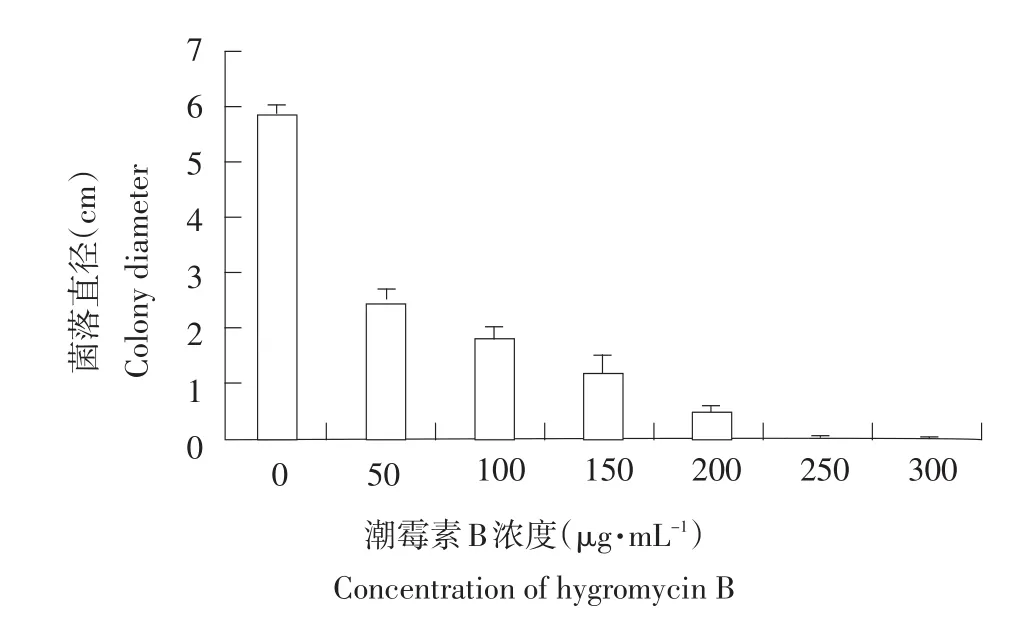
图1 稻瘟病菌(py1022)对潮霉素B的敏感性测定Fig.1 Determination of sensitivity of Magnaporthe grisea(py1022)to hygromycin B
2.1.2 稻瘟病菌分生孢子浓度对转化效率的影响
不同浓度稻瘟病菌分生孢子影响稻瘟病菌的转化效率(见图2)。稻瘟病菌转化成功要求孢子浓度达到一定数值,随着孢子浓度的升高转化效率升高,但当孢子浓度升高到105个·mL-1时,转化效率最大,随后转化效率下降。
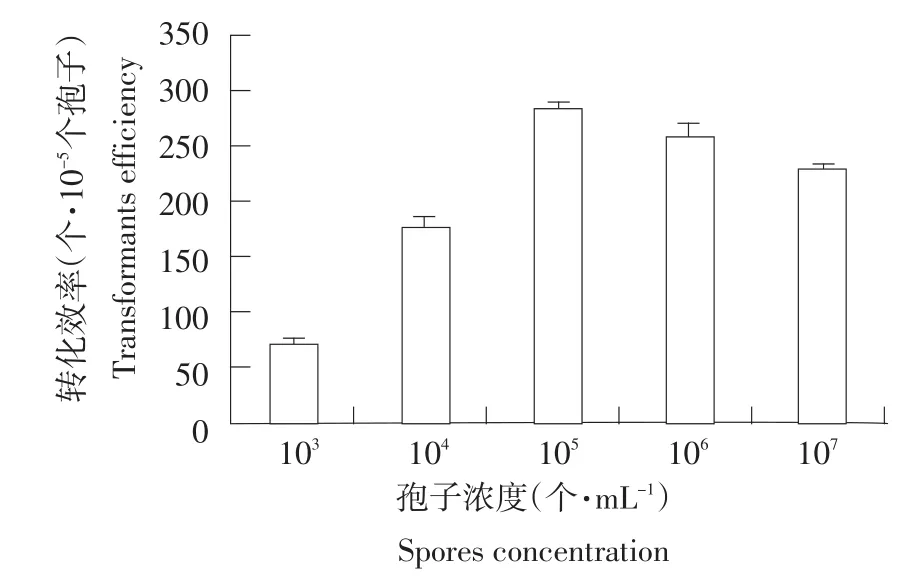
图2 孢子浓度对转化效率的影响Fig.2 Effects of spores concentration on transformation efficiency
2.1.3 共培养时间对转化效率的影响
将共培养时间设置为1、2、3、4、5、6 d五个梯度,不同培养时间产生的转化子数不同(见图3)。共培养1 d,无转化子产生;共培养2 d,可得到少量转化子,随着共培养时间延长,转化效率明显升高;共培养4 d后,平均转化效率为289个转化子/105个孢子,转化率达到最高;继续延长培养时间,转化效率逐渐下降。

图3 共培养时间对转化效率的影响Fig.3 Effects of co-culture time on transformation efficiency
2.1.4 共培养时AS浓度对转化效率的影响
AS浓度对稻瘟病菌转化效率的影响见图4。不添加AS时,仅得到极少量转化子,转化效率随AS浓度增加而有所提高,当AS浓度为200 μmol·mL-1时,转化效率最大,每105个孢子可得到285个转化子。当AS浓度上升为250和300 μmol·mL-1时,转化效率分别为262个转化子·10-5个孢子和181个转化子·10-5个孢子。
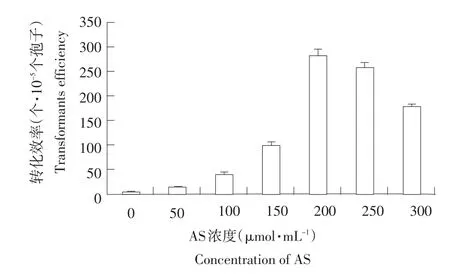
图4 AS浓度对转化效率的影响Fig.4 EffectsofASconcentrationontransformationefficiency
2.1.5 共培养温度对转化效率的影响
将共培养温度设置为22、24、26、28和30℃共五个梯度,并按前文确定的最优条件进行转化。由图5可知,28℃时转化子数量为最多,随后转化子数量开始明显下降。因此,转化子最佳共培养温度为28℃。
2.1.6 转化子致病力测定
将8个转化的稻瘟病菌及未转化的野生稻瘟病菌同时接种感病水稻品种丽江新团黑谷(见图6),发现GFP转化后稻瘟病菌致病力与未转化前野生稻瘟病菌致病力基本一致。说明转入的GFP基因对稻瘟病菌致病力几乎无影响。
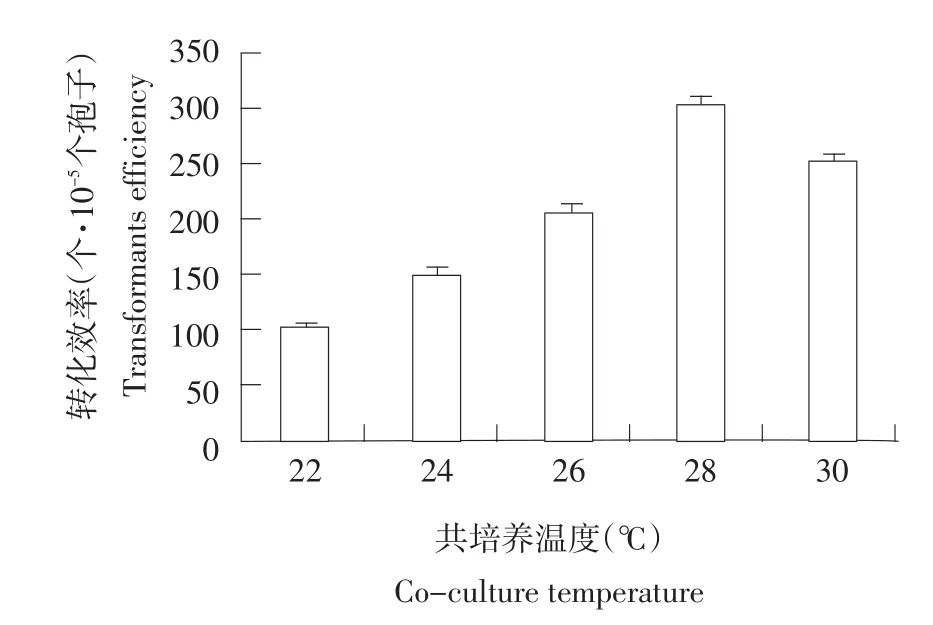
图5 共培养温度对转化效率的影响Fig.5 Effects of co-culture temperature on transformation efficiency

图6 转化后稻瘟病菌的致病力测定Fig.6 Pathogenicity determination of Magnaporthe grisea transformed with GFP
2.1.7 转化子的稳定性
随机选取8个转化子连续转接5代,然后转接到含有潮霉素B250 μg·mL-1的PDA培养基上培养36 h后,发现菌落直径为4~5 cm,表明这些转化子对潮霉素B具有抗性,GFP基因已转入稻瘟病菌的基因组中,并可以稳定遗传。
2.2 转化子验证
2.2.1 转化子的PCR验证
根据GFP载体中含有的潮霉素B基因序列设计引物,分别以载体DNA和未转化的稻瘟病菌DNA作为阳性和阴性对照,对转化子的DNA进行PCR扩增,然后进行测序,以确定转化是否成功。从图7中可以看出,8个需验证的转化子中,都可扩增出与载体一致的大小约为750 bp的片段,可见这些转化子极有可能都是阳性克隆。将1~8转化子扩增的条带进行回收测序,在NCBI将转化子序列与潮霉素B的基因序列进行比对,其同源性为99.6%,由此可证明已把含有GFP的载体成功转入稻瘟菌中。

图7 转化子PCR验证Fig.7 PCR verification for transformant
2.2.2 转化子在光学显微镜下的验证
挑取转化子和野生菌株菌丝和分生孢子在荧光显微镜下观察,结果野生菌株的菌丝和分生孢子没有观察到任何荧光,而转化子的菌丝和分生孢子均能发出绿色荧光,证明已把含有GFP的载体成功转入水稻稻瘟病菌中。
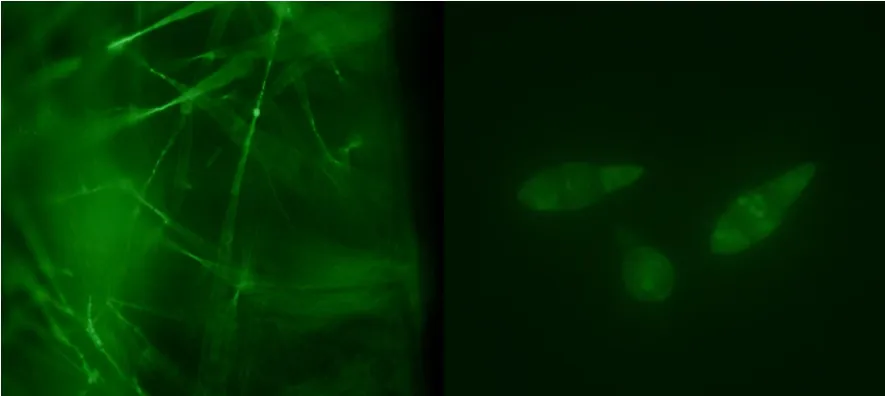
图8 转化子在光学显微镜下验证Fig.8 Transformants verification with optical microscope
3 讨论
稻瘟病一直以来是困扰水稻生产的主要病害,抗病品种选育和利用是解决稻瘟病危害的首要措施,但由于稻瘟病菌变异速度快,生理小种种类多,各地稻瘟病菌生理小种组成和优势小种差异大,而生产上推广的抗病品种少,多数是针对一些稻瘟病菌生理小种具有特异抗性的品种,品种布局困难。虽然各地不断监测稻瘟病菌生理小种的变化,但一段时期获得的稻瘟病菌生理小种分化的资料对后续的品种布局指导意义不大,主要是由于各地水稻品种不断更新,稻瘟病菌生理小种组成和优势小种会发生相应变化,影响利用品种控制稻瘟病措施的应用效果。目前我国对稻瘟病的防治主要依靠化学药剂,生物防治虽有报道,但防效不明显且不稳定,原因之一是对稻瘟病菌侵染过程和致病机制等研究不够深入,导致生物制剂施用时机掌握不准确,影响生物制剂的防病效果。因而深入研究水稻品种对稻瘟病菌抗病机制和稻瘟病菌致病机制对防治稻瘟病意义重大。
ATMT方法相对于其他转化方法,虽然具有转化效率高特点,但其转化效率也同样受诸多因素影响。ATMT转化真菌,可转化多种类型的原材料,包括原生质体、孢子、菌丝体和子实体组织等。对于个别真菌只能转化特定的类型。Michielse等在转化接合菌Rhizopus oryzae时,发现在只有原生质体的情况下,才能得到转化子,孢子不能完成转化[14]。Cardoza等在转化Trichodermaspp.时,采用分生孢子和菌丝作为转化对象均可成功转化[15]。
本研究以分生孢子完成稻瘟病菌转化。农杆菌菌株不同,导致转化效率存在一定差异,一些研究者采用农杆菌菌株AGL21转化效率较低,如Rho等每转化1×106个稻瘟病菌孢子可得到500~1 000个转化子[11];李宏宇等每转化1×106个稻瘟病菌孢子可得到约500个转化子[12];贺春萍等和刘朋娟等每转化1×106个孢子获得约300个转化子[8-9]。而本研究中所用菌株C58C1遗传转化效率相对提高,平均转化效率为289个转化子/105个孢子,效率提高。稻瘟病菌菌株不同也是影响稻瘟病菌遗传转化效率的一个主要因素。贺春萍等采用的稻瘟病菌菌株是Y34[8];Rho等采用的稻瘟病菌菌株是70-15[11];李宏宇等采用的稻瘟病菌菌株为6ZB15、95054B、81274和测8605[12];刘朋娟等采用的稻瘟病菌菌株是Guy11[9];而本研究采用黑龙江省田间分离的野生型强致病菌株py1022。转化受体浓度也影响转化效率。本研究表明,较高浓度的稻瘟病菌可以提高转化效率,但受体真菌孢子浓度过高时则导致真菌的过量生长而不能挑出转化子,使转化效率降低。同样,农杆菌浓度过高时,由于农杆菌过度生长引起严重污染,也会导致转化效率下降。这与De Groot等利用农杆菌转化木霉时的研究结果一致[16]。本研究表明,乙酰丁香酮(AS)是诱导毒性基因表达的基本因素,也是转化成功与否的关键因素。共培养中AS是否加入直接影响转化结果。加入的浓度决定转化效率高低,在共培养过程中缺少AS会导致无转化子产生,与Leclerque等研究成果一致[17]。共转化温度也是影响转化效率的重要因素。本研究对转化温度在22~30℃范围内农杆菌转化效率进行研究,结果表明农杆菌介导稻瘟病菌转化最适温度为28℃,与吴毅歆等研究结果一致[10]。转化时间是影响真菌转化效率的另一个因素,与温度不同,不同丝状真菌的共培养的最佳时间差异很大,方丽等对炭疽菌转化研究认为24 h是共培养转化最佳时间[18],本研究对稻瘟病菌遗传转化最佳时间为4 d。
4 结论
a.根癌农杆菌介导法是一种高效稻瘟病菌遗传转化方法,转化效率高低与转化受体类型、农杆菌菌株类型、载体启动子特异性、菌株类型、受体浓度、乙酰丁香酮浓度、共培养时间和共培养温度等因素有关。
b.稻瘟病菌遗传转化最佳条件为:稻瘟病菌分生孢子浓度为1×105个·mL-1,共培养时间为4 d,共培养AS浓度为200 μmol·mL-1,共培养温度为28℃。
c.本研究已将GFP成功转化至稻瘟病菌中,可为稻瘟病菌与水稻品种互作机制研究提供技术支撑。
[1]孙洪利,潘春清,刘洋大川,等.2008~2009年黑龙江省稻瘟病菌生理小种鉴定[J].东北农业大学学报,2010,41(12):15-21.
[2]Brunaud V,Balzergue S,Dubreucq B,et al.T-dna integration in⁃to theArabidopsisgenome depends on sequences of pre-insertion sites[J].EMBO Reports,2002,3(12):1152-1157.
[3]Chilton M D,Que Q.Targeted integration of T-DNA into the to⁃bacco genome at double-stranded breaks:New insights on the mechanism of T-DNA integration[J].Plant Physiology,2003,133 (3):956-965.
[4]Chen S,Jin W,Wang M,et al.Distribution and characterization of over 1000 T-DNA tags in rice genome[J].The Plant Journal, 2003,36(1):105-113.
[5]Mullins E D,Chen X,Romain P,et al.Agrobacteriummediated transformation ofFusarium oxysporum:An efficient tool for inser⁃tional mutagenesis and gene transfer[J].Phytopathology,2001(2): 173-179.
[6]Michielse C B,Salim K,Ragas P,et al.Role of bacterial viru⁃lence proteins inAgrobacteriummediumed transformation of As⁃pergillus awamori[J].Fungal Genet Biol,2004,41(5):571-578.
[7]Tsuji G,Fujii S,Fujihara N,et al.Agrobacterium tumefaciensme⁃diated transformation for random insertional matagenesis inColle⁃totrichum lagenarium[J].J Gen Plant Pathol,2003,69:230-239.
[8]贺春萍,林春花,廖奇享,等.稻瘟病菌T-DNA插入突变体库构建及致病相关突变体筛选[J].热带作物学报,2007,28(1):80-84.
[9]刘明娟,王政逸,王秋华,等.农杆菌介导的稻瘟病菌转化及致病缺陷突变体筛选[J].中国水稻科学,2006,20(3):231-237.
[10]吴毅歆,范成明,周惠萍,等.一种农杆菌介导稻瘟病菌的遗传转化[J].江西农业大学学报,2008,25(3):407-411.
[11]Rho H S,Kang S,Lee Y H.Agrobacterium tumefaciens-mediated transformation of the plant pathogenic fungusMagnaporthe grisea[J].Molecues and Cells,2001,12(3):407-411.
[12]李宏宇,潘初昕,陈涵,等,稻瘟病菌T-DNA插入方法优化及其突变体分析[J].生物工程学报,2003,19(4):419-423.
[13]张俊华,刘扬,孙洪利,等.黑龙江省稻瘟病菌遗传多样性研究[J].东北农业大学学报,2013,44(1):34-38.
[14]Michielse C B,Hooykaasp J J,Vanden Hondel C J,et al.Agrobac⁃teriummediated transformation as tool for functional genomics in fungi[J].Current Genetics,2005,48(1):1-7.
[15]Cardoza R E,Vizcaino J A.A comparison of the phenotypic and genetic stability of recombinantTrichodermaspp.generated by proto-plast andAgrobacterium-mediated transformation[J].The Journal of Microbiology,2006,44(4):383-395
[16]De-Groot M J A,Bundock P,Hooykaas P J J,et al.Agrobacteri⁃um tumefaciens-mediated transformation of filamentous fungi[J]. Nat Biotech,1998,16:839-842.
[17]Leclerque A,Wan H,Abschutz A,et al.Agrobacterium-mediated insertional mutagenesis(AIM)of the entomopathogenic fungus Beauveria bassiana[J].Current Genetics,2004,45(2):111-119.
[18]方丽,宋凤鸣.农杆菌介导的黄瓜炭疽菌遗传转化[J].浙江大学学报:农业与生命科学版,2006,32(4):360-366.
GFP genetic transformation ofMagnaporthe griseamediated by Agrobacterium tumefaciens
ZHANG Junhua,LIU Ye,HAN Yutong,PAN Chunqing,WANG Zhongye,ZHANG Linlin,CUI Kaixuan
(School of Agriculture,Northeast Agricultural University,Harbin 150030,China)
Rice blast is one of the main devastating diseases in rice production,breeding and utilization of resistant varieties are the most economical and effective measures to control of rice blast disease.Studying the interaction mechanism betweenMagnaporthe griseaand rice varieties is the base of breeding resistant varieties.GFP(Green fluorescent protein)gene fragment is so small that it can fuse with different protein N terminal or C terminal easily,and it can be used in the interaction study between pathogen and host.In this study,we developed anAgrobacterium tumefaciens-mediated transformation system forMagnaporthe griseaby using a high pathogenic isolate py1022 and theAgrobacterium tumefaciensstrain C58C1 carrying plasmid pBGgHg.The results showed that 250 μg·mL-1hygromycin B could completely inhibit the growth ofMagnaporthe grisea.The optimal genetic transformation system were as followed:the conidia concentration ofMagnaporthe griseawas 1×105conidia·mL-1,the total culture time forAgrobacterium tumefaciens-mediated rice blast fungus transformation was 4 d,co-culture with AS concentration was 200μmol·mL-1,co-culture temperature was 28℃.We randomly chosed eight clones and verified the GFP transformation by PCR amplifying with the hph primers and sequencing,observed mycelia and conidia under fluorescence microscopy,determinated pathogenicity and genetic stability,the results showed that the GFP had been successfully transformed into the rice blast fungus,and it can provide powerful tool for the study of interaction mechanism betweenMagnaporthe griseaand rice varieties.
Magnaporthe grisea;Agrobacterium tumefaciens-mediated transformation;green fluorescent protein(GFP)
S432.1
A
1005-9369(2014)11-0001-07
2014-07-06
哈尔滨市科技攻关项目(2014AB6BN036);黑龙江省教育厅科学技术研究项目(11551041);博士后研究人员科研启动资助项目(LBH-Q09172);农业部寒地作物生理生态与黑龙江省高校寒地作物品种改良与生理生态重点开放实验室项目
张俊华(1973-),男,教授,博士,博士生导师,研究方向为寄主与病原物分子互作。E-mail:podozjh@163.com
时间2014-11-21 16:41:33[URL]http://www.cnki.net/kcms/detail/23.1391.S.20141121.1641.012.html
张俊华,刘烨,韩雨桐,等.农杆菌介导稻瘟病菌绿色荧光蛋白(GFP)遗传转化研究[J].东北农业大学学报,2014,45(11):1-7.
Zhang Junhua,Liu Ye,Han Yutong,et al.GFP genetic transformation ofMagnaporthe grisea mediatedbyAgrobacterium tumefaciens[J].Journal of Northeast Agricultural University,2014,45(11):1-7.(in Chinese with English abstract)
