PEDV地方流行毒株S1基因的遗传变异分析及HLJ-2012株免疫原性检测
2014-01-16李一经唐丽杰姜艳平陈佩佩
李一经,张 博,唐丽杰,姜艳平,陈佩佩
(东北农业大学动物医学学院,哈尔滨 150030)
卷终
PEDV地方流行毒株S1基因的遗传变异分析及HLJ-2012株免疫原性检测
李一经,张 博,唐丽杰,姜艳平,陈佩佩
(东北农业大学动物医学学院,哈尔滨 150030)
为探讨猪流行性腹泻(Porcine epidemic diarrhea,PED)再次爆发原因,对现阶段黑龙江省和内蒙古自治区的10株猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)流行毒株S1基因进行扩增、克隆和序列测定,通过序列比对分析其遗传演化特点。选择其中一株毒株进行中和试验,对其免疫原性做初步分析。结果表明,10株PEDV的S1基因与参考毒株相比,核苷酸同源性为86.8%~99.7%;且S1基因均存在点突变、碱基插入及缺失的情况;构建的系统发育树表明PEDV毒株在S1基因水平上共分为两个群,本试验中的10株均处在G1群,与2011~2012年3株其他地区毒株CH/SDQD/2011、CH/HBQHD/2011和HuN亲缘关系较近,而与G2群中的经典毒株CV777及我国以往报道过的LJB/03等亲缘关系较远;通过中和试验,判断出新发毒株HLJ-2012对传统毒株LJB/03具有一定的中和效应,中和效价为1∶53.83。
猪流行性腹泻病毒;遗传变异;S1基因;中和试验
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由冠状病毒科猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的各种年龄猪以呕吐、水样腹泻、脱水和仔猪高致死率为特征的消化道传染病,该病在1971年首次报道于荷兰,随后许多国家相继报道[1],我国于1976年发现该病[2]。2010年至今,PED在我国许多省份的猪场中流行[3],大部分猪场都进行过疫苗免疫。根据哈尔滨兽医研究所的研究报告显示,现阶段流行毒株大部分为新发毒株,也有部分毒株与以往爆发过的毒株相似[4],说明现地猪场PEDV感染情况较为复杂。传统疫苗可能不能对抗流行的新发毒株。研究表明,PEDV S基因1~2 367 bp(S1)包含病毒主要的中和表位和受体结合域[5],这个区域的变化最能体现病毒的变异情况,因此对PEDV S1基因的研究具有重要意义。
中和试验具有较高的特异性并且可以分析病毒的抗原性,林志雄等建立PEDV微量中和试验[6]。采用适应于传代细胞生长的PEDV-G1株,以PK15(猪肾细胞)作指示细胞,48 h判定。研究证实本方法检验准确、可靠、具有较高的敏感性、可用于流行病学调查。
2012年3月至2013年12月从黑龙江省和内蒙古自治区10个养殖场共采集10份猪腹泻病病料,通过RT-PCR扩增出S1基因并对其进行克隆和序列测定,分析其与参考毒株的同源性及系统发育树分析,研究现阶段PEDV的遗传变异规律,从基因水平分析猪场PEDV免疫失败的原因。以Vero细胞为指示细胞,通过PEDV HLJ-2012株兔源抗体对传统毒株LJB/03株的的中和试验对其免疫原性做初步分析,为PED的综合防控提供和新疫苗开发提供参考。
1 材料与方法
1.1 材料
1.1.1 病料
2012年3月至2013年12月从黑龙江省和内蒙古自治区10个养殖场共采集10份猪腹泻病致死的小肠病料,临床表现为水样腹泻,发抖,死亡猪小肠段充满黄色液体并膨胀,肠壁变薄。
1.1.2 试剂
胎牛血清,购自呼和浩特市草原绿野生物工程材料有限公司;DMEM营养液、胰蛋白酶(2.5×103μg·mL-1),购自GIBCO公司;TRIzol购自Invitrogen公司;反转录试剂盒、dNTP、LATaqDNA聚合酶、DL2000 DNA Marker、克隆载体pMD18-T vector均购自宝生物工程(大连)有限公司;胶回收试剂盒购自Axygen公司。
1.1.3 Vero细胞和PEDV分离毒
非洲绿猴传代肾细胞(Vero),东北农业大学兽医微生物与免疫实验室保存;PEDV LJB/03株为东北农业大学兽医微生物与免疫实验室经蚀斑纯化分离并保存[7],其亲缘关系与经典毒株CV777相近,故可定义为传统毒株。
1.1.4 PEDV检测抗原
PEDV N基因重组菌由东北农业大学兽医微生物与免疫实验室制备保存[8]。
1.1.5 引物
根据GenBank中公布的PEDV参考毒株CV777全基因序列(AF353511),设计扩增S1基因的上游引物S1-f∶5′TAAGTTGCTAGTGCGTAAT 3′和下游引物S1-r∶5′TTTACAACGAGAGTTACCATTA3′,扩增片段大小2 516 bp。
1.2 方法
1.2.1 病毒RNA的提取和cDNA的合成
将小肠内容物按1∶5以1×PBS稀释,充分震荡后反复冻融3次,5 000 r·min-1离心10 min,提取上清液中总RNA,按试剂盒说明书合成cDNA,将反转录产物于-20℃保存备用。
1.2.2 S1基因的扩增及克隆
PCR在50 μL体系中进行。依次加入灭菌29 μL,10×LATaq Buffer 5 μL,2.5 mmol·L-1dNTP 4 μL,LA Taq酶1 μL,引物(含上、下游引物)2 μL,取第一链cDNA合成产物7 μL,混匀。采用常规PCR方法,反应程序为95℃预变性变性5 min,94℃变性1 min,50℃退火1 min,72℃延伸2 min 30 s,30个循环,循环结束后72℃延伸10 min。PCR产物经纯化回收与pMD18-T载体连接,转化到E.coli、JM109感受态细胞中,培养后挑取单个克隆进行酶切鉴定和PCR鉴定,重组质粒由上海生工生物技术有限公司进行测序。
1.2.3 序列分析
采用DNAStar和DNAMAN软件对PEDV HLJ-2012株与株参考毒株的S基因进行核苷酸序列分析,采用MAGE5构建基因系统发生树。
1.2.4 多抗的制备
用1.6中处理的小肠得到的上清液,用0.22 μm滤器过滤除菌后,取上清液1 mL与等量弗氏完全佐剂混合后,充分乳化后对家兔进行多点皮下注射;15 d后加弗氏不完全佐剂免疫,剂量同前;15 d后注射病毒液,不加佐剂,剂量同前。三免后心脏采血,4℃静置过夜,5 000 r·min-1离心10 min,吸出血清,-20℃保存备用。
1.2.5 PEDV N蛋白的表达
按照文献[7]的方法,表达并纯化N蛋白作为检测抗原。
1.2.6 间接ELISA试验检测血清抗体水平
用pH 9.6包被稀释液稀释纯化后的N蛋白抗原至2 μg·mL-1,100 μL·孔-1包被酶标板,37℃孵育3 h;PBST洗涤3次,5%脱脂乳作为封闭液,200 μL每孔,37℃孵育2.5 h;PBST洗涤3次后,从1∶100开始,2倍倍比稀释免疫血清,100 μL每孔,置37℃孵育1 h;PBST洗涤3次后,用脱脂乳将羊抗兔酶标抗体5 000倍稀释,100 μL每孔,置37℃孵育1 h;PBST洗涤3次后,加新配制的OPD-H2O2底物显色液,100 μL每孔,避光置于37℃孵育10 min;2 mol·L-1的H2SO4,50 μL每孔终止反应;测定490 nm波长的吸光值,每组设置2孔,计算平均值。
1.2.7 PEDV LJB/03株TCID50的测定
应用参考文献[9]的方法,采用96孔板细胞培养板进行测定。
1.2.8 病毒中和试验操作步骤
采用固定病毒稀释血清法测定,将HLJ-2012兔源阳性血清于56℃30 min以灭活补体,以2倍系列稀释(1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、 1∶128、1∶256),每个稀释度125 μL,分别加入到EP管中;然后将病毒稀释到200 TCID50,加入到血清稀释管中,每管125 μL混匀,37℃作用1 h;取出已经长满单层的Vero细胞的96孔细胞板,向血清和病毒液中加入终浓度为6 μg·mL-1的胰蛋白酶混匀后加入到96孔细胞板中,50 μL每孔,每个血清稀释度加入4个平行孔,37℃作用1 h;然后每孔补加维持液,50 μL每孔,37℃培养;逐日观察并记录CPE。
设立对照:为保证试验结果的准确性,每次试验都必须设置下列对照。
阳性和阴性血清对照:阳性和阴性血清与待检血清进行平行试验,阳性血清对照应不出现细胞病变,而阴性血清对照应出现细胞病变。
病毒回归试验:每次试验培养板上都应设立病毒对照,先将病毒作 0.1、1、10、100、1 000 TCID50稀释,每个稀释度作4孔。0.1 TCID50应不引起细胞病变,而且100 TCID50必须引起细胞病变,否则该试验不能成立。
血清毒性对照:为检查被检血清本身对细胞有无任何毒性作用,设立被检血清毒性对照是必要的,即在细胞中加入低倍稀释的待检血清(相当于中和试验中被检血清的最低稀释度)。
正常细胞对照:即不接种病毒和待检血清的细胞悬液孔。正常细胞对照应在整个中和试验中一直保持良好的形态和生活特征。
结果判定和计算:当病毒回归试验,阳性、阴性、正常细胞对照相,血清毒性对照全部成立时,才能进行判定。被检血清孔出现100%CPE判为阴性,50%以上细胞出现保护者为阳性,固定病毒稀释血清中和试验的结果是计算出能保护50%细胞孔不产生细胞病变的血清稀释度,该稀释度即为该份血清的50%中和抗体效价。
2 结果与分析
2.1 PEDV流行毒株S1基因的扩增
以病料样品制备的总RNA合成的cDNA为模板,用所设计的引物S1-f/S1-r对11株PEDV S1基因进行PCR扩增,PCR产物经0.8%琼脂糖凝胶电泳分析,可见到一条大小约为2.5 kb(见图1)的特异性条带,其大小与预期设计一致,阴性对照没有此条带。图1为部分PCR产物电泳图。
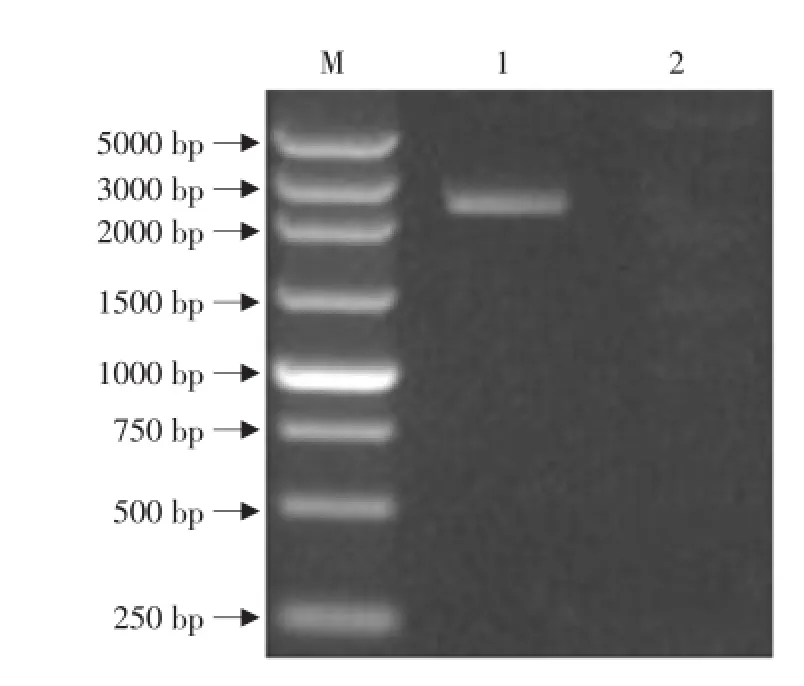
图1 S1基因鉴定结果Fig.1 Identification of S1 gene
2.2 病毒S1基因的克隆和序列分析
将PCR扩增获得的10个PEDV S1基因经纯化、回收、与pMD18-T载体连接转化后到JM109感受态细胞中,进行PCR、酶切鉴定,筛选阳性重组菌落扩大培养,送至上海生工生物工程有限公司进行测序。
并根据样品采集地点与年份分别命名为HLJ-2012(黑龙江省鹤岗市)、LJ-12-1(黑龙江省哈尔滨市)、LJ-12-2(黑龙江省双鸭山市)、LJ-12-3(黑龙江省七台河市)、LJ-12-4(黑龙江宝泉岭农场)、LJ-12-5(黑龙江省鸡西市)、LJ-13-1(黑龙江省哈尔滨市)、LJ-13-2(黑龙江省牡丹江市)、LJ-13-3(黑龙江省安达市)及NMG-2012(内蒙古鄂尔多斯市),10株PEDV S1序列均为2 376个核苷酸,编码792个氨基酸。10株病毒与13株参考毒株S1基因同源性为86.8%~99.7%(见图2)。图2中1:HLJ-2012;2:LJ-12-1;3:LJ-12-2;4:LJ-12-3;5:LJ-12-4;6:LJ-12-5;7:LJ-13-1;8:LJ-13-2;9:LJ-13-3;10:NMG-2012;11:CV777;12:CV777疫苗株;13:Br1/87;14:LJB/03;15:DX;16:CH/ S;17:JS-2004-2;18:83P-5;19:Chinju99;20:NJ;21:CH/HBQHD/2011;22:CH/SDQD/2011;23:HuN。
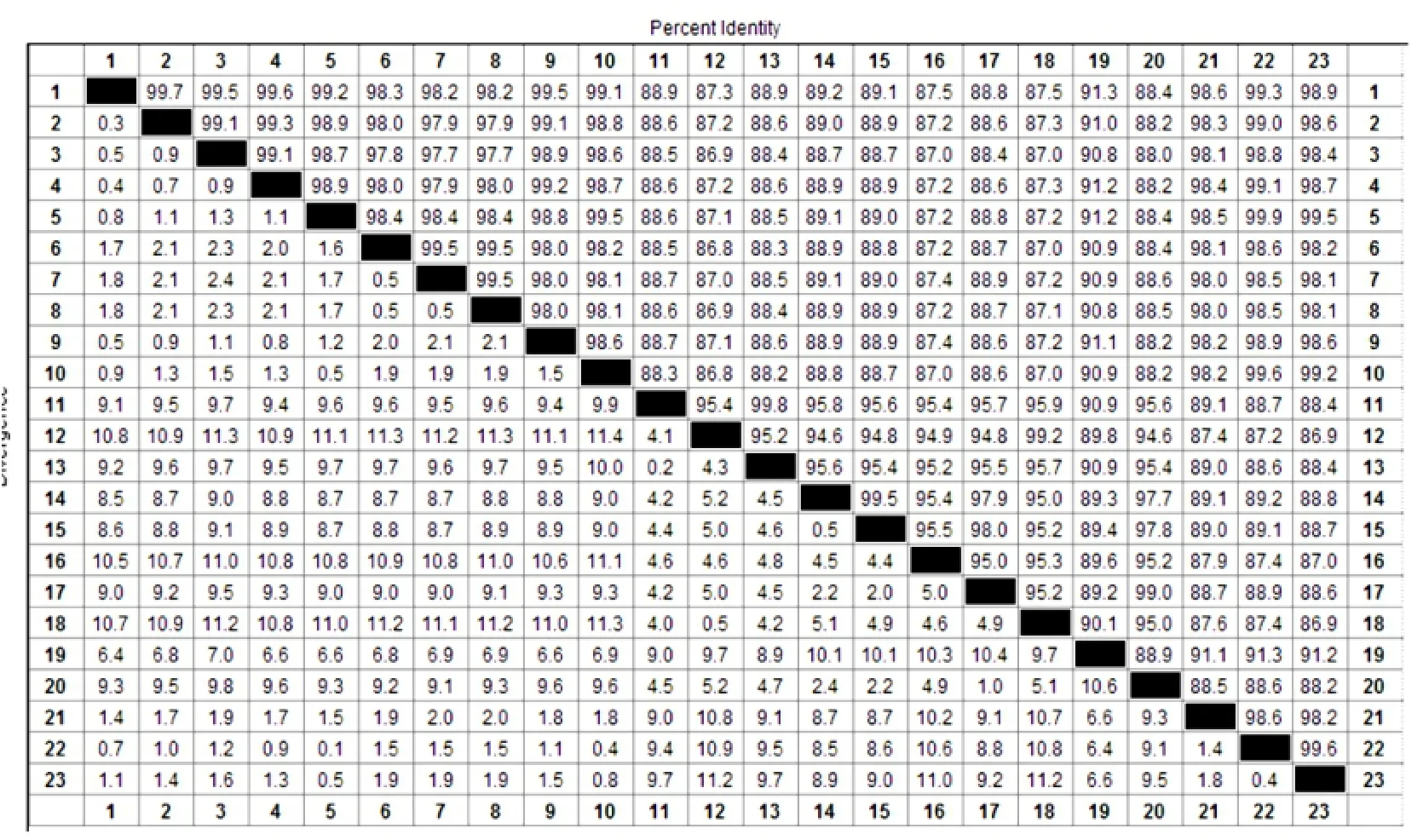
图2 PEDV S1基因序列同源性分析Fig.2 Sequence distance of S1 gene of PEDV
与参考病毒株相比,除点突变还存在插入、缺失和重组现象。采用DNAMAN软件进行比较,并截取部分变异比较大的区域进行图解(见图3)。与传统毒株CV777相比HLJ-2012、LJ-12-1、LJ-12-2、LJ-12-3、LJ-12-4、LJ-12-5、LJ-13-1、LJ-13-2、LJ-13-3、NMG-2012同2011~2012年中国流行毒株HuN、CH/SDQD/2011和CH/HBQHD/ 2011一样在164~165 bp、175~176 bp、184~185 bp、206~207 bp、419~420 bp之间分别有3个、7个、2个、1个、3个核苷酸的插入,第218和481~486 bp之间存在1个和6个核苷酸的缺失。推导的氨基酸,出点突变外,还存在插入、缺失和重组现象,截取部分变异较大区域进行图解(见图4)。韩国学者证明位于S蛋白N端25~88 aa是PEDV受体结合位点[10],与CV777株及中国以往爆发的毒株LJB/03、CH/S、DX等相比较,在这个区域10株流行毒株在59~62 aa处均插入4个氨基酸,并且导致第55~58 aa氨基酸发生变化;在140~141 aa存在一个氨基酸的插入;在161~162 aa存在2个氨基酸的缺失,并且导致157~164 aa区域氨基酸发生变化。

图3 利用DNAStar软件对流行毒株S1基因与参考毒株S1基因序列部分片段的比较分析Fig.3 Comparison of part of S1 gene of PEDV pandemic strains and Reference strains by DNAStar software
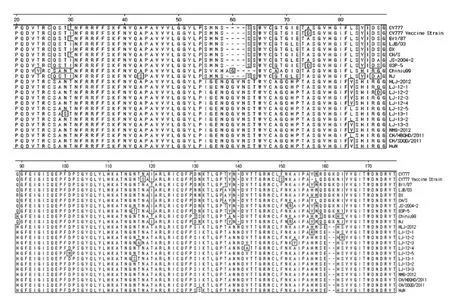
图4 利用DNAStar软件对流行毒株S1蛋白氨基酸与参考毒株S1蛋白氨基酸部分序列的比较分析Fig.4 Comparison of amino acid sequences of the part of S1 protein of PEDV pandemic strains and reference strains by DNAStar software
2.3 基于S1基因的遗传演化关系
用DNAstar软件Clustal V法进行碱基对齐,用MEGA5软件,根据GenBank中已发布的PEDV参考毒株序列与本试验中10株流行毒株S1基因核苷酸序列构建系统进化树,PEDV S1基因共分为2个群(见图5)本试验的10株PEDV(标记▲)与2011~2012年3株其他地区毒株CH/SDQD/2011、CH/ HBQHD/2011和HuN处于同一分枝,亲缘关系较近,定为G1群;其余参考毒株在另一分枝,定为G2群,本群中CV777中国疫苗毒株单独成枝。从进化树关系来看,G1群整体独立成枝,与疫苗毒株亲缘关系较远,而疫苗株与中国以往爆发的毒株亲缘关系较近,这可能就是2011年2013年爆发的PEDV造成免疫失败的原因。
2.4 LJB/03株TCID50的测定结果
该病毒株的CPE在10-5(100%)和10-6(12.5%)之间,其确切稀释倍数可根据Reed-Muench氏公式计算∶即50%细胞病变的稀释度的对数+稀释系数*距离比例距离比例=(高于50%的百分数-50)/(高于50%的百分数-低于50%的百分数)=50/87.5= 0.67,稀释系数=-6+5=-3+2=-1,因此该病毒的TCID50应是105.67μg·mL-1。
2.5 N蛋白表达并纯化
对经IPTG诱导表达并纯化的PEDV N蛋白进行SDS-PAGE分析,结果表明所纯化的蛋白质分子质量为49 ku,为N蛋白表达产物,超声破碎的上清液中有大量目的蛋白存在,而在沉淀部分只有少量的目的蛋白,说明目的蛋白是以可溶形式出现的,为可溶表达(见图6)。经比色法测定所纯化的蛋白浓度为0.065 mg·mL-1,用包被稀释液稀释至2 μg·mL-1后包被酶标板。
2.6 间接ELISA检测家兔体内抗体水平
经间接ELISA检测,酶标仪读取OD490nm值,取平行孔平均值,计算P/N大于2为阳性,结果如图7所示。根据间接ELISA检测结果得出,效价能达到1∶12 800,P/N为2.34,说明多抗血清为阳性。
2.7 中和试验检测抗体水平
可根据Reed-Muench两氏法计算,能保护50%细胞的血清稀释度介于25(10-1.5)与26(10-1.8)之间。距离比例=(100-50)/(100-25)=0.77高于50%保护率血清稀释度的对数+距离比例×稀释系数的对数=-1.5+0.77×(-0.3)=-1.731,-1.731的反对数=1/53.83,即阳性血清的中和效价为1∶53.83。
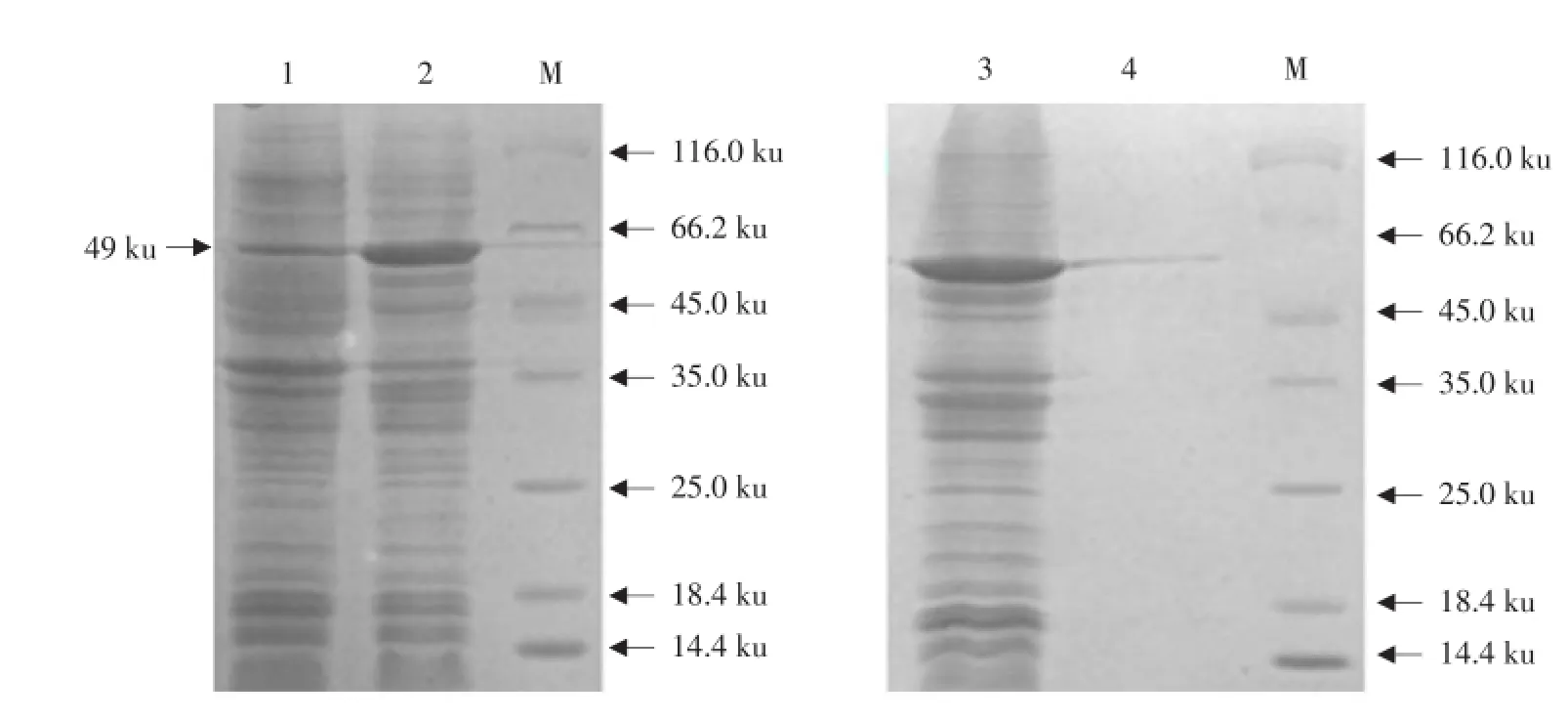
图6 诱导表达并纯化的重组PEDV N蛋白的SDS-PAGEFig.6 SDS-PAGE analysis of purified recombinant N protein
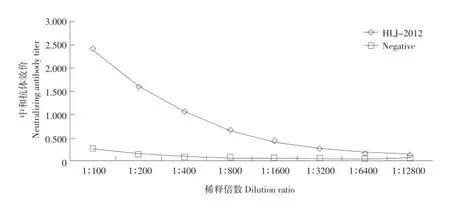
图7 兔抗PEDV抗体效价Fig.7 Rabbit anti PEDV antibody titer
3 讨论
本试验对2012年3月~2013年12月间黑龙江省9个、内蒙古自治区1个疑似感染PEDV的发病猪场调查的临床资料和实验室诊断结果表明,猪流行性腹泻存在于黑龙江及内蒙古个别地区,综合我国其他研究机构报道表明,2011~2012年PEDV除在黑龙江较为流行外,在中国其他大部分省市均有流行,是造成仔猪腹泻死亡的最主要原因。
纤突蛋白(S)基因是PEDV结构蛋白基因中最大基因,在受体细胞结合吸附、膜融合等方面起重要作用;它表面囊膜糖蛋白S既含有介导病毒侵入机体细胞的受体结合域,又拥有介导机体产生中和抗体的抗原表位,是诱导机体产生保护性中和抗体的主要免疫蛋白,由于其存在于病毒粒子之外,所以也是变异最大的基因。PEDV S基因在分析现地流行毒株的流行趋势和遗传变异中具有重要作用。通过对现地流行毒株S基因的序列分析,可及时了解现地流行毒株是否存在变异,为疫苗株的候选提供理论依据,有助于弄清楚病毒的遗传变异情况。动物受到病毒感染后,体内产生特异性中和抗体,并与相应的病毒粒子呈现特异性结合,因而阻止病毒对敏感细胞的吸附,或抑制其侵入,使病毒失去感染能力。中和试验(Neutralization test)是以测定病毒的感染力为基础,比较病毒受免疫血清中和后的残存感染力为依据,判定免疫血清中和病毒的能力,这种方法可评价病毒株是否具有制成疫苗的潜力。
S蛋白被人为划分成S1区(第1~789位氨基酸)和S2区(第790~1 383位氨基酸)[11]。通过冠状病毒S蛋白序列比对,发现PEDV的S2较Sl在序列上更为保守,S1负责与特异性受体的识别和结合,由于不同冠状病毒侵染不同的类型的宿主细胞,因此S1结构域具有多样性。PEDV中和表位区PS420(COE)也处在S1区,研究表明,通过乳酸乳球菌表达的该段蛋白具有免疫中和作用[12]。本试验获得10株PEDV S1基因序列,长度均为2 376 bp,与参考病毒株相比,除点突变还存在插入、缺失的现象。与传统毒株CV777相比HLJ-2012、LJ-12-1、LJ-12-2、LJ-12-3、LJ-12-4、LJ-12-5、LJ-13-1、LJ-13-2、LJ-13-3、NMG-2012同2011~2012年中国流行毒株HuN、CH/SDQD/2011和CH/ HBQHD/2011一样在 164~165 bp、175~176 bp、184~185 bp、206~207 bp、419~420 bp之间分别有3个、7个、2个、1个、3个核苷酸的插入,第218 和481~486 bp之间存在1个和6个核苷酸的缺失,这些变化导致S蛋白N端氨基酸发生很大的变化。通过对比基因序列发现CV777中国疫苗株S基因较其亲本毒株CV777少3个减基,在455~457 bp处,相应的S蛋白在aa152缺失1个氨基酸(Y),哈尔滨兽医研究所研究人员预测该氨基酸可能与PEDV毒株的致病性有关[13]。
PEDV各毒株之间同源性为86.8%~99.7%,本试验中10株毒与经典毒株CV777株的同源性为88.3%~88.9%,说明流行毒株与传统毒株的S1基因上差别很大。根据S1基因序列构建的系统发育树将PEDV毒株分为2个群,本试验中的10株毒均处于G1群,本群中还包括哈尔滨兽医研究所提交的3株2011年流行毒株HuN、CH/SDQD/2011和CH/ HBQHD/2011。CV777中国疫苗毒株处在G2群中并且单独成枝,从亲缘关系上看,疫苗毒株与经典毒株CV777以及我国以往报道过的LJB/03等传统毒株较近,而与现阶段流行毒株亲缘关系较远,结合序列分析结果来看,很有可能是现地猪场免疫失败的原因之一。
通过比较S基因序列,发现HLJ-2012株比LJB/03株多9个碱基,碱基的插入和缺失,导致S蛋白差异很大。S基因系统发育树表明LJB/03处在G2-2群,同群的还有经典毒株CV777以及中国以往报道过的DX、JS-2004-2等株,从进化关系上可被定义为传统毒株,与处在G1-1的HLJ-2012亲缘关系较远。本试验中,制备组织原毒免疫家兔后的抗血清,ELISA检验发现,抗体效价能达到1∶12 800。本实验室在2010年通过蚀斑纯化技术,分离出LJB/03株纯系病毒,效价可达105.67·mL-1[7]。通过固定病毒稀释血清法的中和试验,表明HLJ-2012株的兔源抗体可以对LJB/03株病毒产生中和效应。说明现阶段流行毒株HLJ-2012可以培养成疫苗,即使是现地猪场感染传统毒株,也可起到免疫预防的效果。
4 结 论
2012~2013年在黑龙江省与内蒙古自治区共收集10份仔猪腹泻样品,经RT-PCR检测,均为PEDV感染,表明在仔猪腹泻病原中,PEDV主导。10株PEDV的S1基因均出现插入、缺失情况,导致S蛋白发生很大变异。PEDV HLJ-2012株兔源抗体能够中和PEDV传统毒株LJB/03,中和效价为1∶53.83。
[1]Kuwahara H,Nunoya T,Samejima T,etal.Passage in piglets of a coronavirus associated with porcine epidemic diarrhea[J].Jpan Vet Med Assoc,1988,41∶169-173.
[2]程庆华,牛小迎,叶成玉.青海地区猪流行性腹泻病调查[J].青海畜牧兽医杂志,1992,22(3)∶22-23.
[3]Chen J,Wang C,Shi H et al.Molecular epidemiology of porcine epidemic diarrhea virus in China[J].Archives of Virology,2010, 155∶1471-1476.
[4]刘孝珍,陈建飞,时洪艳,等.2011年猪流行性腹泻病毒的遗传变异分析[J].中国预防兽医学报,2012,34(3)∶180-183.
[5]Sun D B,Feng L,Shi H Y,et al.Spike protein region(aa636-789) of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J].Acta Virol,2007,51∶149-156.
[6]林志雄,李树根,李力复,等.猪流行性腹泻微星血清中和试验的建立和应用[J].中国兽医科技,1994,24(11)∶3-4.
[7]毛雅元,张桂红,葛俊伟,等.猪流行性腹泻病毒地方株LJB/03分离及培养特性[J].病毒学报,2010,26(6)∶483-489.
[8] 姜艳平,葛俊伟,汪淼,等.猪流行性腹泻病毒重组核蛋白作为检测抗原的初步应用[J].中国预防兽医学报,2008,30(8)∶587-591.
[9]毛雅元.猪流行性腹泻病毒地方流行株LJB/03部分生物学特性研究[D].哈尔滨∶东北农业大学,2010.
[10]Lee H M,Lee B J,Tae J H,et al.Detection of porcine epidemic diarrhea virus by immunohistochemistry with recombinant antibody produced in phages[J].J Vet Med Sci,2000,62(3)∶333-337.
[10]孙东波.猪流行性腹泻病毒S蛋白抗原表位及受体结合域的初步筛选[D].北京∶中国农业科学院,2008.
[12]汪淼,葛俊伟,姜艳平,等.PEDV ps420片段乳酸乳球菌表达及免疫中和活性检测[J].东北农业大学学报,2011,42(12)∶20-24.
[13]陈建飞.猪流行性腹泻病毒全基因组序列分析及感染性cDNA克隆的构建[D].北京∶中国农业科学院,2012.
Genetic variation analysis ofS1 genes of PEDV endemic strains and immunogenicity detection of HLJ-2012 strain
LI Yijing,ZHANG Bo,TANG Lijie, JIANG Yanping,CHEN Peipei(School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
To explore the possible reason of the PEDV re-outbreaks,the genetic variation characteristic of PEDVS1 genes was analyzed,S1 genes of 10 PEDV strains collected from Heilongjiang Province and Inner Mongolia Autonomous Region were amplified,cloned,sequenced and compared.To make a preliminary immunogenicity analysis,one of the PEDV strains was chosen to perform the neutralization test.It shows that theS1 gene nucleotide homologies of 10 PEDV strains is 86.8%-99.7%compared with the reference ones;and point mutations,insertion,deletion are all existed inS1 genes of the 10 PEDV strains.Phylogenetic tree showed that PEDVS1 genes are divided into two groups on the gene level,10 isolates in this study are all at G1,and have a closely relationship with CH/SDQD/2011,CH/HBQHD/2011 and HuN.While they have a far relationship with classic CV777 and Chinese previous isolates LJB/03 etc.By neutralization test,the newborn strain HLJ-2012 has a neutralizing effect on traditional strain LJB/03,and the neutralization titer was 1∶53.83.
PEDV;genetic variation;S1 gene;neutralization test
S852
A
1005-9369(2014)12-0001-09
时间2014-12-29 9∶02∶24 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20141229.0902.007.html
李一经,张博,唐丽杰,等.PEDV地方流行毒株S1基因的遗传变异分析及HLJ-2012株免疫原性检测[J].东北农业大学学报, 2014,45(12):1-9.
Li Yijing,Zhang Bo,Tang Lijie,et al.Genetic variation analysis ofS1 genes of PEDV endemic strains and immunogenicity detection of HLJ-2012 strain[J].Journal of Northeast Agricultural University,2014,45(12):1-9.(in Chinese with English abstract)
2014-04-01
“十二五”国家863计划(2012AA101304-3);黑龙江省教育厅项目(10543006)
李一经(1960-),男,教授,博士,博士生导师,研究方向为兽医微生物与免疫学。E-mail∶yijingli@163.com
