C11orf17蛋白的原核表达及功能预测
2014-01-08汪宗桂左长清刘振杰刘新光广东医学院生物化学与分子生物学教研室广东东莞53808广东医学院药理学教研室广东医学院衰老研究所广东省中医院检验科
汪宗桂,左长清,刘振杰,刘新光,3(.广东医学院生物化学与分子生物学教研室,广东 东莞 53808;.广东医学院药理学教研室;3.广东医学院衰老研究所;4.广东省中医院检验科)
C11orf17,又名AKIP1、BCA3,定位于染色体11p15.3,含210个氨基酸残基,主要存在于细胞核中。其最先报道为乳腺癌相关蛋白3,即BCA3(breast cancer associated protein 3),高表达于前列腺癌和乳腺癌细胞系中[1],但其功能研究目前尚未明确。本实验室利用酵母双杂交方法从人骨骼肌细胞cDNA文库中筛选了21个与衰老相关蛋白prelamin A结合的阳性候选克隆,其中C11orf17在其C末端98aa的区域内与prelamin A的C末端相结合(数据未发表)。为了进一步研究其功能,本研究对C11orf17基因编码区进行克隆、表达,为研究C11orf17蛋白的结构和功能奠定基础;同时,我们采用整合蛋白互作与全基因组共表达谱生物信息学方法对其功能进行了预测,为下一步实验提供方向。
1 材料与方法
1.1 材料
大肠杆菌DH5α菌种、BL21(DE3)菌种、K562细胞、pET-32a质粒,均由本室保存; 引物、DNA纯化试剂盒为上海生工生物工程技术服务有限公司产品;Pyrobest DNA polymer-ase、内切酶BamH I及XhoⅠ为TaKaRa公司产品;Anti-His抗体,购自Santa cruz公司;ECL试剂盒,购自北京中杉金桥公司;BugBuster蛋白抽提试剂购自Novagen公司等。
1.2 方法
1.2.1 K562细胞总RNA的提取及cDNA的制备 按Trizol试剂盒操作说明提取RNA,取2 μL用DEPC处理水稀释至500μL,用紫外分光光度法测定A260和A280,RNA浓度(μg/mL)=A260×40×稀释倍数;纯度以A260/A280比值表示,达1.8~2.0方能用于实验。用DEPC处理的去离子水稀释RNA到终浓度为100 pg/μL,进行逆转录实验。RT-PCR结束后,得到的为cDNA,样品保存于-20 ℃。
1.2.2 引物的设计与合成 根据已知的pET32a载体序列以及C11orf17的cDNA编码序列,运用oligo6.0设计引物上游引物为:5′ GA GGA TCC ATG GAC AAC TGT TTG GCG GC 3′,含人C11orf17 cDNA编码区起始20个核苷酸,其5′端含BamH I酶切位点;下游引物为:5′ CA CTC GAG CAC AGG GAA GAC CAG GTC CA 3′,与人C11orf17 cDNA编码区最后20个核苷酸互补,其5′ 端含XhoI 酶切位点,引物序列由上海生工生物工程技术服务公司合成。
1.2.3 pET32a-C11orf17载体的构建与鉴定 以制备的cDNA为模板,利用上述引物进行PCR扩增,反应条件为: 94 ℃预变性5min; 94 ℃30 s,58.2 ℃30 s,72 ℃45 s,30个循环;72 ℃延伸7 min,扩增完毕后4 ℃终止反应。将PCR产物与pET-32a载体分别进行BamH I/XhoⅠ双酶切,经DNA纯化试剂盒纯化后进行连接反应,并转化至DH5α感受态大肠杆菌,经初步的双酶切鉴定后,送上海生工公司测序。
1.2.4 融合蛋白C11orf17-His6的原核表达 将经DNA测序验证的pET32a-C11orf17质粒及空载体pET-32a分别转化感受态表达菌BL21(DE3),铺入含氨苄青霉素(Amp)的LB琼脂平板上倒置培养,当A595值达1时,加IPTG至终浓度为0.4 mmol/L诱导表达,同时设立不加IPTG的阴性对照组。继续培养4 h后,每管取1.5 mL菌液分装,10 000×g离心1 min,菌体用100 μL灭菌去离子水重悬菌体后,加入等体积的2×蛋白电泳上样缓冲液混匀,沸水浴10 min。冷却后吸取10 μL样品上样,进行SDS-PAGE分析,Western blotting分析所用的样品则需要稀释10倍。
1.2.5 融合蛋白C11orf17-His6的可溶性分析 取上述诱导表达的1.5 mL细菌培养液离心收集的菌体,用300 μL BugBuster试剂重悬沉淀,加入溶菌酶使终浓度为1 KU/mL[溶菌酶可用溶菌酶稀释液进行稀释:50 mmol/L Tirs-HCl(pH7.5),100 mmol/L NaCl,0.1 mmol/L EDTA,1 mmol/L DTT,0.1%Triton X-100]和0.3 μL Benzonase核酸酶以降解核酸,降低抽提物粘度。细菌重悬后,在水平摇床低速摇动,室温孵育10~20 min。使用Benzonase核酸酶孵育后,细菌抽提物不应为粘稠状态。12 000 r/min,4 ℃离心20 min,将离心后的上清转移到新的EP管中,沉淀部分加80~100 μL蒸馏水重悬。分别取10 μL上述处理的上清液和沉淀重悬液,加等体积的2×蛋白电泳上样缓冲液,混匀后沸水浴10 min,再进行SDS-PAGE 和Western blotting分析。
1.2.6 生物信息学功能预测 C11orf17的全基因组共表达分析采用全基因组共表达资源库分析web工具UGET(http://genome.ucla.edu/~jdong/GeneCorr.html)进行[2]:分析采用芯片平台为affymetrix公司的HG-U133 Plus 2,选择与C11orf17基因共表达强度最高的300个探针进行分析。C11orf17基因的蛋白互作分析:整合人类蛋白相互作用数据库BioGRID(http:// thebiogrid.org/)[3]和HPRD(www.hprd.org/)[4]相关资源,搜索与C11orf17蛋白相互作用的已知蛋白。最后采用在线生物信息软件Gather (http://gather.genome.duke.edu/)分析共表达基因和相互作用蛋白所富集的生物学功能。
2 结 果
2.1 目的基因的获得及pET32a-C11orf17载体的构建
以K562细胞总RNA制备的cDNA为模板,经PCR扩增,取1 μL的扩增产物进行琼脂糖凝胶电泳,结果(见图1的A和B泳道)显示在500~750 bp之间有很亮的条带,与理论值630 bp相符,表明PCR扩增获得大量的C11orf17目的片段。将PCR产物连接pET-32a载体后,扩增阳性菌落,提取质粒分别进行BamH I和XhoⅠ双酶切鉴定,结果显示(见图1的C泳道),在约630 bp处及6 000 bp处出现两条带,其大小与理论值(目的片段约630 bp,空载体约5 900 bp)相一致,表明C11orf17的PCR产物经双酶切后已经连接到载体pET32a上。将重组子送上海生工生物工程技术服务有限公司测序,结果发现其序列与GenBank完全一致,证明原核表达重组质粒pET32a-C11orf17构建成功。
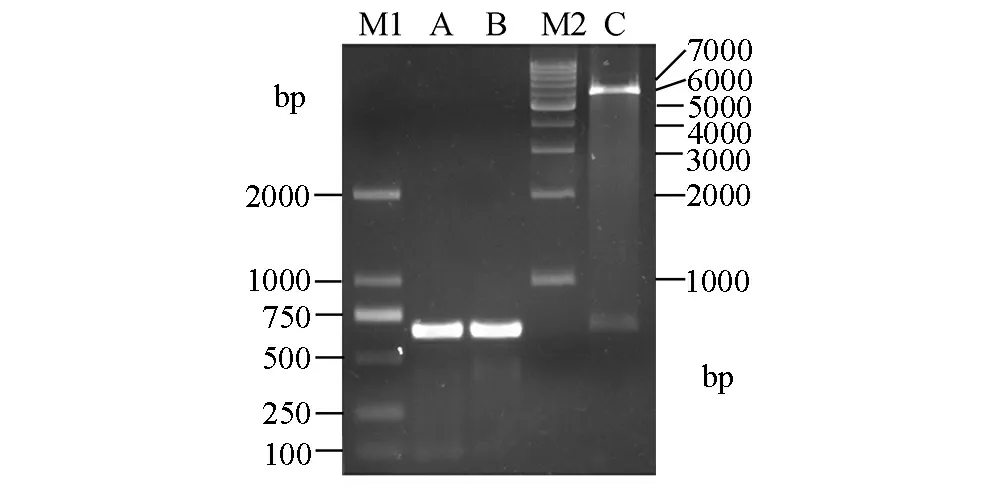
图1 C11orf17的PCR扩增及pET32a-C11orf17载体的双酶切鉴定
2.2 重组C11orf17-His6融合蛋白的表达情况及检测
将重组质粒pET32a-C11orf17和空载体pET-32a分别转化大肠杆菌BL21(DE3),经IPTG诱导在分子量43.5kD(见图2的D泳道)和20.4kD(见图2的B泳道)处分别出现明显条带。这与His标签蛋白分子量为20.4kD和C11orf17为23.1kD的理论值相符,即C11orf17-His6融合蛋白分子量为43.5 kD。而未经IPTG诱导的BL21(含pET32a-C11orf17)和BL21(含pET-32a)则未见高表达量目的条带,分别见图2的C泳道和A泳道。为进一步确认融合蛋白C11orf17-His6得到表达,本文用anti-His标签抗体对细菌总裂解液进行Western blotting检测,结果见图3的E。以上表明重组质粒pET32a-C11orf17在大肠杆菌BL21中得到表达。
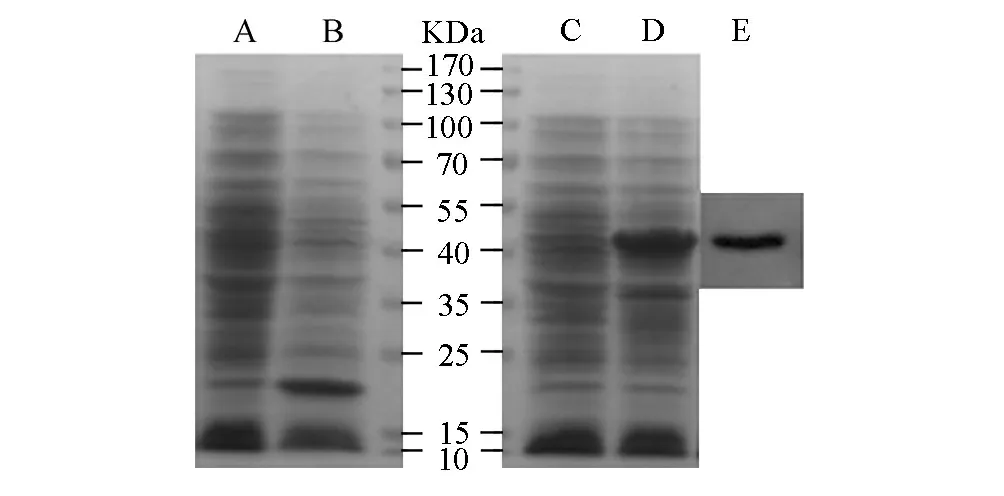
图2 转化菌中C11orf17-His6融合蛋白的表达和Western blotting检测
2.3 重组C11orf17-His6融合蛋白的可溶性分析及检测
BugBuster裂解液裂解经IPTG诱导的BL21(含pET32a-C11orf17)菌体,将上清和沉淀分别进行SDS-PAGE,结果发现上清中未出现大量明显的重组融合蛋白(见图3的B泳道),而在沉淀中43.5kD处发现大量重组蛋白(见图3的C泳道),表明C11orf17-His6主要以不可溶的包涵体形式存在。图3的A泳道是pET32a-C11orf17重组菌的全蛋白。为进一步确认C11orf17-His6在沉淀中是否确实存在,用His标签抗体Western blotting进一步检测融合蛋白的表达情况(图3的D泳道)。结果显示C11orf17-His6融合蛋白在DE3的包涵体中成功表达。
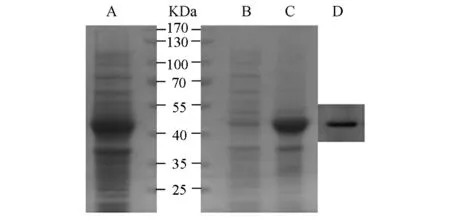
图3 C11orf17-His6融合蛋白的可溶性分析和Western blotting检测
2.4 生物信息学功能预测
UGET分析得到前300个共表达基因探针中,包含267个已知基因(gene symbol)。在线Gather软件对267个共表达基因进行分析发现:共表达基因主要富集基因分子功能本体GO:0007154(cell communication),GO:0007165(signal transduction),GO:0007049(cell cycle) (P<0.000 1)。整合人类蛋白相互作用数据库BioGRID和HPRD资源分析发现,目前已经研究证明的C11orf17相互作用蛋白只有PRKACA (protein kinase,cAMP-dependent,catalytic,alpha)蛋白,后者是细胞周期数据库(Cell Cycle Database:http://www.itb.cnr.it/cellcycle/index.html )的重要成员。
3 讨 论
中国社会正面临严重的人口老龄化问题,有关衰老和老龄化的研究显得十分紧迫而必须。由于人类的生命周期较长,正常的衰老过程不易研究,因此衰老的研究通常利用人类早衰的病人来完成,进而揭示正常衰老过程的分子机理。儿童早老症(Hutchinson-Gilford Progeria Syndrome,HGPS)是一种非常罕见的遗传疾病,患者出生时正常,但会以每年衰老10岁的速度老化,平均寿命为13岁,90%以上因为进行性冠状动脉和脑血管硬化死亡[5]。HGPS是由于LMNA基因在其外显子11的1824位发生核苷酸替代(C→T),尽管未造成氨基酸残基的改变(G608G),但产生了一个潜在的剪切位点,导致外显子11的150nt被剪切,使得A型核纤层蛋白前体(prelamin A,PLA)的C末端50个氨基酸残基被切除[6],阻止了后续的蛋白水解使之加工为成熟的lamin A的过程。这表明prelamin A的加工和成熟过程与细胞衰老紧密相关。而prelamin A可能通过与其他蛋白相互作用最终引起细胞的早衰,寻找新的与细胞衰老相关的prelamin A结合蛋白并对其生物学功能进行研究,对于探索细胞衰老发生的机制具有重要意义。
本实验室研究发现C11orf17在其C末端98aa的区域内与prelamin A的C末端相结合。此区域包含了SH2结合序列、PKC磷酸化模体及CK2磷酸化位点,并且C11orf17的羧基端即-F-P-V序列高度保守,对应于共同的结合序列为-F/Y-x-(A/F/V),此序列来源于II型PDZ结构域包含蛋白,PDZ功能域蛋白主要定位在细胞膜的细胞质侧,它们能结合底物的羧基端,包含有另外的激酶功能域[1]。这暗示着C11orf17的C末端区域具有许多未知的重要功能需要我们去探讨。
本文以K562细胞的cDNA为模板,经RT-PCR扩增,成功构建C11orf17的原核表达载体,测序验证其序列于GenBank中序列完全一致,并且,经大肠杆菌诱导表达,获得了高表达量的融合蛋白,用His标签抗体Western blotting检测显示,C11orf17-His6融合蛋白在大肠杆菌DE3的包涵体中成功表达。这为抗体制备提供了足够的抗原,对进一步研究C11orf17蛋白的结构和功能具有十分重要的意义。
关于新基因、蛋白功能预测,目前广泛使用的方法为利用高通量的基因表达[7]和蛋白质相互作用数据[8-9]进行分析。通过整合两种方法有利于预测结果的可靠性。本研究对C11orf17进行了全基因组共表达基因分析,结果表明:共表达基因富集细胞交流,信号传导,细胞周期等功能,提示C11orf17可能具有以上相关功能。进一步分析已知的相互作用蛋白发现:C11orf17能与PRKACA蛋白相互作用。PRKACA是cAMP依赖性蛋白激酶催化亚基,研究证明其与细胞增殖,细胞周期功能密切相关[10],是细胞周期数据库的重要成员。通过整合共表达基因和蛋白相互作用预测结果,我们认为:C11orf17可能是细胞周期调控的重要新分子。衰老相关prelamin A蛋白对细胞衰老过程中的细胞周期调控是否与其新的相互作用蛋白C11orf17相关,还需进一步研究。
[1]Kitching R,Li H,Wong MJ,et al.Characterization of a novel human breast cancer associated gene (BCA3) encoding an alternatively spliced proline-rich protein[J].Biochim Biophys Acta,2003,1625(1):116-121.
[2]Day A,Dong J,Funari VA,et al.Disease Gene Characterization through large-scale Co-expression analysis[J].PLoS ONE,2009,4(12):e8491.
[3]Breitkreutz BJ,Stark C,Reguly T,The bioGRID interaction database:2008 update[J].Nucleic Acids Res,2008,36(Database issue):D637-640.
[4]Peri S,Navarro JD,Amanchy R,et al.Development of human protein reference database as an initial platform for approaching systems biology in humans[J].Genome Res,2003,13(10):2363-2371.
[5]Pollex RL,Hegele RA.Hutchinson-Gilford progeria syndrome[J].Clin Genet,2004,66(5):375-381.
[6]Eriksson M,Brown WT,Gordon LB,et al.Recurrent de novo point mutations in lamin A cause Hutchinson-Gilford progeria syndrome[J].Nature,2003,423(6937):293-298.
[7]Hvidsten TR,Komorowski J,Sandvik AK,et al.Predicting gene function from gene expressions and ontologies[J].Pac Symp Biocomput,2001,6:299-310.
[8]Vazquez A,Flammini A,Maritan A,et al.Global protein function prediction from protein-protein interaction networks[J].Nat Biotechnol,2003,21(6):697-700.
[9]Deng M,Zhang K,Mehta S,et al.Prediction of protein function using protein-protein interaction data[J].J Comput Biol,2003,10(6):947-960.
[10]Cui C,Zhao H,Zhang Z,et al.CDC25B acts as a potential target of PRKACA in fertilized mouse eggs[J].Biol Reprod,2008,79(5):991-998.
