核磁共振技术在海洋鱼类研究中的应用
2013-12-23蔡宏浩崔晓红林美金
蔡宏浩, 崔晓红, 林美金, 陈 忠
(1. 厦门大学 电子科学系 福建省等离子体与磁共振研究重点实验室, 福建 厦门 361005; 2. 厦门大学 海洋学系 近海海洋环境科学国家重点实验室, 福建 厦门 361005)
核磁共振(nuclear magnetic resonance, NMR)以其精确性、选择性和无创性成为最有用和最普遍的谱学分析方法之一。从复杂的生物分子到各种材料, 从活的有机体到纳米分子, NMR谱提供了许多宝贵的信息。鱼肉和鱼卵富含动物蛋白质、不饱和脂肪酸和磷脂质等物质, 易被人体消化吸收, 对人类体力和智力的发展具有重大作用, 因此对经济鱼类和模式鱼类的研究对人类有着重大的意义。然而, 迄今人们对不同鱼类的营养价值差异, 鱼类的生存条件等因素对其生长、繁殖的影响以及鱼类药物测试等方面的研究尚处于起步阶段, 而NMR技术正是研究这些课题的有力手段。
对于液体样品, 利用液体NMR谱方法能够获得具有化学位移、J偶合常数等谱信息的高分辨NMR谱图。鱼类虽然含有较多水分, 但是仍属于固体, 固体NMR谱图中谱峰的线宽往往比液体要宽的多, 谱图分辨率很低。如果用小动物磁共振成像仪(magnetic resonance imaging, MRI)对整只鱼采集1H NMR谱图, 样品内部固有的不均匀性将导致谱线的严重增宽。因此如何获得鱼类的高分辨NMR谱对鱼类的深入研究具有重大的意义。当前获取鱼类NMR高分辨谱主要有3种方法: 萃取物高分辨NMR谱方法, 魔角旋转法(magic angle spin, MAS)以及基于分子间多量子相干(intermolecular multiple-quantum coherences, iMQC)的NMR方法。萃取物高分辨NMR谱方法是鱼类和鱼卵研究中最早出现也是目前最常用的NMR方法。该方法的优点是: 谱图分辨率高, 利于谱峰的归属, 利用基于自旋回波采样技术的NMR方法还能够获得鱼肉中除大分子脂质外的小分子化合物的谱信息。而该方法的缺点在于对组织的破坏性大, 难以进行原位、在体、无损的研究。随着NMR硬件技术的进步, Varian Nano 探头[1]的出现, 魔角旋转法能够有效平均固体样品中核自旋间的偶极-偶极相互作用, 窄化谱峰线宽, 成为人们获取生物组织高分辨NMR谱的另一有力手段。MAS方法的优点在于无需对样品进行复杂的萃取操作过程, 对组织的破坏性较小; 而缺点同样在于无法进行原位、在体、无损的研究。除了NMR硬件上的改进外, 还可以通过设计脉冲序列和数据处理方法在不均匀不稳定场下获取高分辨谱。近年来发展的基于分子间多量子相干的NMR方法, 由于其对磁场不均匀性不敏感的特性, 因而能有效减小NMR谱线的线宽, 从而获得高分辨谱图。iMQC的作用范围与偶极相干距离dC相关,dC的范围在5 ~ 500 μm, 一般远小于实验样品的尺寸, 当dC比磁场的不均匀度还小时就有可能获得线宽很窄的谱线, 从而消除或减弱磁场不均匀对NMR谱图分辨率的影响。更重要的是, iMQC能够获得与常规单量子相干(single-quantunm coherences, SQC)类似的化学位移、J偶合常数等谱信息。但是由于iMQC的信号强度只有常规SQC信号的1/10, 因此信噪比较低。随着磁场强度的提高, 超低温探头以及磁化转移技术的应用, 这个问题将会逐步得到改善。
作者将评述获取鱼类及鱼卵高分辨NMR谱的方法及其在鱼类研究中的应用现状。
1 萃取物高分辨NMR谱方法
1.1 基本原理
萃取物高分辨NMR谱方法就是从鱼肉或者鱼卵中萃取脂类, 酸类等物质, 然后进行NMR检测以获取高分辨NMR谱图的方法。通过对鱼肉或鱼卵的萃取物进行NMR检测, 能够获得鱼肉内脂类和酸类物质的详细谱学信息, 从而确定各种小分子代谢物和大分子代谢物的结构和含量, 甚至一些含量很低的物质如游离氨基酸、核苷酸、缩氨酸等也能够检测到。目前, 萃取鱼肉或鱼卵的方法中比较常用的是布莱戴尔(Bligh and Dyer)法[2]。萃取后, 一般在萃取物中加入适量的氘代试剂, 目的是为了进行锁场[3]。
常见的NMR谱有氢(1H)、碳(13C)、磷(31P)谱[4]等, 分别是利用物质中所含有的1H、13C和31P元素来进行检测。1H是NMR检测方法中旋磁比最大的元素, 在自然界天然丰度也非常高, 因此1H NMR谱的灵敏度最高, 但由于鱼肉和鱼卵含有的脂类, 酸类及蛋白质等都是结构复杂的化合物, 而1H NMR谱本身的谱宽一般在10(10-6)以内, 因此往往会造成谱峰的重叠。而13C NMR谱的谱宽可以达到250 (10-6), 谱峰不易重叠, 分辨率较高, 然而, 由于13C的旋磁比只有1H的1/4, 且天然丰度仅为1.1%, 因此13C的灵敏度只有1H的1/6000, 故13C NMR谱实验需要长时间累加。1H NMR谱和13C NMR谱各有各的优势, 在实际使用中可以按实验的目的和要求进行选择。
1.2 典型例
Gribbestad[5]在布鲁克DRX 500 MHz谱仪上采用Carr-Purcell-Meiboom-Gill (CPMG)[6]脉冲序列对从大西洋鲑鱼白肉萃取得来的脂类和酸类物质分别进行NMR实验, 得到的脂类和酸类物质的1H NMR谱分别如图1和图2所示, 对谱峰的归属分别如表1和表2所示。根据图1和表1, 作者对不同类型的n-3脂肪酸和DHA进行了归属, 结合13C NMR谱和气相色谱(gas chromatography, GC)确定了不同脂肪酸的结构和含量。由图2和表2对酸类的1H NMR谱进行了归属, 包含乳酸、肌酸、鹅肌肽和氨基酸等, 其中乳酸峰有很好的分辨率, 可以用于对组织中所含的乳酸进行定量分析。
Falch等[7]在布鲁克DRX 600 MHz谱仪上获得的鳕鱼(Gadous macrocephalus)卵及鳕鱼精子的13C NMR谱如图3所示。通过得到的13C NMR谱, 作者分析了胆固醇在鳕鱼精子和卵子的发育过程中的变化, 并对鱼精子和卵子进行了分级。
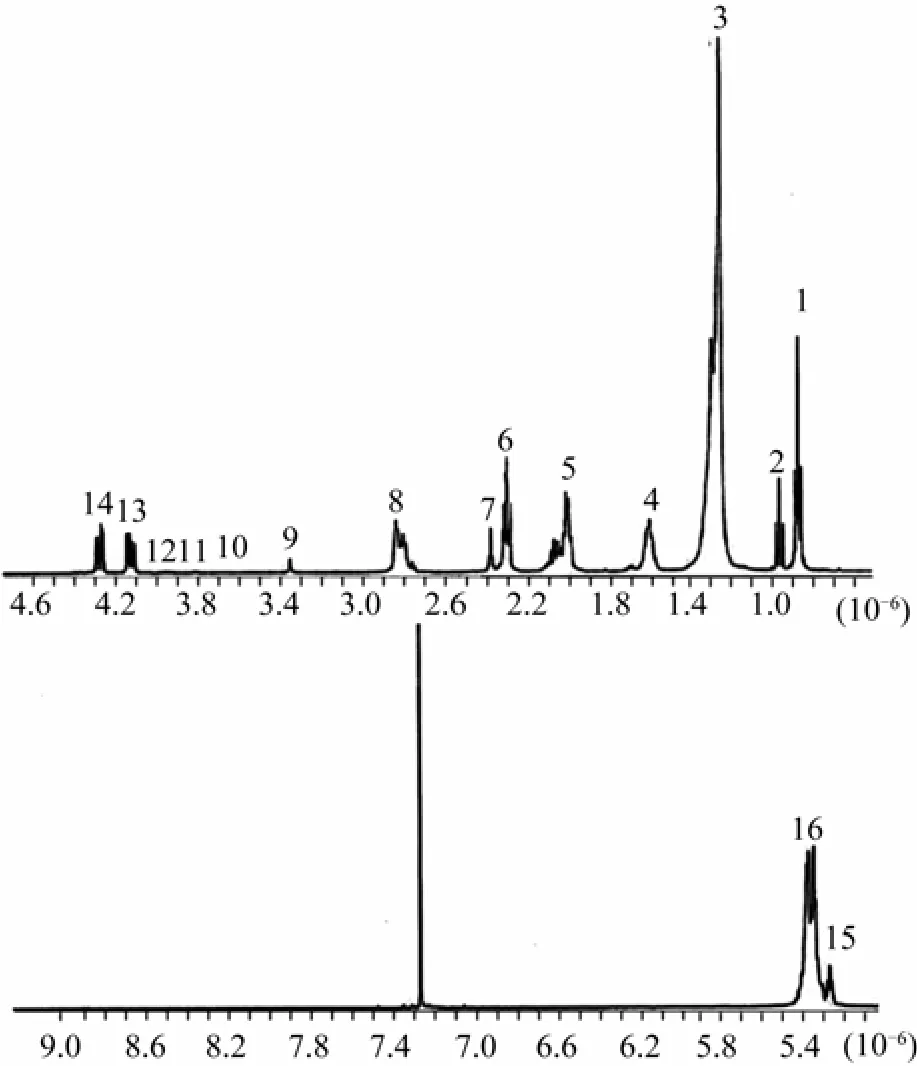
图1 500 MHz谱仪大西洋鲑鱼(Salmo salar L.) 白肉脂类提取物的1H NMR谱 (文献[5])

表1 大西洋鲑鱼白肉脂类提取物的1H NMR谱谱峰归属(文献[5] )

图2 500 MHz谱仪大西洋鲑鱼白肉酸类提取物的1H NMR谱(文献[5])
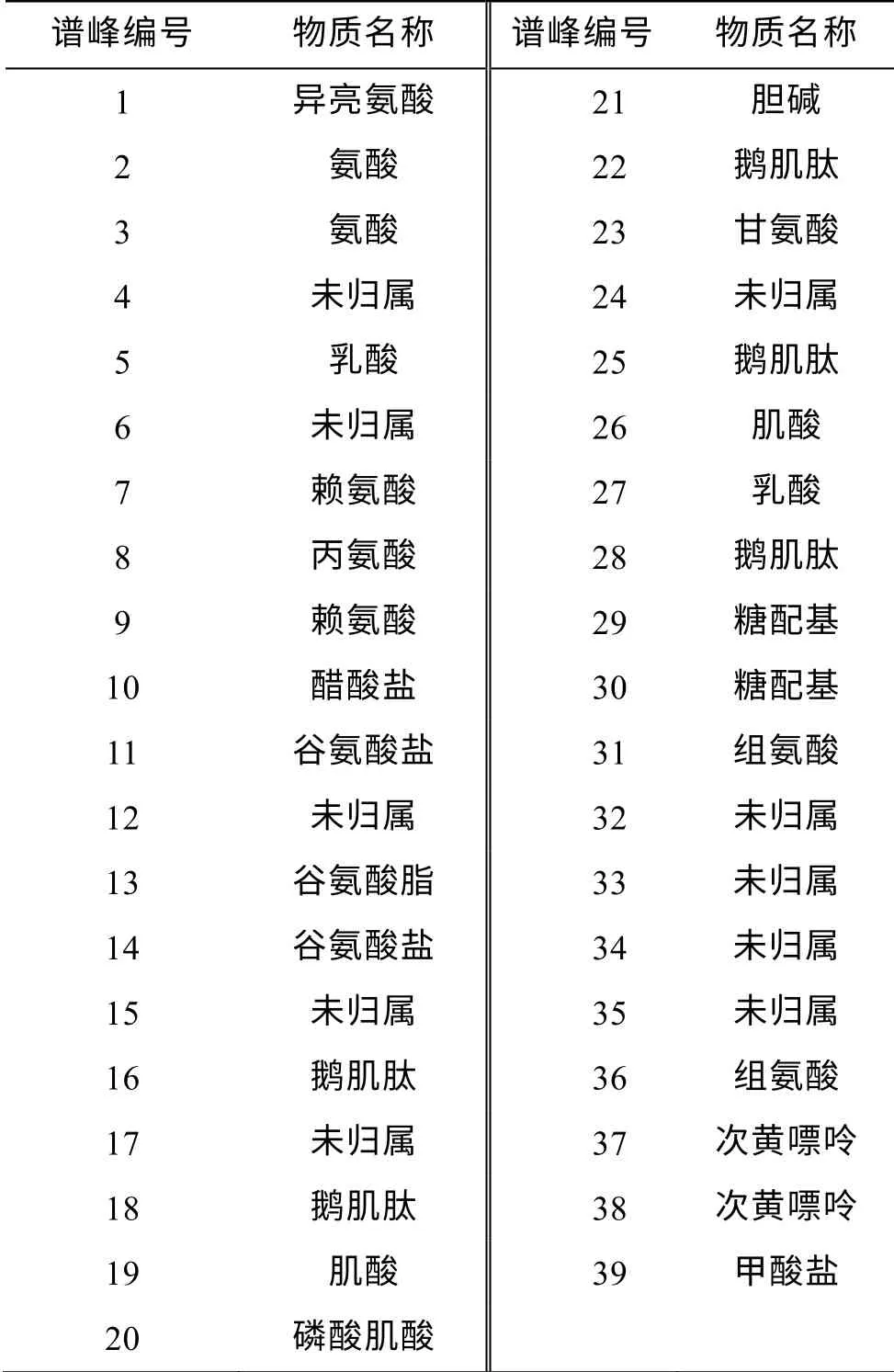
表2 大西洋鲑鱼白肉酸类提取物的1H NMR谱峰归属(文献[5])
2 魔角旋转法
2.1 基本原理
由于固体中存在各种各向异性的相互作用, 因此, 固体NMR谱峰线宽往往比液体谱峰线宽宽的多。最明显的例子是水, 液态水中质子的NMR线宽可达到0.1 Hz, 然而在冰中则达到105 Hz。研究发现, 通过对固态样品中的原子核施加某些操作使其产生运动, 可以观测到NMR线宽有效窄化。MAS方法就是使样品在以其与外加恒定磁场方向的夹角的轴上作快速旋转, 当旋转速度满足一定的条件时所观测到的固体NMR谱峰线宽明显缩窄[8]。
进行MAS实验获得的谱峰线宽与魔角设置的准确度和转速有很大关系, 通常要获得高分辨谱图, MAS实验要求转速足够高、足够准, 魔角设定足够准、足够稳。此外, 由于13C NMR谱灵敏度很低, 因此MAS实验最佳选择是1H NMR谱。
2.2 典型例
Bankefors等[9]在布鲁克Avance 600 MHz谱仪上分别将MAS技术与3种脉冲序列相结合对大西洋鲑鱼进行实验, 实验对象是大西洋鲑鱼肉组织, 获得的一维(one-dimensioanl, 1D)1H MAS NMR谱如图4所示。图4a和图4b同时显示了包含小分子代谢物和大分子代谢物如脂肪酸和糖原的谱峰, 而图4c则过滤了小分子代谢物只剩下大分子代谢物, 这样便有可能区分组织中的小分子代谢物和大分子代谢物。
与萃取法相比, 魔角旋转法能够将完整一块鱼肉放进谱仪检测, 不仅省去了萃取的步骤, 而且对组织破坏较小, 所需样品量少。缺点是需要更换专用的Nano探头进行实验, 增加了设置魔角等操作步骤。而与组织魔角旋转NMR谱相比, 萃取物高分辨NMR谱灵敏度更高。
3 基于分子间多量子相干的NMR方法
3.1 基本原理
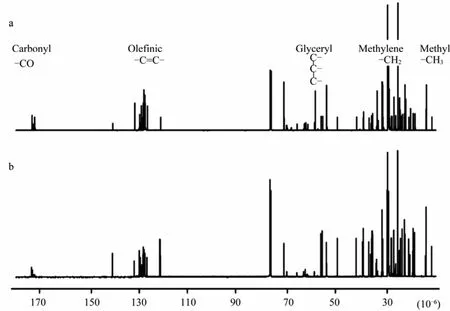
图3 500 MHz谱仪鳕鱼卵(A)及鳕鱼精子(B)的13C NMR谱(文献[7])
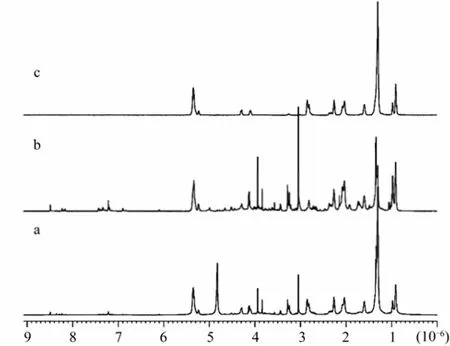
图4 600 MHz谱仪魔角旋转转速4 kHz下5 mg大西洋鲑鱼肉1H NMR谱
iMQC来自分子间的远程偶极相互作用, 当偶极相干距离比磁场的不均匀度还要小时就有可能在不均匀磁场下获得线宽窄化的谱图。分子间偶极相互作用的有效范围为5 ~ 500 μm, 远小于一般样品的尺寸, 在偶极相干距离内磁场基本可以看成是均匀的, 因此, 可以将iMQC方法应用于不均匀场获得高分辨率谱图。与萃取法和魔角旋转法相比, iMQC方法最大的优势就是能够保持样品的完好性, 能进行原位、在体检测, 省去了萃取, 更换探头以及设置魔角的步骤, 极大地简便了实验过程。将iMQC方法与定域谱[10]技术结合可以灵活地对生物体(如鱼等)的指定区域进行原位、在体、无损的检测。
3.2 典型例
厦门大学陈忠小组[11]2009年提出了基于分子间双量子相干(intelmolecular double-quantum coherence, iDQC)的iDQF-HOMOGENIZED II(简称iDH2)一系列序列: iDH2-2J、iDH2-1J、和iDH2-0J, 如图5所示。并以跳跳鱼(Boleophthalmus pectinirostris)为实验对象, 将其麻醉后不做处理直接放入核磁管, 应用iDH2序列进行NMR实验, 并与经典的PRESS定域谱方法和魔角旋转法做了对比, 实验结果如图6所示。

图5 iDH2系列序列图
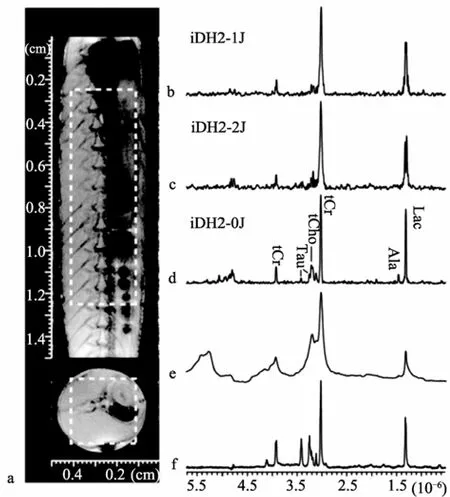
图6 500 MHz谱仪完整跳跳鱼的矢状面和冠状面微成像和1H NMR谱
从图6可以看到, e图的常规PRESS谱由于跳跳鱼固有的不均匀性导致获得的谱图线宽较宽, 分辨 率低。而iDH2序列能够克服跳跳鱼固有的不均匀性, 可以获得与魔角旋转法相近分辨率的高分辨谱图, 并且真正做到原位、无损检测。iMQC方法的缺点在于灵敏度较低, 只有常规实验的1/10。
4 核磁共振技术的应用
4.1 海产等级区分
鱼类和贝类既是美味的又是极富营养价值的食物, 尤其是深海鱼体内的不饱和脂肪酸, 如: EPA、DHA等, 有助于调节血脂、改善视力、提高记忆力、预防老年痴呆。鱼卵中含有丰富的磷脂质, 而磷脂质中的n-3不饱和脂肪酸对人类的健康非常有益[12], 能够预防心血管疾病[13], 对大脑及神经系统都有正面的影响, 并能够提高人体免疫力[14]。拿三文鱼(Salmo)举例, 脂类含量的多少和三文鱼品质有很大的关系, 脂类多的三文鱼无论在口感还是营养价值方面都更好[15]。通过NMR技术可以定量分析三文鱼肉中脂类物质的含量, 如图1所示, 该谱图给出了不饱和脂肪酸的谱峰归属, 峰的强度越高代表该物质含量越多。因此, 在同样条件下对不同鱼肉采集NMR谱图, 便能比较不同鱼肉脂类含量的多少。类似地, 利用NMR技术也能对鱼卵含有的不饱和脂肪酸进行谱峰归属和定量测量[16]。
同时, 利用NMR技术还可以追踪同一条鱼或者鱼卵在不同时期脂类或者酸类物质的变化情况, 以此观察鱼和鱼卵的生长发育情况。Rezzi等[17]便利用NMR方法采集的金头鲷(Sparus aurata)脂类的NMR谱图对其进行等级区分。Tyl等[18]采用NMR方法对4种鱼体内的脂肪酸的变化做了研究。
4.2 鉴别野生与养殖
通过NMR谱图能够区别鱼类是野生还是养殖, 甚至判断出鱼类的原产地。Aursand等[19]通过13C NMR谱图配合概率神经网络(PNN)[20]和支持向量机(SVM)[21]研究如何区分野生和养殖三文鱼以及三文鱼的原产地。挪威养殖三文鱼(NF)在化学位移31.48 ppm位置上的脂肪峰强度显著高于挪威野生三文鱼(NW)、苏格兰野生三文鱼(SW)、爱尔兰野生三文鱼(IW)(图7)。
Trocino等[22]利用相似的方法对有机养殖和传统养殖的欧洲海鲈鱼(Dicentrarchus labraxL.)进行了实验, 研究发现有机养殖的鲈鱼体内n-3至n-6不饱和脂肪酸的单位含量要比传统养殖的鲈鱼要高。
4.3 生长条件对鱼类的影响
养殖鱼类的质量受许多因素影响, 如水温、盐度、含氧量、污染物、饲料等。通过NMR技术可以定性定量研究这些因素对鱼类质量的影响, 从而通过优化养殖来改善鱼类的质量。
Bankefors等[9]对喂食普通鱼饲料和20%接合菌饲料的大西洋鲑鱼进行NMR实验, 并利用MATLAB[23]工具结合主成分分析法(principal component analysis, PCA)[24]得到结果如图8所示。从得分图(a)可以看出普通鱼饲料喂养的鲑鱼和20%接合菌饲料喂养的鲑鱼明显的区分了开来, 进一步从负载图(b)可以看出喂食20%接合菌饲料的鲑鱼主要在乳酸(Lactate)、鹅肌肽(Anserine)、肌酸(Creatine)这3个成分上与喂食普通饲料的鲑鱼产生了区别。
Viegas等[25]利用一定浓度的氘代水饲养禁食和正常喂食的欧洲海鲈鱼一定时间后, 结果发现正常喂食的鲈鱼在葡萄糖代谢物在量上要多于禁食鲈鱼。通过这一实验可以无损的观测葡萄糖在鱼体内 的代谢过程。
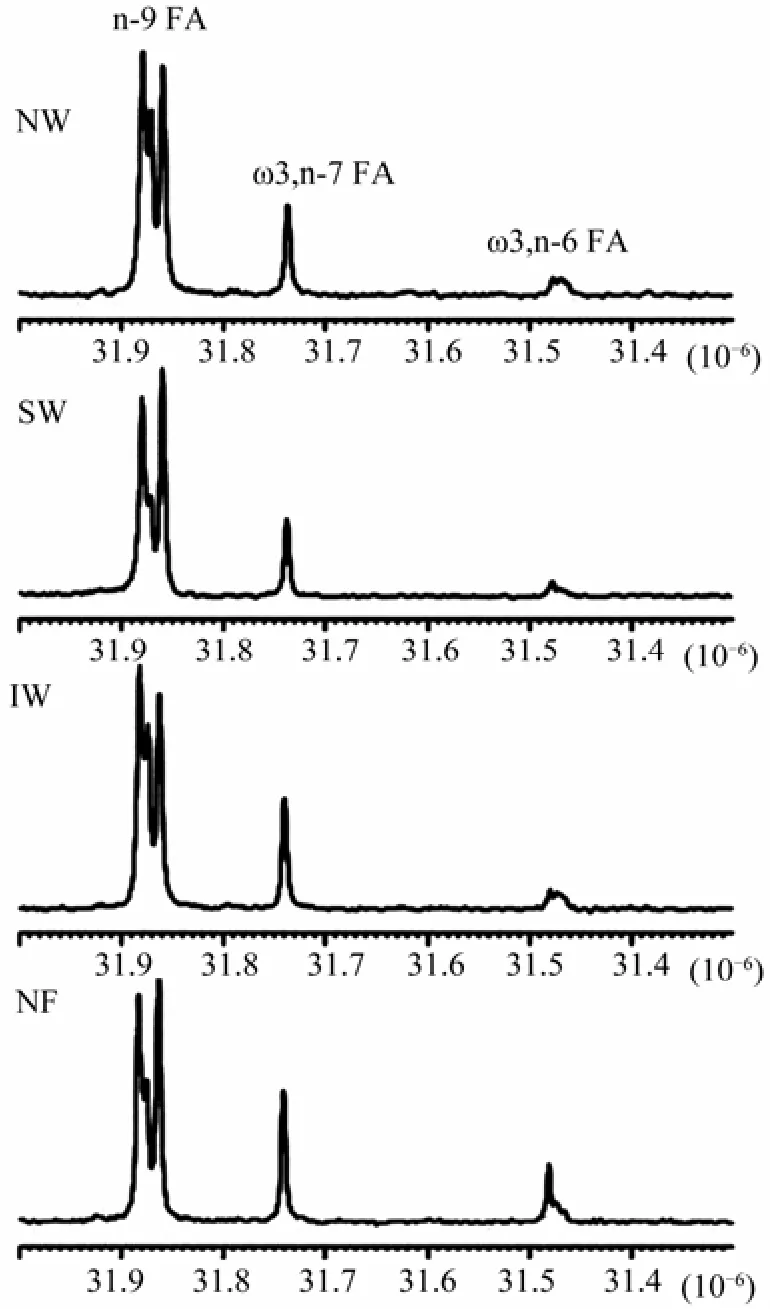
图7 500 MHz谱仪三文鱼脂类提取物的部分13C NMR谱(化学位移范围为31.3 ~32 ppm)
当今河流与海洋都受到不同程度的污染, 因此通过模拟污染环境分析污染物对鱼类和贝类的影响对海洋产业有重要的意义。刑丽红等[26]利用液相色谱-串联质谱法研究三聚氰胺在大菱鲆(Scophthalmus maximus)体内的代谢规律, 从而为防范三聚氰胺残留提供理论依据, 而NMR技术同样能够做到类似的检测[27], 并能做到原位、无损检测, 而液相色谱-串联质谱法做不到。Zhang等[28]利用NMR技术以马尼拉蛤蜊(Manila clam,Ruditapes philippinarum)为实验对象, 研究不同时间、不同剂量的具有致癌致畸性的苯并(a)芘对蛤蜊的影响, 对蛤蜊的腮提取物采集NMR谱图, 并应用PCA分析谱图, 结果发现苯并(a)芘会改变蛤蜊体内的某些代谢物的含量。Ekman等[29]以呆鲦鱼(Fathead minnow)的尿液为研究对象, 应用NMR技术结合PCA方法分析了呆鲦鱼暴露在某些化学环境下体内代谢物的变化。
4.4 鱼类生产加工
朱榕璧等[30]将NMR技术应用于鱼糜的漂洗、擂溃、凝胶和保藏, 定性定量研究了各种添加剂对鱼糜制品的影响。NMR技术可以快速、准确、无破坏性广泛应用于鱼糜制品加工的各个环节中。此外, Gudjonsdottir 等[31]利用NMR技术测量鲑鱼肉的纵向弛豫时间(T1)和横向弛豫时间(T2), 以此来比较两种不同的鱼肉腌制方法对鱼肉中蛋白质的影响。
4.5 鱼类成像
通过磁共振成像(magnetic resonance imaging, MRI)技术可以无损、在体地获得鱼类的内部构造图像, 进而能够从图像上观察得到鱼类的发育情况, 病变等讯息。Nott等[32]在布鲁克 BMT 2.35T 动物成像仪上获得了虹鳟鱼(Salmo gairdneri)的磁化转移速率加权的磁共振成像图, 由于磁化转移速率随着蛋白质的密度增加而增大, 虹鳟鱼的肌肉和内脏中的蛋白质在冰冻后聚合导致密度增大。因此, 从图9中可以很明显地看出: 冰冻后的虹鳟鱼横断面图 的强度比新鲜的虹鳟鱼的横断面的强度要大, 尤其是内脏位置, 冰冻后的亮度显著大于新鲜的。因此, 通过MRI技术可以区分新鲜的和冰冻过的虹鳟鱼。

图8 大西洋鲑鱼鱼肉切片组织的PCA得分图及负载图
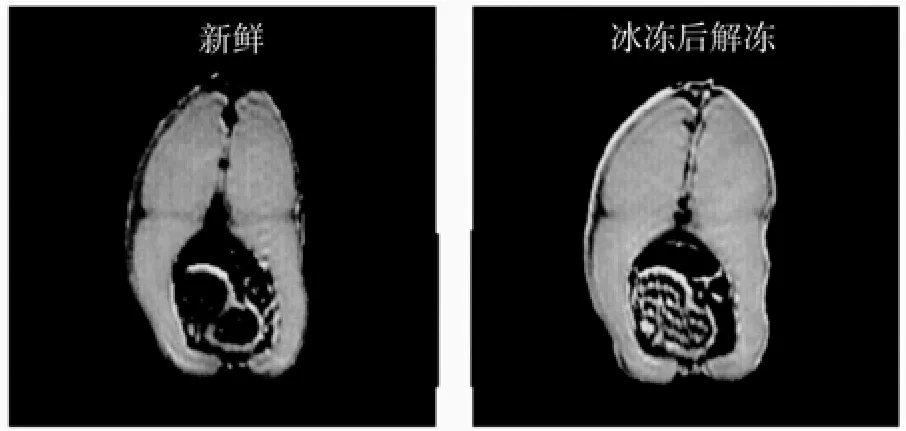
图9 2.35T 动物成像仪上同一只虹鳟鱼在新鲜(左)和冰冻储存4周后(右)的磁共振横断面图 (文献[32])
5 结语
海洋是生命的摇篮, 蕴藏着极其丰富的资源, 人类对海洋的探索一直没有停止, 但是海洋还有许多未解之谜。NMR技术能够无创、无损、定性、定量地对实验对象进行检测, 配合其他数学工具, 能够用于研究许多其他技术不能解决或是较难解决的问题。因此, NMR技术在挖掘海洋资源, 保护海洋环境等方面具有潜在的巨大优势。
作者比较分析了3种获取高分辨NMR谱的方法, 给出了对应的实验验证, 并介绍了一些具体应用。萃取法和MAS方法能够获得高分辨NMR谱图, 缺点是这两种方法都会对实验对象造成不同程度的损伤。基于iMQC的NMR方法能够在对生物体不损伤的情况下进行原位、在体检测。但其缺点是固有的低灵敏度。因此, 如何提高iMQC方法的灵敏度, 如何利用iMQC方法获得高分辨、高灵敏度的NMR谱是今后研究的重要课题。
[1] Shockcor J P, Wrum R M, Silver I S, et al. Metabolife structure elucidation using NMR mirco-nano- detection[J]. Tetrahedron Letters, 1994, 35(28): 4919-4922.
[2] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemical Physics, 1959,37(8): 911-917.
[3] Vanzijl P C M. The use of deuterium as a nucleus for locking, shimming, and measuring NMR at high magnetic fields[J]. Journal of Magnetic Resonance, 1987, 75(2): 335-344.
[4] Pettegrew J, Minshew N, Glonek T, et al.31P Nuclear magnetic resonance analysis of huntington and control brain[J]. Annals of Neurology, 1982, 12(1): 91-95.
[5] Gribbestad I S, Aursand M, Martinez I. High-resolution1H magnetic resonance spectroscopy of whole fish, fillets and extracts of farmedAtlantic salmon(Salmo salarL.) for quality assessment and compositional analyses[J]. Aquaculture, 2005, 250(1): 445-457.
[6] Maudsley A A. Modified carr purcell meiboom gill sequence for NMR fourier-imaging applications[J]. Journal of Magnetic Resonance, 1986, 69(3): 488-491.
[7] Falch E, Storseth T R, Aursand A. Multi-component analysis of marine lipids in fish gonads with emphasison phospholipids using high resolution NMR spectroscopy[J]. Chemisrty and Physics of Lipids, 2006, 144(1): 4-16.
[8] 叶朝辉. 魔角旋转核磁共振波谱学[J]. 波谱学杂志, 1984, 1(4): 415-416.
[9] Bankefors J, Kaszowska M, Pickova J, et al. A comparison of the metabolic profile on intact tissue and extracts of muscle and liver of juvenileAtlantic salmon(Salmo salarL.) - application to a short feeding study[J]. Food Chemistry, 2011, 129(4): 1397-1405.
[10] Ryner L N, Sorenson J A, Thomas M A. Localized 2D J-resolved1H MR spectroscopy strong coupling effects in vitro and in vivo[J]. Magnetic Resonance Imaging, 1995, 13(7): 1043-1044.
[11] Chen X, Lin M J, Chen Z, et al. Fast acquisition scheme for achieving high-resolution MRS with J-scaling under inhomogeneous fields[J]. Magnetic Resonance in Medicine, 2009, 61(4): 775-784.
[12] Takahashi K. More efficient utilization of fish and fisheries products[J]. Developments in Food Science, 2004, 42: 87-96.
[13] Vanschoonbeek K, Demaat M P M, Heemskerk J W M. Fish oil consumption and reduction of arterial disease[J]. Journal of Nutrition, 2003, 133(3): 657-660.
[14] Connor W E. Importance of n-3 fatty acids in health and disease[J]. American Journal of Clinical Nutrition, 2000, 71(1): 171S-175S.
[15] Mohr V. Control of nutritional and sensory quality of cultured fish[J]. Seafood Quality Determination, 1987, 9: 487-496.
[16] Pouliquen D, Omnes M H, Seguin F, et al. Changes in the dynamics of structured water and metabolite contents in early developing stages of eggs of turbot[J]. Comparative Biochemistry and Physiology B: Biochemistry and Molecular Biology, 1998, 120(4): 715-726.
[17] Rezzi S, Giani I, Heberger K, et al. Classification of gilthead sea bream (Sparus aurata) from1H NMR lipid profiling combined with principal component and linear discriminant analysis[J]. Journal of Agricultural and Food Chemistry, 2007, 55(24): 9963-9968.
[18] Tyl C E, Brecker L, Wagner K H.1H NMR spectroscopy as tool to follow changes in the fatty acids of fish oils[J]. European Journal of Lipid Science and Technology, 2008, 110(2): 141-148.
[19] Aursand M, Standal I B, Prael A, et al.13C NMR pattern recognition techniques for the classification of Atlantic salmon (Salmo salarL.) according to their wild, farmed, and geographical origin[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3444-3451.
[20] Specht D F. Probabilistic neural networks and the polynomial adaline as complementary techniques for classification[J]. Neural Networks, IEEE Trans, 1990, 1(1): 111-121.
[21] Cortes C, Vapnik V. Support vector networks[J]. Machine Learning, 1995, 20(3): 273-297.
[22] Trocino A, Xiccato G, Majolini D, et al. Assessing the quality of organic and conventionally-farmed European sea bass (Dicentrarchus labrax)[J]. Food Chemistry, 2012, 131(2): 427-433.
[23] Gunther U L, Ludwig C, Ruterjans H. NMRLAB - advanced NMR data processing in MATLAB[J]. Journal of Magnetic Resonance, 2000, 145(2): 201-208.
[24] Wold S, Esbensen K, Geladi P. Principal component anlysis[J]. Chemometrics and Intelligent Laboratory Systems, 1987, 2(1): 37-52.
[25] Viegas I, Jarak I, Leston S, et al. Analysis of glucose metabolism in farmed European sea bass (Dicentrarchus labraxL.) using deuterated water[J]. Comparative Biochemistry and Physiology A: Physiology, 2011, 160(3): 341-347.
[26] 刑丽红, 孙伟红, 苗钧魁, 等. 三聚氰胺在大菱鲆体内的代谢消除规律研究[J]. 海洋科学, 2011, 35(1): 66-69.
[27] Farag M A, Porzel A, Schmidt J, et al. Metabolite profiling and fingerprinting of commercial cultivars ofHumulus lupulusL.(hop): a comparison of MS and NMR methods in metabolomics[J]. Metabolomics, 2012, 8(3): 492-507.
[28] Zhang L, Liu X L, You L P, et al. Benzo(a) pyrene-induced metabolic responses in Manila clamRuditapes philippinarumby proton nuclear magnetic resonance (1H NMR) based metabolomics[J]. Environmental Toxicology and Pharmacology, 2011, 32(2): 218-225.
[29] Ekman D R,Teng Q, Jensen K M,et al. NMR analysis of male fathead minnow urinary metabolites: A potential approach for studying impacts of chemical exposures[J]. Aquatic Toxicology, 2007, 85(2): 104-112.
[30] 朱榕璧, 彭树美, 张丽晶, 等.1H NMR及其在鱼糜制品加工和保藏中的应用[J]. 农产品加工学刊, 2008, 12: 22-24.
[31] Gudjonsdottir M, Arason S, Rustad T. The effects of pre-salting methods on water distribution and protein denaturation of dry salted and rehydrated cod - A low-field NMR study[J]. Journal of Food Engineering, 2011, 104(1): 23-29.
[32] Nott K P, Evans S D, Hall L D. Quantitative magnetic resonance imaging of fresh and frozen-thawed trout[J]. Magnetic Resonance Imaging, 1999, 17(3): 445-455.
