3株深海细菌的生理及分子生物学鉴定
2013-12-23侯兆君蒋富清张宝玉
侯兆君, 张 明, 蒋富清, 张宝玉
(1. 天津科技大学, 天津 300457; 2. 安徽省肥西县城建环保局, 安徽 肥西 231200; 3. 中国科学院 海洋研究所, 山东 青岛 266071)
海底沉积物和上部洋壳构成了海底深部生物圈, 蕴藏着丰富的物种资源。海底深部生物圈微生物的研究已成为21世纪海洋领域地学和生物学综合研究的一个生长点, 显示出旺盛的生命力和发展应用前景。
海底深部生物圈为极端环境, 是嗜冷、嗜热、嗜压、嗜酸、嗜碱、嗜盐或嗜低营养等极端环境微生物的理想来源。由于不同的生长特性, 传统的菌种鉴定方法很难进行。即使参照传统方法对一些深海细菌进行鉴定, 其结果也并非与手册中描述相符合, 往往存在一定差异[1-3]。或者有些细菌在不同培养条件下形态多变, 甚至在同一培养条件下菌落形态也不稳定。 因此迫切需要建立一些简单、方便、易于操作的鉴定方法对深海微生物进行分析, 为深海微生物资源的开发利用奠定基础。
目前16S rRNA基因无论在高等生物, 还是在原核生物鉴定中的应用证实其已成为属间、种间分类研究中最常用也是最有效的分子指标, 被广泛地应用于各种微生物的遗传特性和分子差异的研究[4], 同时国际上也建立了多个微生物16S rRNA序列数据库, 成为对微生物鉴定分类非常有用的参照系统。通过对未知微生物16S rRNA基因序列的测定和比较分析, 可以快速有效地对其进行鉴定。
作者从西菲律宾海底4 954 m深的沉积物中分离到一批细菌, 其最适生长温度均低于37℃。本文结合生理、电镜及分子生物学方法即应用16S rRNA基因作为分子指标对这些细菌进行分类鉴定, 并对其系统进化情况进行了分析。
1 材料与方法
1.1 菌株与培养基
菌株B2, B5, B6(暂定名)分离自水深4 954 m处的深海海泥中。2216E培养基: 酵母膏0.1%, 蛋白胨0.5 %, Fe4(PO4)30.005% , 琼脂1.5%, 加入过滤后的自然海水配制, pH 7.2~ 8.0。
1.2 菌株的分离与形态观察
首先用无菌刀片将冰冻的泥样上层削去, 用酒精灯灼烧该刀片, 冷却后用刀尖取少许泥样于无菌液体培养基, 上述培养液在4℃培养7~10 d, 转接相应的固体培养基, 培养观察是否有菌落生成, 菌落形态用光学显微镜和KYKY2008B扫描电镜观察。
1.3 菌株的最适生长条件测定
1.3.1 耐盐性与需盐性
测定方法参照常见细菌系统鉴定手册[5]。
1.3.2 最适生长温度的测定
单菌于17℃±1℃左右培养至指数生长期, 然后接种于10 mL 2216E培养基中, 在6、10 15、20、28、37℃等温度下培养48 h, 取菌液测吸光度A600。并绘制温度-生长曲线。
1.3.3 最适初始pH测定
于2216E液体培养基中15℃培养至指数生长期, 然后接种于不同起始pH(pH6~14)的10 mL液体培养基中。150 r/min, 15℃恒温培养12 h, 取菌液测其吸光度A600。并绘制pH-生长曲线。
1.4 细菌DNA的制备
采用细菌单菌落直接PCR扩增法, 参照文献[4]制备细菌DNA。即取一单菌落溶于10μLSDS(1%)溶液中, 充分振荡摇匀, 用300 µL TE溶解获得DNA原液。将原液按一定的梯度稀释作为PCR扩增模板。
1.5 16S rDNA的PCR扩增及克隆
采用细菌通用引物8F: 5′-AGAGTTTGATCCT- GGCTCAG-3′1492R: 5′-GTTACCTTGTTACGACTT- 3′。50 μL扩增反应体系含有: 50 mmol/L KCl, 10 mmol/L Tris-HCl (pH8.3), 1.5 mmol/LMgCl2, 细菌DNA模板约10 ng, 1.5 mmol/L MgCl2, 0.2 mmol/L dNTPs, 0.2 μmol/L引物, 0.3 U/μL Taq DNAase。 每次均设阴性对照, PCR反应条件如下: 96℃变性4 min, 94℃变性30 s, 59℃退火45 s, 72℃延伸1 min, 10个循环后, 94℃变性30 s, 54℃退火45 s, 72℃延伸1 min, 最后是72℃延伸10 min。在Ependdorf Mastercycler Gradient基因扩增仪上完成。扩增产物以1.0%琼脂糖凝胶电泳检测, 用凝胶成像系统Pharmacia Biotech ImageMaster VDS记录实验结果。
切胶回收纯化约1.5 kb目的DNA片段。用T4DNA连接酶将纯化的片断与pMD18-T vector载体 (购自Takara)连接, 然后热激转化Escherichia coliDH 5α感受态细胞。以氨苄青霉素(100 mg/L)抗性和蓝白斑筛选阳性转化子。菌液经PCR检测为含目的片断的阳性转化菌后, 交由上海博亚生物技术有限公司进行测序。
1.6 系统发育学关系分析
序列的多重排列用BioEdit 中的Clastal W 程序完成, 转换至phylip 3.6, Bootstrap value 设为1 000, 得到的树文件用Treeview 3.2输出。
2 结果与分析
2.1 菌株的分离与形态观察
根据上述方法获得3株菌, 根据采集位置的不同暂命名为B2、B5与B6。B2菌为橙黄色圆形不透明菌落; B5为鲜红色的圆形菌落; B6为乳白色圆形不透明菌落。菌落见图1。各菌株的扫描电镜照片见图2。从SEM照片上可以看出, B2和B6菌均为杆状细菌, 但B6菌的外面覆有鞘膜。B5菌为球形。
2.2 菌株最适生长温度、盐度及pH
2.2.1 最适温度
温度测试表明, 3株菌在4℃均能生长, 但3株菌株最适温度分别约为20、28、28℃, B2菌20℃开始出现浑浊, 温度超过28℃生长开始缓慢(图3)。
2.2.2 最适盐度
观察结果表明B2在盐度3%~10%生长良好; B5和B6菌在盐度3%~7%能够生长, 盐度10%不生长。

图1 3株菌菌落形态图片 Fig. 1 Optical images of 3 strains of deep-sea bacteria

图2 3株深海菌的电子扫描照片 Fig. 2 SEM images of 3 strains of deep-sea bacteria
2.2.3 最适pH
pH测试表明, B2菌在pH 8时生长良好, pH超过8, 生长明显缓慢; B5菌也在pH 8生长良好, pH超过10, 生长明显缓慢; B6菌在pH 12下生长的最好, pH超过13, 生长明显缓慢(图4)。
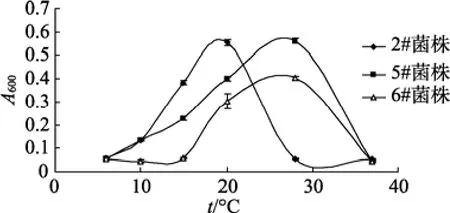
图3 温度对3株菌生长的影响 Fig. 3 Changes of bacteria density at different temperature
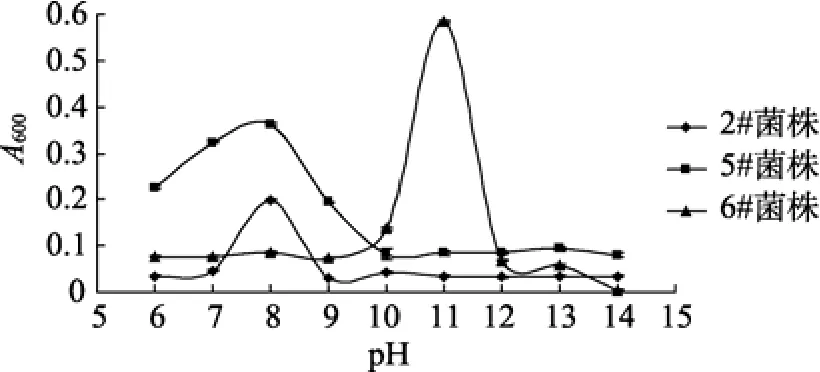
图4 pH对3株菌生长的影响 Fig. 4 Changes of bacteria density at different pH
2.3 菌株16S rDNA序列分析及系统发育分析[6]
采用上述引物, B2菌16S rDNA的PCR产物共获得1 406个碱基, B5为1 414个; B6 为 1 399 个。上述序列已提交到GenBank, 获得的序列号分别是: AY822610; DQ513408; DQ407272。
B2菌16S rDNA的序列同源性分析表明, 它与GenBank中Bacillus菌(Acession number : AF221855、AY690690、BSP315068、BSP244686、BSP391199等)有高达99%的同源性(表1), 而这些细菌分别是海洋杆状细菌或海洋土壤杆状细菌, 另外, 在系统进化树(图5)上的聚类分析也表明, B2菌与海洋杆状细菌或海洋土壤杆状细菌的亲缘关系也最近, 因此该菌应该属于海洋杆状细菌。
B5菌16S rDNA的序列同源性分析表明, 它与GenBank中Arthrobacter菌(Acession number: AF479354、AF511518、AY131225、AY576708、DQ177488等)有高达99%的同源性(表1), 而这些细菌属于Arthrobacter菌, 均为从冰冻土壤或深海中分离出来的细菌, 为海洋土壤中常见菌。另外, 系统进化树(图 5)上的聚类分析也表明, B5菌与Arthrobacter菌属细菌的亲缘关系也最近, 因此该菌应该属于Arthrobacter菌属。
B6菌的16S rDNA的序列同源性分析表明, 它与GenBank中Acinetobacter菌(Acession number : AF188300、AF324537、AF468386、AY055373、AY994049、DQ088799等)有高达99%的同源性(表1), 而这些细菌是从深海中分离出来的Acinetobacter johnsonii, 另外, 在系统进化树(图5)上的聚类分析也表明, B6菌与这些细菌的亲缘关系也最近, 因此该菌应该属于Acinetobacter johnsonii。
一般认为16S rRNA 序列同源性小于98%, 可以认为属于不同的种, 同源性小于93%~95%, 可以认为属于不同的属[7-8]。综上所述, 本文研究的3株细菌应该分别属于芽孢杆菌(Bacillus)、节杆菌(Arthrobacter)、蛋白菌(Acinetobacter)3个不同的菌属, 这3个菌属为从深海中分离出来的能够培养的常见菌属[9-11]。
3 讨论
由于传统微生物培养法的局限以及海底深部生物圈生境的特殊性, 能够培养的微生物数量非常有限, 常常低于总细胞计数的1%[12]。为克服传统培养法的局限, 16S rRNA基因序列和系统进化分析近年来得以广泛应用。分子技术研究表明, 海底深部生物圈不但蕴藏了丰富的微生物种类, 并且许多种类与目前已描述的所有细菌和古菌都相距甚远, 代表着新颖的微生物物种或类群。
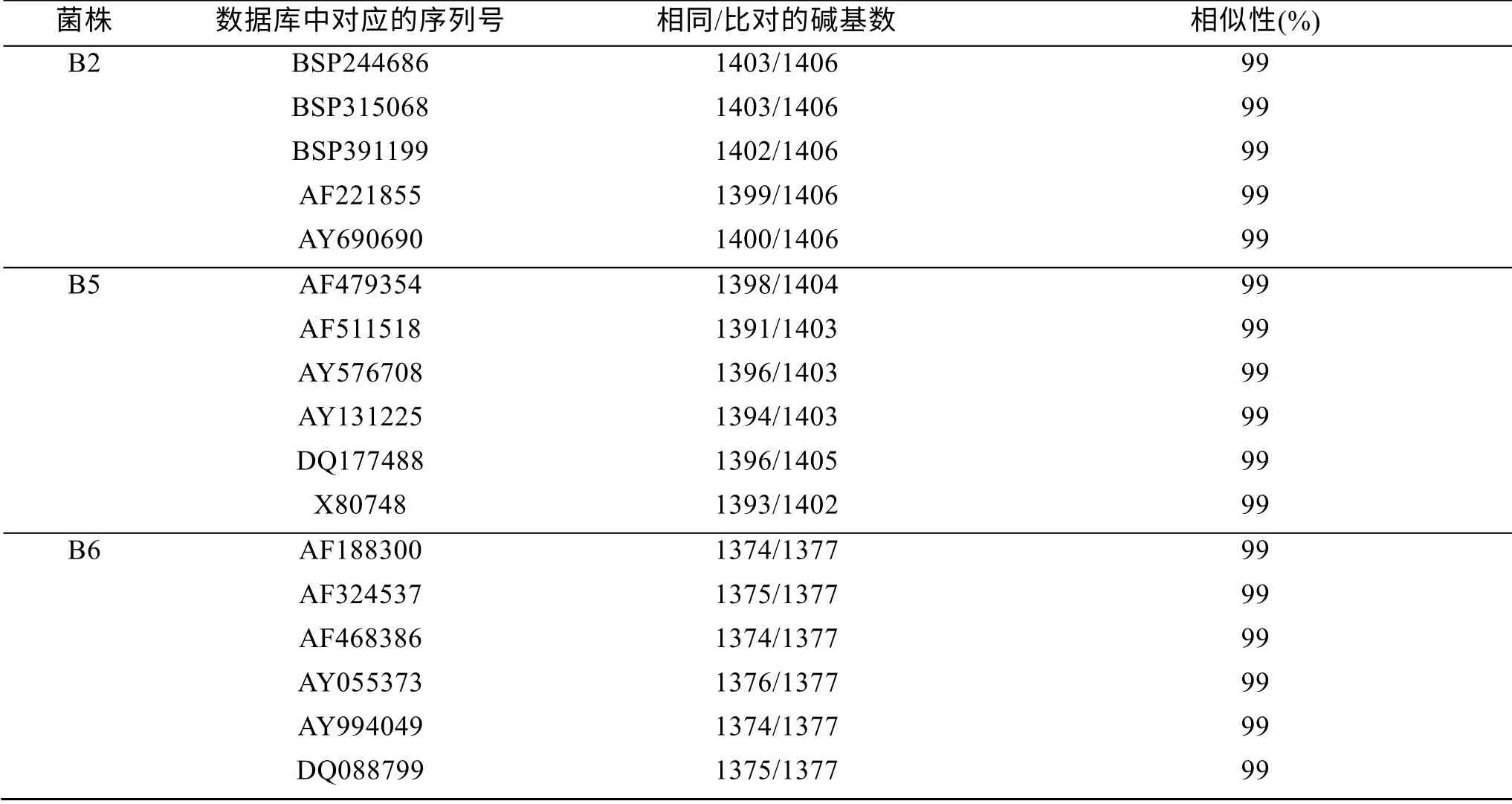
表1 深海微生物16S rDNA基因序列比对结果 Tab. 1 The BLAST results of 3 strains of deep-sea bacteria
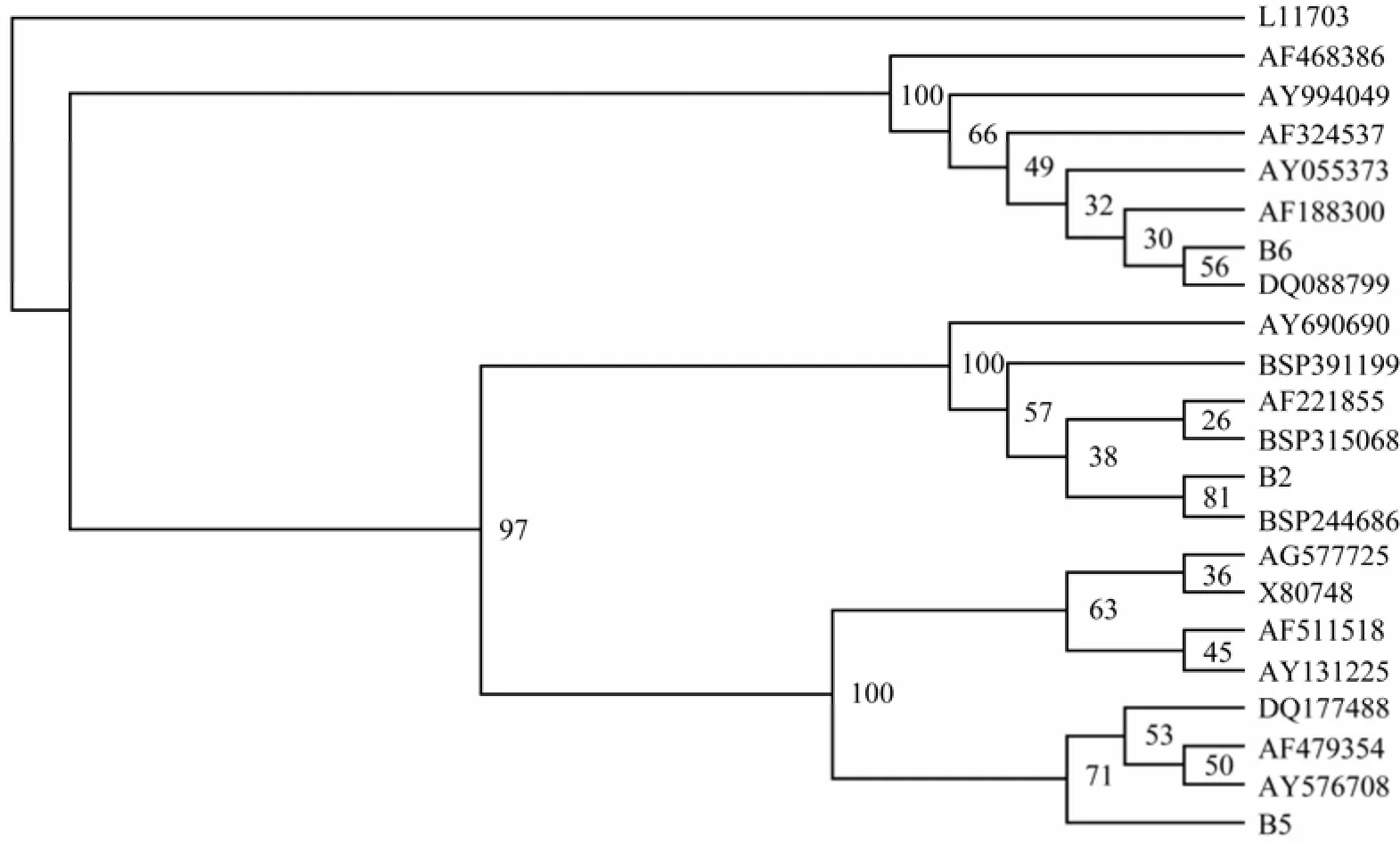
图5 根据16S rDNA序列构建的深海细菌系统进化树 Fig. 5 Phylogenetic tree of deep-sea bacteria with 16S rDNA sequences by NJ method L11703 (Thermonema lapsum) is outgroup
海底4 954 m 基本上是一个无光、高盐等极性环境。我们获得的菌株从生长温度及对光的需求方面来看, 加上我们严格的无菌操作, 应该确定所获得的菌株是深海细菌。
按照最适生长温度和生长上限温度的不同, 深海细菌一般被分为2大类: 嗜冷型(psychrophilic)和耐冷型 (psychrotrophic 或 psychrotolerant)。其中, 嗜冷菌通常是指最适生长温度≤15℃, 生长上限温度<20℃的菌株; 耐冷菌则是指能够在4℃左右良好生长、但最适生长温度>20℃的微生物[13]。根据该规定, 我们所获得的3株菌应该属于耐冷菌范畴。
传统的菌种鉴定是选用不同的代谢底物作为碳源和氮源, 将菌株利用碳、氮源的能力作为鉴定指标, 该方法建立在37℃菌株能够正常生长的前提之上。而深海微生物的最适生长温度或者低于37℃, 或者高于37℃, 也就是说在37℃无法正常生长或根本无法生长。因此作者在参照常见细菌系统鉴定手册对其进行鉴定时, 往往无法获得理想结果。因此, 无法参照常规方法对其进行鉴定分类。通过16S rRNA基因序列同源性比较并结合系统发育分析, 往往能够对极端微生物进行快速、准确的初步分类, 并且这一方法已广泛应用于极端环境下细菌的鉴定, 都取得了较好的结果[14-16]。
[1] Kämpfer P, Steiof M, Becker P M, et al. Characterization of chemoheterotrophic bacteria associated with the in situ bioremediation of a waste-oil contaminated site [J]. Microbial Ecology, 26 (2): 161-188.
[2] 俞勇, 李会荣, 陈波. 一株产海藻糖合成酶南极海洋低温细菌的鉴定[J]. 极地研究, 2005, 17(2): 127-133.
[3] 王远亮, 李光玉, 东秀珠,等. 中国大陆科学钻探(CCSD)微生物研究——地下3900 m一株细菌的分离鉴定[J]. 岩石学报, 2005, 21(2): 540-544
[4] 戴欣, 陈月琴, 周惠, 等. 海洋细菌的分子鉴定分类[J].中山大学学报(自然科学版)2000, 39(1): 68-71.
[5] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[6] 吕明生, 王淑军, 房耀维, 等.一株产低温右旋糖苷酶海洋细菌的筛选和鉴定[J]. 海洋科学, 2011, 35(5): 32-37.
[7] Devereux R, He S H, Doyle C L, et al. Diversity and origin of Desulfovibrio species: phylogenetic definition of a family[J]. Bacteriol.1990, 172: 3609-3619.
[8] Fry N K., Warwick S, Saunders N A, et al. The use of 16S ribosomal RNA analyses to investigate the phylogeny of the family Legionellaceae.[J]. Gen. Microbiol.1991,137: 1215-1222.
[9] Bowman J P, Mccammon S A, Brown M V, et al. Diversity and association of psychrophilic bacteria in Antarctic Sea ice [J]. Applied and Environmental Microbiology, 1997, 63(8): 3068-3078.
[10] Thorseth I H, Torsvik T, Torsvik V, et al. Diversity of life in ocean floor basalt [J]. Earth and Planetary Science Letters, 2001, 194: 31-37.
[11] Toffin L, Webster G, Weightman A J, et al. Molercular monitoring of culturable bacteria from deep-sea sediment of the Nankai Trough, Leg190 Ocean Drilling Program [J]. FEMS Microbiology Ecology, 2004, 48: 357-367.
[12] Parkes R J, Gragg B A, Wellsburg P. Recent studies on bacterial populations and processes in subseafloor sediments: A review [J]. Hydrogeological Journal, 2000, 8(1): 11-28.
[13] Morita R Y. Psychrophilic bacteria[J]. Bateriological Reviews, 1975, 39(2): 144-167.
[14] Yanagibayashi M, Nogi Y, Li L, et al. Changes in the microbial community in Japan Trench sediment from a depth of 6292 m during cultivation without decompression [J]. FEMS Microbiology Letters, 1999, 170: 271-279.
[15] Takai K, Inagaki F, Nakagawa S, et al. Isolation and phylogenetic diversity of members of previously uncultivated ε-proteobacteria in deep-sea hydrothermal fields [J]. FEMS Microbiology Letters, 2003, 218: 167-174.
[16] 徐庆强, 张志明, 王延明, 等. 产碱性纤维素酶海洋细菌的筛选、鉴定及酶学性质研究[J].海洋科学, 2009, 33 (7): 1-5.
