海湾扇贝混交家系中优先受精以及自然选择压力下杂合子过剩的研究
2013-12-23张守都张国范
张守都, 许 飞, 李 莉, 张国范
(1.中国科学院 海洋研究所,山东 青岛 266071; 2.中国科学院 研究生院, 北京100049)
海湾扇贝(Argopecten irradians)原产于美国大西洋沿岸, 于1982年引进我国并成为我国最重要的养殖经济贝类之一[1]。海湾扇贝作为雌雄同体生物可通过自交进行繁殖, 这对育种工作十分有利, 有时只需少量个体即可成功扩繁具有一定规模的群体。但是这种近交的便利加上我国海湾扇贝育苗产业的车间化等特点, 连续多年的小规模的群体内繁育导致我国海湾扇贝养殖群体近交衰退严重[2]。虽然重新引种工作可以从某种程度上解决这个问题, 但是由于对海湾扇贝这种生物的近交行为的缺乏理解和在产业中的一些不恰当的操作行为, 国内海湾扇贝的产业的发展陷入了引种-衰退-再引种-再衰退的恶性循环, 这无疑加剧了整个产业发展的成本和不便。为此人们开展了大量的关于海湾扇贝近交方面的研究[3-4]。
自体受精的繁殖方式在生物交配方式的进化上具有举足轻重的地位, 在生物群体高度自交和严重的近交衰退的情况下, 对近交的选择压力迫使生物群体向杂交的交配方式进化并维持这种交配方 式[5-6]。作者研究发现我国海湾扇贝养殖群体近交衰退严重[2], 虽然不会在几十年的时间内出现交配方式的急剧变化, 但是作者探讨在高度的近交衰退和面临高强度的对近交的选择压力下海湾扇贝中国养殖群体的驯化反应, 包括在混交情况下的优先受精和自然选择压力下的杂合子过剩问题。
1 材料与方法
1.1 亲贝的获取和培养
实验所用亲贝为随机选自我国海湾扇贝养殖群体的红贝和黑贝个体, 所有实验用亲贝均同时在胶南市龙湾海珍品育值有限公司育苗车间进行性腺促熟,培育方法参照张福绥等[1], 整个促熟过程遵循无公害食品海湾扇贝养殖技术规范NY/T 5063-2001。
1.2 产卵和受精
从生产群体中随机挑选 10只性腺发育至第四期[7]的个体(红、黑个体各一只)在空气中阴干30min , 然后对每只扇贝注射的五羟色胺[8], 将每一个准备好的扇贝逐一放入一个单独容器中待产, 每个容器中注入23℃沙滤海水, 大约30 min后所处理扇贝会首先排放精子, 收集质量好的精子备用, 接下来中间会出现一个10 min左右的暂停期, 将扇贝用新鲜海水冲洗几遍后放回烧杯中, 待其进一步排放卵子。为了进一步防止自体受精, 第1次排放卵子弃之不用, 接下来每次收集卵子均进行洗卵, 然后收集在显微镜下检查过的未被污染的(即未自体受精)卵子备用, 这样共分别收集到10只扇贝未受精的卵子和精子。
将10只扇贝两两随机分组进行受精, 首先根据精液在烧杯中的透光度将每组的两只扇贝的精子分别稀释至浓度一致, 并镜检判断精子活力相一致。然后将等体积的两个扇贝的精液混匀分别给收集好的两只扇贝未污染的卵子受精。另外对每个扇贝的部分卵子做自体受精即自交组作为杂交组的对照。每两只扇贝组合中共形成红♀×混合♂, 黑♀×混合♂双向两个混交组和红♀×红♂, 黑♀×黑♂两个自交组共4个不同遗传组。将红♀×混合♂, 黑♀×混合♂两个混交组混合孵化, 在接下来中将统称混交组。这样5对扇贝组合共形成5个实验组, 每个实验组设置3个重复。5个实验组中的混交系分别命名为M1、M2、RW-01、RB-03和WP-03。
1.3 幼虫培养和稚贝、亲贝的养成
在受精卵孵化24 h后, 用300目的筛绢对孵化D形幼虫进行选优, 幼虫的起始培养密度被设置为 10个/mL, 各组培养在40 L的白塑桶23℃沙滤海水中并在相同的环境条件下培养。幼虫的前期饵料为金藻, 后期为金藻、扁藻和小硅藻等。 投饵量和投饵次数随幼虫增长而增加, 确保每天全换水一次。
8~10 d时幼虫开始出现眼点。当30%左右的幼虫出现眼点时开始投放附着基(聚已烯网廉) 每个塑料桶中投廉片数依幼虫多少而定。在受精20 d时, 附着基被装入60目的聚乙烯网袋挂至海上开始进入海上保苗期, 随着稚贝的长大网袋由 60目逐渐地更换成40目、30目。最后稚贝当稚贝的壳长达到 5 mm 以上时也被从附着基上洗刷下来转入18目网袋中培养, 至稚贝壳长生长至2~3 cm时移入带有标记牌的扇贝暂养笼暂养, 密度设置每层 250 个。 随着扇贝的长大每层减少至100个再到50个, 而后进入带有标记牌)养成笼, 密度设置每层30个。幼虫培育、稚贝的保苗和养成过程中任何个体没有被随意地丢弃。
1.4 数据测量和样品固定
对各个混交系的受精后6 h担轮幼虫、1 dD形幼虫、20 d稚贝、40 d稚贝、3个月稚贝和成贝的分别进行取样以酒精固定以备后期分析。并对每组的混交系和自交系的1 dD形幼虫、20 d稚贝、40 d稚贝、3个月稚贝和成贝的壳长进行测量。
1.5 以微卫星进行杂合子测定
1.5.1 DNA的提取
担轮幼虫和1 dD形幼虫的DNA提取方法参照战文斌等, 稚贝和成贝DNA用天根生化科技有限公司的Fast200 DNA 提取试剂盒参照厂家说明书提取。
1.5.2 以微卫星对各个时期杂合子比例的测定
从已经发表的海湾扇贝微卫星标记中[9-11]为5组混交系筛选出各一对在父母本中均有特异等位基因的标记(表1), 并以特异等位基因的杂交来判断出混交系中的杂合子。15 μL的PCR反应体系为1× PCR buffer, 0.34 μmol/L的引物, 200 μmol/L的dNTP, 1.5 mm MgCl2, 0.5 U Taq酶和大约50 ng的DNA 模板。所有反应均在TaKaRa TP600 PCR仪上进行。PCR反应程序设定为: 94℃5 min; 94℃30 s, 退火30 s (各引物退火温度见表1)和72℃ 30 s,35个循环; 最后延伸72℃5 min。PCR 产物用12% 聚丙烯酰胺凝胶上电泳分离, 经EB染色后进行荧光显影摄像。用Gel-Pro Analyzer 软件(version 7.0, available at http://www.mediacy.com) 进行带型大小的分析。
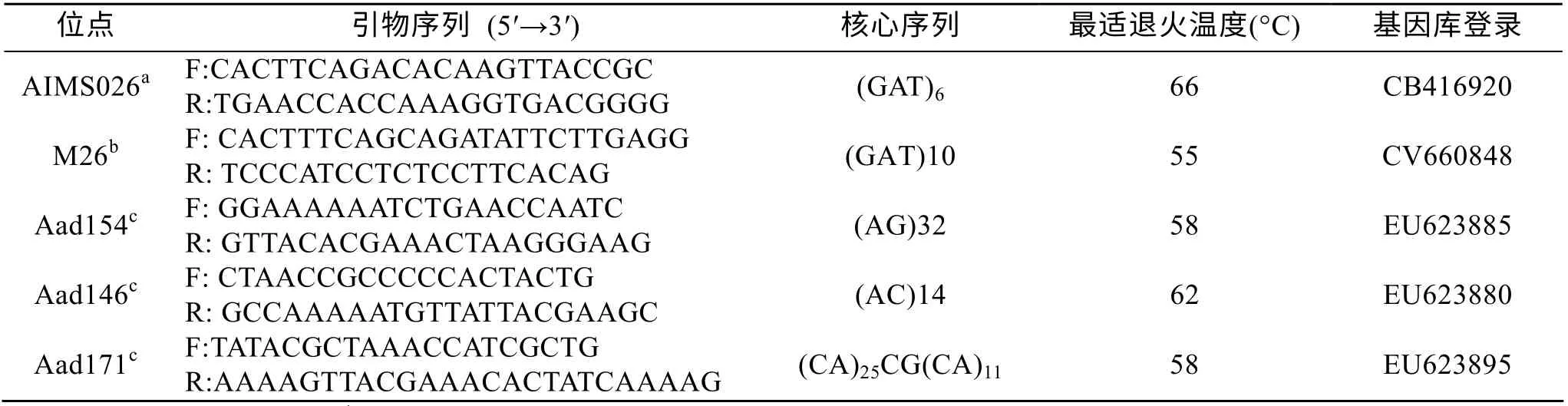
表1 用于对5组混交系杂合比例分析的5对微卫星分子标记的情况 Tab. 1 Primer sequences, repeat types, and PCR conditions for microsatellite loci used in this study
1.6 数据分析
杂交优势的计算方法参考Cruz等[8]的方法:
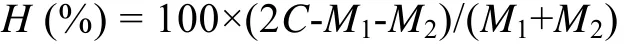
式中,H为杂种优势,C、M1和M2分别为混交组和两个自交组在同一日龄的壳长。
对各个时间点间的杂合子比例和杂交优势率的数据比较用软件SPSS 17.0的One-Way ANOVA命令进行方差分析, 差异显著性设为P<0.05。
用excel的CHITEST函数对混交系的杂合子比例进行卡方检验是否发生对随机的偏离, 对杂合子比例和杂交优势率的变化趋势通过散点图添加趋势线方式进行相关性图例分析。
2 结果与分析
2.1 杂交优势率的变化
图1列出了海湾扇贝3个混交实验组的混交系相对于自交组在不同时期的壳长杂交优势率的情况(分别以各个实验组中的混交系RW-01、RB-03和WP-03表示, 另外两个实验组的混交系M1和M2未能获取变态后的数据, 在此未列出)。结果显示杂交优势率随着发育时间推移逐渐变大。对1 d的D形幼虫、20 d的稚贝、40 d的稚贝、3个月的稚贝以及成贝等时期的杂交优势率进行单因素方差分析显示各个时期的杂交优势率的差异显著(P<0.05)(表2)。
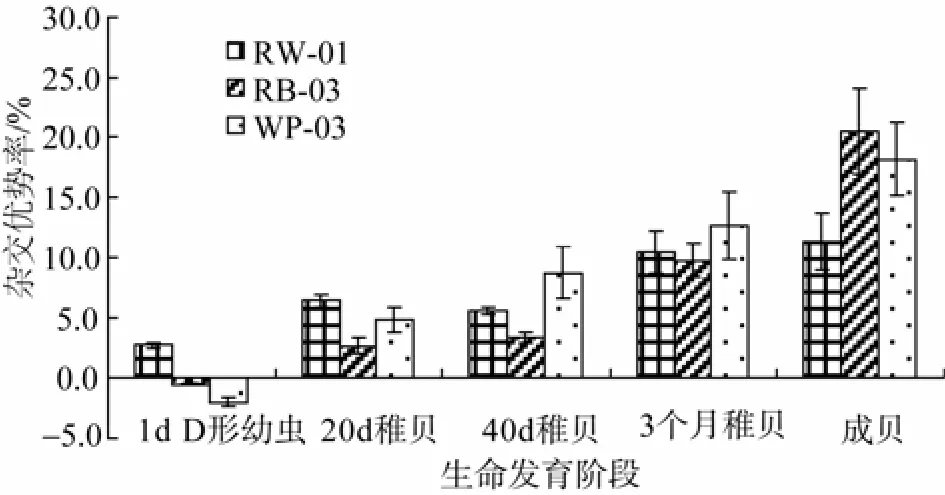
图1 海湾扇贝3个混交系在发育各个时期杂交优势率 Fig. 1 Shell length Heterosis of three mixed families compared with their controls at six phases

表2 对发育不同时期的杂合子比例和杂交优势率的单因素方差分析 Tab. 2 Analyses of variance for hybrid proportions and shell length heterosis
2.2 以微卫星分子标记进行的杂合子比例测定
用5对选定的在父母本中具有特异等位基因(图2)的位点(表1), 分别对5组混交系从担轮幼虫(由于有两组的担轮幼虫损坏, 所以担轮期只有3组进行了鉴定)、1 d的D形幼虫、20 d的稚贝、40 d的稚贝、3个月的稚贝以及成贝等时期的杂交比例进行鉴定。
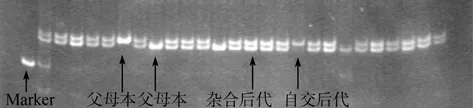
图2 父母本AA×BB模式的后代杂合情况图示 Fig. 2 Preferential fertilization examination under AA×BB parents model
结果显示3组混交系在担轮幼虫期杂合子比例均高于50%, 担经卡方检验只有一组发生显著偏离随机水平(P<0.05)。随着时间杂合子比例逐渐上升, 最高甚至达到100%(图3)。
以发育的不同时期为因素进行单因素方差分析发现, 在不同的时期的杂合子比例具有显著的变化(P<0.05)(表2)。
2.3 杂交优势率变化和杂合子比例变化的相关性分析
对杂交优势的变化和杂合子比例的变化进行相关性分析, 发现两者的变化呈正相关(图4)。
3 讨论
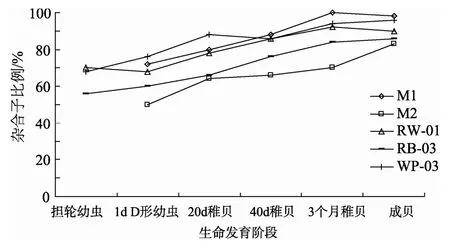
图3 海湾扇贝5个混交系在各个时期杂合子比例的变化情况 Fig.3 The hybrid proportion of the five bay scallop mixed families at six phases
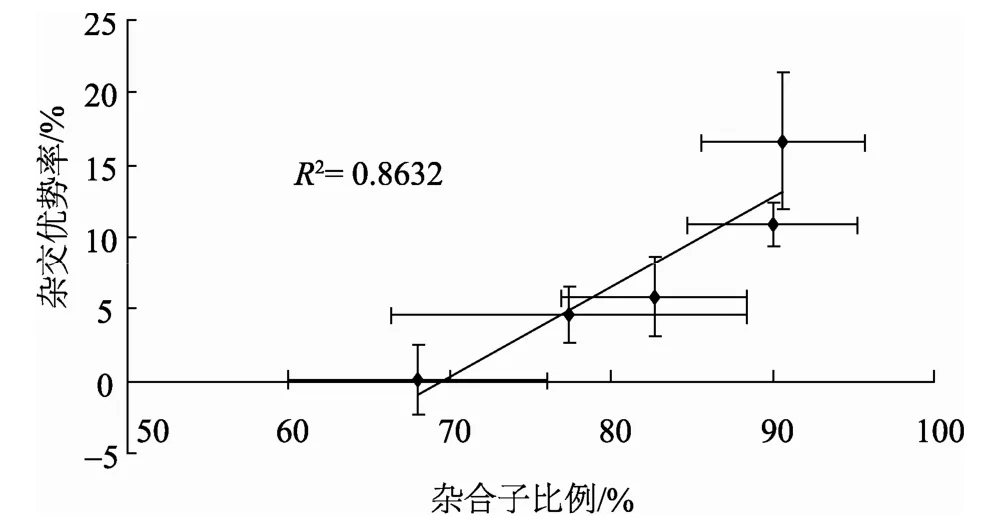
图4 壳长杂交优势率变化和杂合子比例变化的相关性分析 Fig. 4 Analyses of correlativity between hybrid proportions and shell length heterosis
对一个引进物种种群稳定的维持是育种工作者重要的工作目标。这对海湾扇贝这种极易自交的生 物物种尤其重要。工厂化育苗是海湾扇贝自从引种成功以后在我国的主要存在模式, 特定环境下的过小的种群数量就更加重了高度近交、自交的可能性。在这种独特的进化环境下人们研究自然选择压力对海湾扇贝交配方式的影响。生物交配方式的进化是物种进化的一个方面也是一个重要的手段。从长远来看研究发现自体受精自体受精生物在高度自交和严重近交衰退的情况下选择的压力迫使它向杂交的交配方式进化并维持这种交配方式包括自交不匹配和雌雄异体[5-6]。但是在较短的时间内作者认为一个生物种群如果能生存下来虽然不能发生交配方式的剧变但必然也能对自然选择有所应对措施。人们之前的工作发现海湾扇贝杂交家系传至第三代时即已经很难再往下维持, 但我国海湾扇贝自引种以来已数十年却能够较为稳定传代, 那么说明在这些群体中没有或较少自交至三代以上的个体即对自交行为存在一个较强的选择压力, 这种选择压力可能是来自受精前的精子选择或者是受精后对自交个体的选择。作者在海湾扇贝的混交家系构建过程中发现随着时间推移混交家系相对于自交家系的优势有逐渐扩大的趋势, 因为在混交家系中同时存在着杂交个体和自交个体, 作者猜想在这个过程中会有对自交个体有较强的选择现象而在混交系中凸显杂交个体的生长优势。
微卫星作为第二代共显性分子标记可以清晰地进行混交家系中的后代进行亲子鉴定。作者以对受精后6h的担轮幼虫的杂合子比例的鉴定来作为优先受精的判断标准。卡方结果显示3个实验组中只有1个发生随机的偏离即不能定义中国海湾扇贝在受精时对随机受精的偏离, 也就是在受精时卵子并没有对自体精子和异体精子产生倾向性的选择, 说明海湾扇贝引入中国的这段时间内, 虽然经受了群体内的高度自交和严重的近交衰退, 并没有出现向着自交不亲和或者雌雄异体等交配方式方向上的进化, 但在D形幼虫之后的杂合子比例却是逐渐上升的(图3), 这是与海湾扇贝的杂交家系一般比自交家系具有更高的存活率一致的, 即在中国海湾扇贝生长过程中杂合子的过剩是由对自交个体的选择导致的, 甚至有个别家系的杂合子比例接近100%。
不同发育阶段间的杂合子比例和杂种优势率的单因素方差分析结果显示杂合子比例或杂种优势率的上升变化是显著的(P<0.05)。而杂合子比例变化和杂种优势率的变化呈显著的相关性。这是很容易理解的, 因为在自然选择的压力下, 随着混交家系中的生长劣势的个体逐渐被淘汰而导致生长占优势的杂合个体的比例逐渐上升, 所以整个家系就表现出来越来越大的生长优势。作者认为, 中国的海湾扇贝群体就是在这种不断淘汰着自交个体和保留杂交个体的模式下得以传承下来的, 即表现问群体中的杂合子的显著过剩。
理解海湾扇贝的受精行为和对自然选择的应对对育种工作也有很大的启发, 在没有优先受精行为的存在下, 即所有的受精都是在精子随机入卵的基础上的进行, 而后期生长又表现大量的杂合子过剩并且这一比例逐渐升高, 也即是对自交个体的一个强烈选择过程。在这种情况下作者认为如果增加有效群体数量, 则会增加杂合子的比例, 减少对自交个体的淘汰, 进而可避免由对个体淘汰而导致的稀有等位基因的丢失或基因漂变, 延缓种质的衰退。
致谢: 感谢胶南市龙湾海珍品育殖有限公司为本研究提供了实验所用的场地以及所有设施。
[1] 张福绥, 何义朝, 刘祥生, 等. 海湾扇贝的引种、 育苗与试养[J].海洋与湖沼, 1986, l7(5): 367-374.
[2] 张国范, 郑怀平. 海湾扇贝养殖遗传学[M]. 北京: 科学出版社, 2009.
[3] 张国范, 刘述锡, 刘晓, 等. 海湾扇贝自交家系的建立和自交效应[J]. 中国水产科学, 2003, 10(6): 441-445.
[4] 郑怀平, 张国范, 刘晓, 等. 海湾扇贝杂交家系与自交家系生长和存活的比较[J]. 水产学报, 2004, 28(3): 267-272.
[5] Lloyd D G. Maintenance of gynodioecy and androdioecy in angiosperms[J]. Genetica, 1975,45 : 325-339.
[6] Charlesworth B, Charlesworth D. Model for evolution of dioecy and gynodioecy[J]. American Naturalist, 1978, 112, 975-997.
[7] Sastry, A N. Reproduction of the bay scallop aequipecten irradians lamarck. Influence of temperature on maturation and spawning[J].Biol Bull, 1963, 441: 146-153.
[8] Cruz P, Ibarra A M. Larval growth and survival of two catarina scallop (Argopecten circularis, Sowerby, 1835) populations and their reciprocal crosses[J]. J Exp Mar Biol Ecol, 1997, 212: 95-110.
[9] Zhan A B, Hu J J, Wang X L,et al. A panel of polymorphic EST-derived microsatellite loci for the bay scallop (Argopecten irradians) [J]. Journal of Molluscan Studies, 2006, 72: 436-438.
[10] Roberts S, Romano C,Gerlach G. Characterization of EST derived SSRs from the bay scallop,Argopecten irradians[J]. Molecular Ecology Notes, 2005, 5: 567-568.
[11] Li R H, Li Q,Yu R H. A set of polymorphic expressed sequence tag-derived microsatellites from the bay scallop,Argopecten irradians irradians, and their transportability in three other scallop species[J]. Journal of the World Aquaculture Society, 2008, 39: 138-141.
