盐霉素联合奥沙利铂对PANC 89的增殖及诱导凋亡的机制
2013-12-16戴维其郭传勇
何 磊,王 凡,戴维其,程 萍,沈 淼,郭传勇
(同济大学附属第十人民医院消化内科,上海 200072)
胰腺癌是最恶性的致死性肿瘤之一。在20年间,我国胰腺癌的发病率增长了近4倍[1-2]。胰腺癌5年生存率低于5%,有远处转移的进展期患者的5年生存率仅为2%,中位生存期不到6个月。由于受胰腺癌的解剖学、生物学特性及早期诊断各种局限,目前对胰腺癌的治疗缺乏一种有效的手段。盐霉素是由白色链霉素发酵产生的大小为751Da的一元羧酸聚醚类抗生素[3]。近年来,大量研究表明盐霉素可以抑制肿瘤的生长。盐霉素或许可以成为一种新的、高效的抗肿瘤药物。本实验通过观察盐霉素对人胰腺癌细胞株PANC89增殖、凋亡及其对奥沙利铂敏感性的影响,探讨盐霉素对胰腺癌治疗的可行性及可能的机制。
1 材料与方法
1.1 药物及试剂
人胰腺癌细胞株PANC89保存于本实验室,用含10%胎牛血清的DMEM高糖完全培养基培养于37℃、CO2体积分数为5%的培养箱中,每2~3 d传代1次,取对数生长期的细胞进行试验。
盐霉素(salinomycin,Sal)购自sigma公司,用DMSO溶解,配成50 mmol/L浓度,置于-20℃保存,使用时以DMEM高糖完全培养基稀释至所需浓度,使 DMSO终浓度<4‰(V/V);奥沙利铂(LOHP)购自江苏奥德赛制药有限公司,根据实验要求以DMEM高糖培养基稀释至不同浓度。DMEM高糖培养基及胎牛血清购自 Gibco公司,Cell Counting Kit-8及Hoechst33342染色试剂购自日本同仁株式会社,Annexin V/PI双染凋亡试剂盒购于Sigma公司,反转录试剂盒及RT-PCR试剂购买于TaKaRa公司,PCR引物由生工生物工程(上海)合成,BCA蛋白定量试剂盒购于美国Thermo公司。兔抗人Bcl-2抗体、兔抗人Bcl-2同源拮抗物Bak、兔抗人Bcl-2相关的X蛋白(Bax)抗体,兔抗人Bclxl抗体及兔抗人磷酸化p-GSK-3β抗体购自Santa Cruz公司;兔抗人β-catenin及鼠抗人β-actin抗体均购自CellSignaling Technology公司;鼠抗人GSK-3β抗体购自Abcam公司;DylightTM800标记的羊抗小鼠荧光二抗购于美国Rockland公司。
1.2 方法
各实验分溶剂对照组、盐霉素组、奥沙利铂组及其联合组。
1.2.1 CCK-8法测定奥沙利铂和盐霉素对人胰腺癌细胞株PANC89增殖的影响 以每孔5×103个细胞接种于96孔板内,置37℃、CO2体积分数为5%的培养箱中,24 h细胞贴壁后弃去培养液,奥沙利铂组每孔加入含不同浓度奥沙利铂的DMEM 高糖完全培养基200 μl,使奥沙利铂终浓度分别为0~25 mg/L,分为 5组分别为 5、10、15、20、25 mg/L,每一浓度设5个复孔。盐霉素组处理同上使每孔终浓度为0~50 μΜ,分别为10、20、30、40、50 μΜ,每一浓度设 5 个复孔,同时设无药对照组5孔。然后置37℃、CO2体积分数为5%的培养箱中继续培养,于加药后24、48、72 h 取出培养板,每孔加入20 μl CCK-8 试剂混匀继续温育3 h后,用全自动酶标仪检测波长在480 nm时的OD值。按以下公式计算细胞增殖抑制率:抑制率 =(OD无药对照组- OD实验组)/OD无药对照组。经CCK-8结果筛选后,联合用药盐霉素浓度为20 μΜ,奥沙利铂浓度为5 mg/L,重复实验并加入联合组。
1.2.2 Hoechst 33342染色法观察奥沙利铂和盐霉素对人胰腺癌细胞株PANC89凋亡的影响 以每孔2×104个细胞接种于24孔板内,经盐霉素20 μM、奥沙利铂5 mg/L或其联合处理细胞72 h后,用PBS洗 1 次并加入 500 μl培养基,再加入 2 μl Hoechst33342染液,混匀,37℃避光孵育15 min,荧光显微镜下观察并拍照。
1.2.3 AnnexinV/PI双染法检测奥沙利铂和盐霉素对人胰腺癌细胞株PANC 89的凋亡 经盐霉素20 μΜ、奥沙利铂5 mg/L或其联合处理细胞72 h后,计数2×105的细胞量制成细胞悬液,离心并用PBS 洗 2 次,加入10 μl AnnexinV 和5 μl PI,轻轻混匀,避光室温反应15 min,流式细胞仪检测细胞凋亡。
1.2.4 RT-PCR检测基因的mRNA表达水平 经盐霉素20 μΜ、奥沙利铂5 mg/L或其联合处理细胞72 h后,根据 Trizol试剂说明书提取细胞总RNA,再根据TaKaRa-PCR试剂盒说明书,反转录获得cDNA第一链,以cDNA模板为100 ng左右、20 μl反应体系条件下用 ABI 7900HT系统对此cDNA为模板进行目的片段扩增并分析每个组别内模板的循环数(Ct),以18 s为内参计算出各组别Caspase-3起始拷贝数(2-△△Ct)。引物根据Medline基因文库用Primer 5.0软件自行设计(表1)。

表1 引物序列Tab.1 Sequences for primers
1.2.5 Western bloting检测蛋白相对表达水平 经盐霉素20 μΜ、奥沙利铂5 mg/L或其联合处理细胞72 h后,用RIPA法提取各组细胞总蛋白并用BCA法定量蛋白,加入蛋白上样缓冲液沸水浴10 min使蛋白变性,采用10%聚丙烯酰胺凝胶电泳并转膜到PVDF膜上,封闭1 h,一抗单克隆抗体(1∶1 000稀释)4℃孵育过夜,TBST洗膜6次,每次10 min;然后DylightTM800标记的羊抗小鼠及羊抗兔荧光二抗用含5%脱脂奶粉的TBST以1∶1 000的浓度稀释后,孵育硝酸纤维素膜1 h。TBST洗膜两次,每次10 min,TBS洗膜1次,10 min。然后使用LI-COR公司的Odyssey红外荧光成像仪扫描,所得图像以灰度显示,经Photoshop CS2软件分析结果。
1.3 统计学方法
以上实验均独立重复三次。实验数据采用SPSS 13.0统计分析软件进行两独立样本t检验,数值采用(±s)形式表示。P<0.05为有统计学意义,检验水准 α =0.05。
2 结 果
2.1 盐霉素、奥沙利铂及联合运用对PANC89细胞增殖的影响
分别以不同的浓度梯度的盐霉素(0~50 μΜ)作用于人胰腺癌细胞株PANC89后,经CCk-8法测定发现盐霉素对于胰腺癌细胞的增殖有明显的抑制作用,并且抑制率有明显的浓度和时间依赖性(图1A)。同样也发现奥沙利铂(0~25 mg/L)对于PANC89的增殖的抑制也有明显的时间-浓度依赖性(图1B),差异具有统计学意义(P<0.05)。联合盐霉素20 μΜ和奥沙利铂5 mg/L作用于胰腺癌细胞株PANC89不同时间后,可以观察到联合用药对增殖的抑制明显高于单独用药时(图1C)。
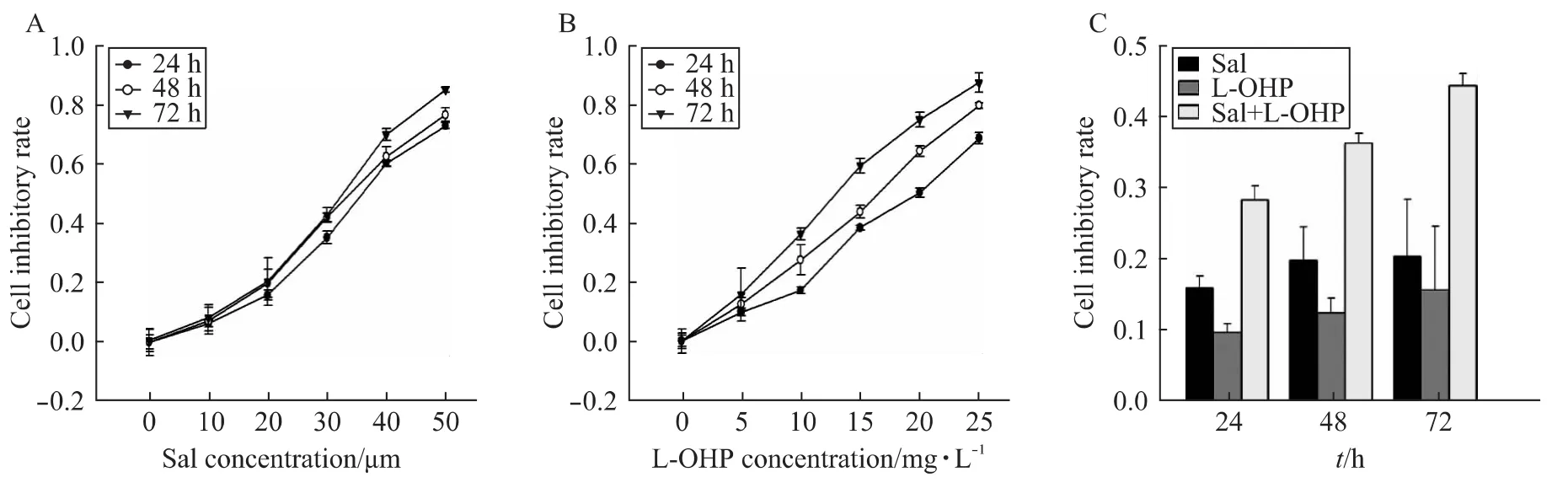
图1 不同浓度不同时间盐霉素、奥沙利铂及盐霉素联合奥沙利铂对PANC89细胞增殖的影响Fig.1 Effect of different concentrations of Sal,L-OHP and combined Sal with L-OHP on growth of human pancreatic cancer PANC89 cells at different time points
2.2 盐霉素联合奥沙利铂对PANC89细胞凋亡的影响
Hoechst33342染色发现,经盐霉素20 μΜ、奥沙利铂5 mg/L作用72 h后,相对于空白组药物处理组呈现出典型的凋亡改变(核固缩),荧光显微镜下表现高蓝光;并且联合盐霉素与奥沙利铂作用组的典型凋亡改变显著增加(图2A)。AnnexinV/PI双染法被用于进一步检测经处理后凋亡细胞的数量,结果表明相对于空白组,盐霉素联合奥沙利铂作用组的凋亡细胞明显增加,结果有统计学意义(P<0.05),见图2B。
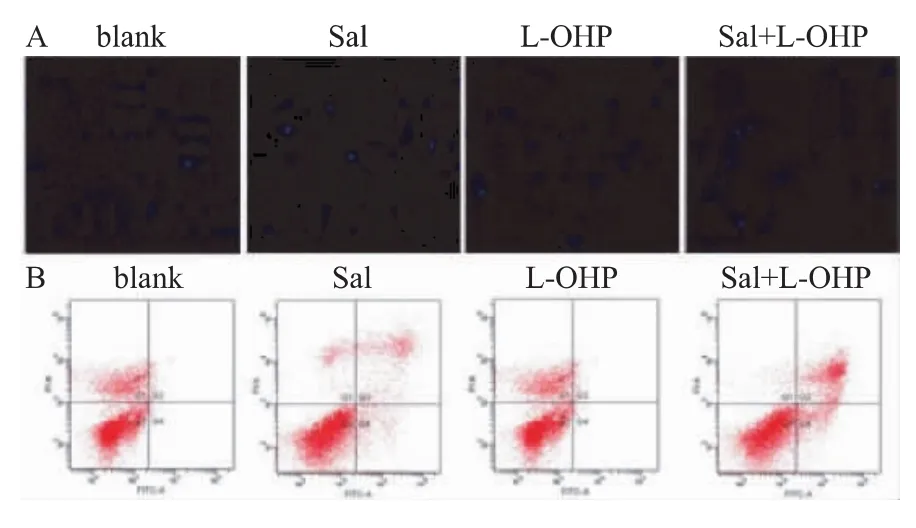
图2 盐霉素(20 μΜ)、奥沙利铂(5 mg/L)及盐霉素联合奥沙利铂对PANC89细胞凋亡的影响A:Hoechst33342染色观察细胞凋亡(200×)Fig.2 Effect of Sal(20 μΜ),L-OHP(5 mg/L)and combined Sal with L-OHP on apoptosis of human pancreatic cancer PANC89 cells
2.3 盐霉素联合奥沙利铂对PANC89细胞的凋亡相关基因的mRNA及蛋白水平的表达的影响
经盐霉素、奥沙利铂处理后,用realtime PCR和western blot检测凋亡相关基因的mRNA和蛋白水平的表达。结果表明,经过盐霉素和奥沙利铂联合处理后促凋亡基因Bax和Bak的mRNA和蛋白表达水平明显升高,而且可以有效地抑制抑凋亡基因Bcl-2和Bcl-xl的表达,差异有统计学意义(P<0.05),见图 3,图 4A。
2.4 盐霉素联合奥沙利铂对PANC89细胞Wnt信号通路的关键基因β-catenin、GSK-3β的mRNA及蛋白水平表达的影响
用药物处理后的胰腺癌细胞株,观察到Wnt/βcatenin通路中的关键基因β-catenin的mRNA和蛋白水平明显受到了抑制,同时p-GSK-3β的蛋白表达也降低了,差异有统计学意义(P<0.05),见图3,图4B。以上实验说明,盐霉素增敏奥沙利铂抗胰腺癌细胞株的凋亡的作用或许是通过对 Wnt/βcatenin通路的抑制所引起的。
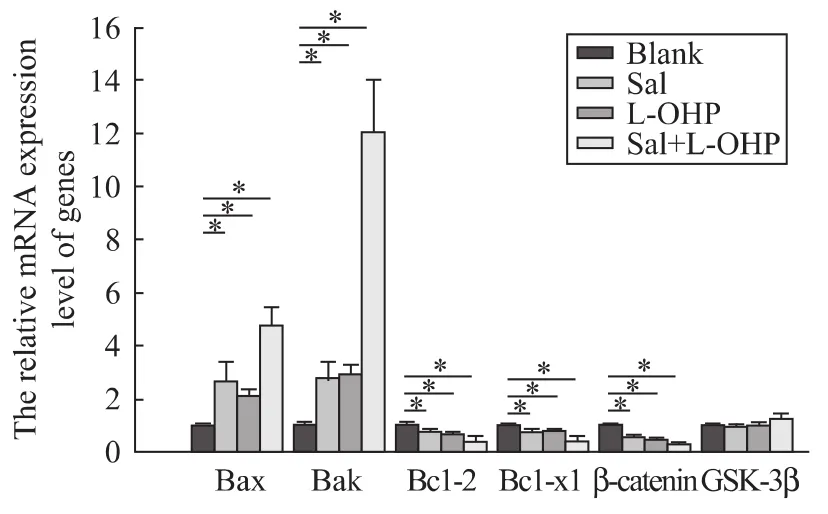
图3 盐霉素(20 μΜ)、奥沙利铂(5 mg/L)及盐霉素联合奥沙利铂对PANC89处理72 h后Bcl-2家族及β-catenin和GSK-3β的mRNA水平的表达(n=3,±s),P<0.05Fig.3 The mRNA expressions of Bcl-2 family,βcatenin and GSK-3β in human pancreatic cancer PANC89 cells after treated with Sal(20 μΜ),L-OHP(5 mg/L)and combined Sal with L-OHP(n=3,±s)
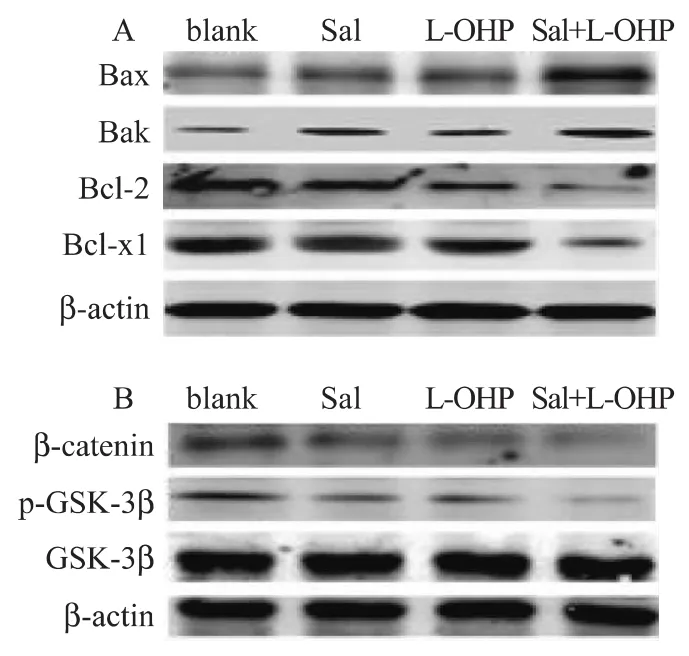
图4 盐霉素(20 μΜ)、奥沙利铂(5 mg/L)及盐霉素联合奥沙利铂对PANC89处理72 h后Bcl-2家族及βcatenin,GSK-3β和p-GSK-3β的蛋白水平的表达Fig.4 The proteins expressions of Bcl-2 family,β-catenin,GSK-3β and p-GSK-3β in human pancreatic cancer PANC89cells after treated with Sal(20 μΜ)、LOHP(5 mg/L)and combined Sal with L-OHP
3 讨 论
胰腺癌是全球最具侵袭性和致死性的肿瘤之一,在发达国家中胰腺癌在肿瘤死亡中位居第四位,在我国也是最常见的肿瘤之一。由于缺乏早期诊断及有效的治疗手段,胰腺癌患者的中期生存率低于6个月,而5年生存率更是低于5%。胰腺癌细胞对大多数抗肿瘤药物敏感性差,作为胰腺癌化疗的一线药物吉西他滨,临床研究发现只有12%的胰腺癌患者及仅有少数进展期肿瘤可被其治疗[4-5]。盐霉素是从白色链霉菌中分离的一种羧酸聚醚型离子载体抗生素,因其对包括风枝杆菌、疟原虫、艾美尔球虫菌等革兰阳性菌具有广谱杀菌作用,目前被广泛应用于家畜抗菌治疗中。Gupta等[6]最早在一个高通量的研究中发现了盐霉素可以在体外高效地抑制乳腺癌干细胞的增殖,从而提示盐霉素或许可用于治疗肿瘤,广泛用于抗革兰阳性菌,如结核分枝杆菌、金黄色葡萄球菌、真菌、疟原虫、和原生动物寄生虫等。近年来,有大量研究表明盐霉素可以抑制结肺癌、直肠癌、膀胱癌、淋巴瘤等肿瘤增殖和生长[7-11]。虽然盐霉素抗肿瘤生长的机制还不明确,但其或许可以成为一种新的有效的抗胰腺癌生长的药物。
本研究结果表明,盐霉素在体外可以明显抑制胰腺癌细胞株PANC89的增殖并且呈一定的剂量和时间依赖性。同时发现用盐霉素联合奥沙利铂处理后的肿瘤细胞的增殖,明显优于单用盐霉素和奥沙利铂;盐霉素可以增敏化疗药物奥沙利铂的抗肿瘤性。通过Hoechst33342染色,观察到盐霉素联合奥沙利铂处理后胰腺癌细胞的典型细胞凋亡表现细胞皱缩、核及胞质固缩明显增加了;并且通过AnnexinV/PI流式细胞仪检测也证实了上述实验结果。凋亡途径的调节紊乱可造成包括肿瘤在内的多种病理状态[12],Bcl-2家族是调控线粒体凋亡途径的主要调节因子。Bcl-2及Bcl-xl主要通过保护线粒体外膜透化(mitochondrialoutermember permeabilization,MOMP)或者拮抗促凋亡分子来减少凋亡[13]。Bak及Bax通过Drp1与线粒体膜稳定结合[14],同时可通过Bak与Mfns相互作用,来激活线粒体凋亡途径,促进细胞凋亡的发生。在本实验过程中,发现经盐霉素和奥沙利铂联合处理后的胰腺癌细胞株中促凋亡基因Bax和Bak的mRNA和蛋白表达明显上调,同时抑凋亡基因Bcl-2及Bcl-xl的mRNA和蛋白的表达水平出现了明显的下调。以上结果表明,Bcl-2家族途径和线粒体凋亡途径是盐霉素诱导胰腺癌细胞株PANC89凋亡的可能机制。
在实验过程中,发现Wnt/β-catenin通路中的几个关键蛋白,β-catenin、p-GSK-3β的表达水平明显降低,这说明对Wnt/β-catenin通路的抑制或许是盐霉素抑制胰腺癌细胞增殖的的机制之一。Wnt/βcatenin通路对于胚胎发育及调控细胞功能如细胞的增殖、凋亡、侵袭和迁移起着重要作用[15-17];其在胰腺的发育过程中起着重要[18-19],并且有研究表明,在多数胰腺癌中Wnt/β-catenin通路发生异常激活[20]。阻断Wnt/β-catenin通路可以抑制细胞的增殖和促进细胞凋亡的发生[21]。
综上所述,盐霉素可以抑制胰腺癌细胞株PANC89的增殖和促进增殖,增敏奥沙利铂的抗肿瘤作用,并且这一过程可能是通过抑制 Wnt/βcatenin通路而产生作用的,但具体作用机制还需要进一步的研究。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60:277-300.
[2] Li J,Wientjes MG,AuJL.Pancreaticcancer:pathobiology,treatment options,and drug delivery[J].AAPS J,2010,12:223-232.
[3] Miyazaki Y,Shibuya M,Sugawara H,et al.Salinomycin,a new polyether antibiotic[J].J Antibiot(Tokyo),1974,27:814-821.
[4] Kullmann F,Hollerbach S,Dollinger MM,et al.Cetuximab plus gemcitabine/oxaliplatin(GEMOXCET)in first-line metastatic pancreatic cancer:a multicentre phase II study[J].Br J Cancer,2009,100:1032-1036.
[5] Herrmann R,Bodoky G,Ruhstaller T,et al.Gemcitabine plus capecitabine compared with gemcitabine alone in advanced pancreatic cancer:a randomized,multicenter,phase III trial of the Swiss Group for Clinical Cancer Research and the Central European Cooperative Oncology Group[J].J Clin Oncol,2007,25:2212-2217.
[6] Gupta PB,Onder TT,Jiang G,et al.Identification of selective inhibitors of cancer stem cells by highthroughput screening[J].Cell,2009,138:645-659.
[7] Wang Y.Effects of salinomycin on cancer stem cell in human lung adenocarcinoma A549 cells[J].Med Chem,2011,7:106e11.
[8] Dong TT,Zhou HM,Wang LL,et al.Salinomycin selectively targets'CD133+'cell subpopulations and decreases malignant traits in colorectal cancer lines[J].Ann Surg Oncol,2011,18:1797-804.
[9] Kim KY,Yu SN,Lee SY,et al.Salinomycin-induced apoptosis of human prostate cancer cells due to accumulated reactive oxygen species and mitochondrial membrane depolarization[J].Biochem Biophys Res Commun,2011,413:80-86.
[10] Lu D,Choi MY,Yu J,et al.Salinomycin inhibits Wnt signaling and selectively induces apoptosis in chronic lymphocytic leukemia cells[J].Proc Natl Acad Sci USA,2011,108:13253-13257.
[11] Fuchs D,Daniel V,Sadeghi M,et al.Salinomycin overcomes ABC transporter-mediated multidrug and apoptosis resistance in human leukemia stem cell-like KG-1a cells[J].Biochem Biophys Res Commun,2010,394:1098e104.
[12] Sorenson CM.Bcl-2 family members and disease[J].Biochim Biophys Acta,2004,1644:169-177.
[13] Youle RJ,Strasser A.The BCL-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9:47-59.
[14] Wasiak S,Zunino R,McBride HM.Bax/Bak promote sumoylation of DRP1 and its stable association with mitochondria during apoptotic cell death[J].J Cell Biol 2007,177:439-450.
[15] 方霞,易祥华.Wnt/beta-catenin和EGFR信号通路在非小细胞肺癌发生发展中的作用[J].同济大学学报:医学版,2012,33(1):105-110.
[16] Xu J,Zhu X,Wu L,et al.Micro RNA-122 suppresses cell proliferation and induces cell apoptosis in hepatocellular carcinoma by directly targeting Wnt/beta-catenin pathway [J].Liver Int,2012,32:752e60.
[17] SongKS,Jing K,Kim JS,et al.Omega-3-polyunsaturated fatty acids suppress pancreatic cancer cell growth in vitro and in vivo via downregulation of Wnt/beta-catenin signaling[J].Pancreatology,2011,11:574e84.
[18] Nadauld LD,Sandoval IT,Chidester S,et al.Adenomatous polyposis coli control of retinoic acid biosynthesis is critical for zebrafish intestinal development and differentiation[J].J Biol Chem,2004,279:51581-51589.
[19] Wang QM,Zhang Y,Yang KM,et al.Wnt/betacatenin signaling pathway isactive in pancreatic development of rat embryo[J].World J Gastroenterol,2006,12:2615-2619.
[20] Zeng G,Germinaro M,Micsenyi A,et al.Aberrant Wnt/beta-catenin signalingin pancreatic adenocarcinoma[J].Neoplasia,2006,8:279-289.
[21] Cui J,Jiang W,Wang S,et al.Role of Wnt/betacatenin signaling in drug resistance of pancreatic cancer[J].Curr Pharm Des,2012,18:2464e71.
