大鼠诱导性多能干细胞向神经前体细胞诱导分化研究
2013-12-16曲泽澎吕立夏徐国彤
曲泽澎,管 圆,崔 璐,吕立夏,徐国彤,
(1.上海交通大学医学院/中国科学院上海生命科学研究院健康科学研究所,上海 200025;2.同济大学附属第十人民医院眼科/同济大学医学院眼科研究所,上海 200072;3.同济大学医学院再生医学系/干细胞研究中心,上海 200092)
视网膜退行性疾病严重威胁人们的健康和生活质量。使用流产胎儿组织等来源的供体细胞进行移植治疗可取得一定效果[1-2],但有限的供体细胞来源限制了其应用。多能干细胞具有分化为各种组织细胞的潜能,使无限地制备各种供体细胞成为可能[3]。尽管大鼠的生理和病理特征及药物反应性与人更为接近,更适合作为人类疾病研究的动物模型,但由于技术的限制,以往的干细胞治疗研究主要在小鼠进行。近年来,大鼠胚胎干细胞(embryonic stem cell,ESC)[4]和诱导性多能干细胞(induced Pluripotent Stem Cell,iPSC)[5]先后建系成功,为研究大鼠的细胞分化、基因敲除和细胞治疗等奠定了基础。本研究将探索大鼠iPS细胞向神经细胞定向诱导分化的方法,并为进一步研究分化机制和治疗作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞和动物 M13大鼠iPS细胞系:10周龄SD大鼠原代骨髓细胞来源的iPS细胞系,由(中科院上海生命科学研究院)肖磊研究员实验室建立[5],通过中科院干细胞库提供。
C57/BL-6J小鼠:购自上海斯莱克动物中心。
RCS大鼠:遗传性视网膜色素变性动物模型(由上海市第一人民医院吴星伟教授实验室提供)。
1.1.2 试剂及耗材 胰蛋白酶、TrypLE Express、细胞培养基和部分添加成分以及TRIzol(购自Gibco/Invitrogen公司);磷酸缓冲液 PBS、胎牛血清FBS及部分细胞培养添加成分(购自Hyclone公司);生长因子 EGF和 bFGF(购自 Peprotech公司);ReverTra-Ace mRNA反转录试剂盒(购自Toyobo公司);荧光封片剂Flurorescence Mounting Medium(为DAKO公司产品);反式维甲酸(RA)、牛血清白蛋白BSA、多聚甲醛PFA、细胞核染料DAPI等(均购自Sigma公司)。细胞培养皿、孔板及15 ml、50 ml刻度塑料离心管(购自BD/Corning公司)。
1.1.3 大鼠基因引物 本研究使用的引物均由上海生工公司合成,具体包括:
Oct4:CCCAGCGCCGTGAAGTTGGA/CACCTTTCCAAAGAGAACGCCCAGG;
Nanog:TCAGGCCCAGTTGTGTGCACTC/TGAGCCCTTCTGAGTCAGGCCG;
Sox2:ATCACAACAATCGCGGCGGC/CACGGCCTTGCGCGGAGATC;
Nestin:AAGTTCCAGCTGGCTGTGGAAGCC/CGTCCAGGTGTCTGCAACCGA;
GAPDH:TTCTTGTGCAGTGCCAGCCTCGT/TGGGTTTCCCGTTGATGACCAGC。
1.1.4 抗体 Anti-MAP2、Anti-NESTIN 和 Sox2抗体(购自Chemicon);Anti-GFAP(购自Abcam;Anti-BrdU)抗体(为Sigma产品);二抗Anti-rabbit Cy3和Anti-mouse Cy3(均购自Jackson Immuno Research)。
1.1.5 仪器 本研究使用的仪器包括:荧光显微镜(Nikon)、相差显微镜(Nikon)、CO2细胞培养箱(Heraus)、高速台式低温离心机(Eppendorf)、二级生物安全柜(ESCO)、实时荧光定量(Real-Time)PCR检测仪(Roche LightCycler480)、冰冻切片机(Leica)、激光共聚焦显微镜(Leica SP5)。
1.2 方法
1.2.1 滋养层细胞(小鼠胚胎成纤维细胞,MEF)制备 将怀孕13.5 d的C57BL/6J小鼠脱臼处死。无菌条件下取出胚胎并去掉其头、尾、内脏及四肢后,用无菌生理盐水冲洗。将组织块剪成1 mm大小的碎片,放入50 ml离心管中,加0.25%Trypsin-EDTA,37℃消化20~30 min,直到出现大量单细胞。加入MEF培养液终止消化,吹打制成单细胞悬液。300 g离心5 min,弃去含胰蛋白酶的上层液体,再用10 ml MEF培养液重悬细胞,并将细胞接种在75 cm2的培养瓶。晃动培养瓶以使细胞尽可能均匀地分散于整个培养瓶中。待细胞生长超过90%融合时,用0.25%Trypsin-EDTA消化后传代。传代3~4次后,待细胞生长至80%融合时,弃除旧的培养液,加入6 ml含丝裂霉素C(终浓度为10 μ/ml)的MEF培养液继续培养3~4个 h。处理完后,除去含丝裂霉素C的培养液,用PBS洗5~7遍,用0.25%Trypsin-EDTA 消化,制成单细胞悬液。细胞按照5×105/ml的密度均匀地接种在经0.1%明胶预处理1 h的培养皿中,然后置于37℃培养箱中待用。一般可放置一周。
MEF细胞培养液成分:DMEM(Hyclone);FBS(Hyclone)10%;Penicilin/Streptomycin(P/S)(Gibco)1%。
1.2.2 大鼠iPS细胞培养 大鼠iPS细胞传代使用60mm细胞培养皿进行,每48h传一次。TrypLE Express消化后,iPS细胞连同MEF吹打成单细胞,以1×104个细胞/皿的密度传至处理后的滋养层细胞上。大鼠iPS细胞培养液的成分包括:Knockout DMEM、10%FBS、10%KSR、1%NEAA、1%L-glutamine、0.1mM β-Mercaptoethanol。除FBS为Hyclone产品外,其余为Gibco产品。
1.2.3 RA诱导分化 大鼠iPS细胞扩增2 d后用TrypLE Express消化并去除滋养层细胞,以1×104个细胞/皿的密度悬浮培养于无粘附性细菌培养皿,以大鼠iPS细胞培养液培养,隔天换液。悬浮类胚体(embryoid body,EB)3 d后,加全反式维甲酸(retinoic acid,RA),浓度为 5 μmol。继续培养 4 d后用胰酶消化,传代到PDL-Laminin-Firbronectin包被的贴壁培养皿,先以N2培养基培养2 d,消化并吹打成单细胞,重新传至不贴壁培养皿,用N2培养基加10 ng/ml bFGF和10 ng/ml EGF悬浮培养。4 d后胰酶消化成单细胞后重铺至 PDL-Laminin-Fibronectin包被的细胞培养皿,用N2B27培养基加10 ng/ml bFGF和10 ng/ml EGF贴壁培养,每2~3 d单细胞传代一次。取传代3次后的细胞进行相关免疫荧光染色和qPCR鉴定。
N2培养基成分:DMEM/F12(1∶1)(Gibco);N2 supplement(Gibco)1%;L-glutamine(Gibco)1%;NEAA(Gibco)1%;P/S(Gibco)1%。
B27培养基成分:Neurobasal medium(Gibco);B27 supplement(Gibco)2%;L-glutamine(Gibco)1%;NEAA(Gibco)1%;P/S(Gibco)1%。
N2B27培养基成分:N2培养基与B27培养基1∶1 混合。
1.2.4 细胞免疫荧光检测 将细胞传代于铺有玻片的培养皿。细胞贴壁后,取出玻片,用PBS洗后以4%多聚甲醛/PBS室温固定15 min;PBS洗三遍,每次5 min,0.25% TritonX-100/PBS 于室温15 min透膜,用 PBS洗去透膜液,洗三遍,每次5 min。10%山羊血清/PBS室温封闭30 min。用封闭液稀释一抗至适当浓度,去除封闭液加一抗,4℃过夜。用PBS洗去一抗,三次,每次5 min。加上荧光二抗,室温反应1 h,用PBS洗去二抗,三次,每次5 min。以300 mmol DAPI处理5 min标记细胞核后,用封片剂封片,以荧光显微镜下观察并照相,或置于4℃暗室中保存。
1.2.5 实时定量 PCR检测 细胞用 TRIZOL裂解,按 TRIZOL操作说明书抽提样品细胞的总RNA。紫外分光光度计定量后,取2 μg总RNA;用oligo(dT)15为第一链引物,以ReverTra-Ace反转录酶逆转录得到cDNA;获得的cDNA 1∶10稀释。Realtime RT-PCR 的反应总体系为 10 μl,含 5 μl Toyobo SYBR ® GREEN PCR MasterMix、0.8 μl的10 μmol引物和 4 μl稀释后的 cDNA。反应程序为:95℃首轮变性1 min(Stage 1);95℃变性15 s,60℃退火和延伸45 s(Stage 2),40个循环后;95℃15 s,60 ℃15 s(Stage 3,Dissociation Stage)。为排除样品上样量差异造成的影响,每个基因的Ct值都用看家基因GAPDH的Ct值进行校正。
1.2.6 BrdU侵入实验 细胞按照5×105个细胞/60 mm培养皿的密度接种于玻片上,经过24 h培养后换含终浓度为10 μmol BrdU的培养基继续培养过夜。用70%的酒精在-20℃固定细胞20 min,晾干。用2 N的盐酸室温处理细胞15 min变性DNA,用PBS清洗5 min。以0.1 M 四硼酸钠(Na2B4O7)重悬细胞,室温孵育5 min后,PBS清洗3次,每次5 min。用10%的正常山羊血清室温封闭30 min。加入1∶10稀释的anti-BrdU抗体,室温孵育2 h。用PBS清洗3次后,加入1∶100稀释的anti-Rat抗体,室温孵育1 h。用PBS清洗3次后,用DAPI复染细胞核。PBS再次清洗后用荧光封片剂封片,置于荧光显微镜下观察或4℃保存。
1.2.7 动物模型的建立 本研究使用RCS大鼠,饲养条件遵照视觉与眼科学研究协会(Association for Research in Vision and Ophthalmology,ARVO)关于眼科和视觉研究饲养和使用动物的标准以及健康科学研究所的动物饲养和使用规定。动物饲养于50流明、12:12光照循环的动物房内,给予适量食物和饮水。
1.2.8 细胞移植 细胞准备:单层培养扩增2~3代的大鼠iPS细胞分化获得的神经前体细胞(neural progenitor cell,NPC)用 TrypLE Express消化成单细胞,经70 μm 孔径细胞滤器(cell strainer,BD)过滤去除细胞团和杂质,计数后离心收集,以5×105cells/μl重悬于 PBS。
细胞移植:生后25 dRCS大鼠,麻醉后置于体式显微镜下,并在大鼠眼球上放置凹透镜;用胰岛素针头在角巩膜缘后2 mm处刺一个针孔,然后用33 gauge的微量注射器从这个针孔处进针至视网膜下腔,移植入2 μl 1×106细胞的悬液。
1.2.9 冰冻切片免疫荧光染色分析 将细胞移植后1个月的RCS大鼠脱臼处死,立即取出眼球置于4%多聚甲醛中固定,4℃放置1 h。用组织包埋剂OCT于4℃平衡1 h后,液氮中包埋并保存于-80℃。用冰冻切片机连续切10 μm厚的组织片,贴在APES处理过的载玻片上。室温电风扇吹4 h后,用PBS洗去OCT后,加上0.25%Triton X-100室温透膜10 min。用PBS洗去透膜液三次,每次5 min。10%山羊血清/PBS室温封闭30 min。用封闭液稀释一抗至适当浓度,去除封闭液加一抗,4℃过夜。用PBS洗去一抗三次,每次5 min。加荧光二抗,室温反应1 h,用 PBS洗去二抗三次,每次5 min。以300 mmol DAPI处理5 min标记细胞核后,用封片剂封片,以荧光显微镜下观察并照相或置于4℃暗室中保存。
2 结 果
2.1 大鼠iPS细胞培养与诱导分化
大鼠iPS细胞在滋养层细胞上正常传代培养,呈克隆样生长(图1A)。经沉降和粘附性差异去除绝大部分的饲养层细胞后进行EB培养。经RA诱导继续悬浮培养4 d,可获得表面较为紧密、内部略微发暗的EBs(图1B)。EBs经无血清N2培养基培养1~2 d后,可观察到外周有具有中/内胚层形态特点的细胞迁移出球体(图1C)。继续用N2培养基加10 ng/ml bFGF和10 ng/ml EGF悬浮培养,可见类似神经球形态的悬浮细胞团及少量死细胞。洗去死细胞及碎片后可观察到神经球球体由于细胞扩增而变大(图1D)。再经N2B27培养基加10 ng/ml bFGF和10 ng/ml EGF贴壁培养,获得的则是形态比较均一的NPC(图1E)。上述诱导分化获得的NPC可以长期传代培养,贴壁培养一周能够形成rosette样结构(图1F)。

图1 大鼠iPS细胞培养与诱导分化(标尺:50 μm)Fig.1 Cultured and differentiated iPS cells of rat(bar:50 μm)
2.2 诱导分化的NPC的基因表达检测
通过实时定量PCR方法检测了传代3次以上的NPC的神经分化相关基因的表达。结果表明,大鼠iPS细胞全能性转录因子Oct4和Nanog在NPC中表达均下调,而NPC标记物Sox2和Nestin的表达均显著上调(图2A)。免疫荧光检测的结果也显示NPC标志物Sox2和Nestin在分化的细胞几乎普遍表达,而神经元的标志物(MAP2)以及胶质细胞前体标志物(GFAP)表达则很低(图 2B)。
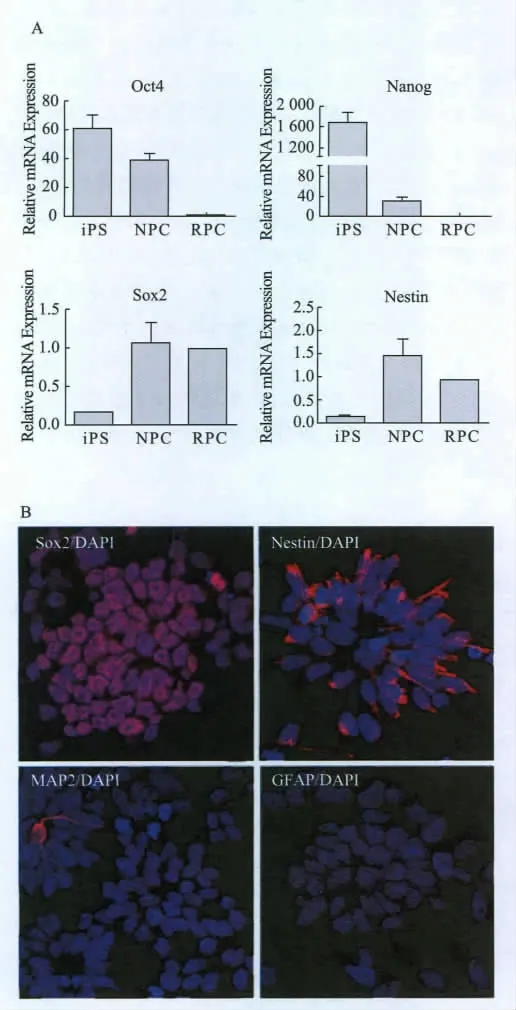
图2 大鼠iPS细胞分化得到细胞基因表达和免疫荧光染色的结果Fig.2 Gene expression and immunostaining results of NPC derived from rat iPS cells
2.3 NPC的增殖和分化能力检测
为检测分化得到NPC的增殖能力,用这些NPC进行了BrdU摄入实验。结果显示,绝大多数细胞都呈现BrdU阳性(图3),表明获得的细胞保持较强的增殖能力。

图3 分化得到NPC的BrdU免疫荧光染色结果(标尺:25 μm)Fig.3 BrdU staining of rat iPS cells derived NPC(bar:25 μm)
由于起始用于分化的大鼠iPS细胞带有持续表达的GFP标记,分化后的NPC仍然能够显示绿色荧光。将这些NPC移植到RCS大鼠视网膜下腔,并在一个月后观察其存活、分化和迁移能力。结果显示,NPC能够在视网膜下腔存活良好,与DAPI共染色表明移植的细胞能够迁移到视网膜内部,与神经元标志物MAP2及胶质细胞前体标志物GFAP的共染(图4)说明大鼠iPS细胞来源的NPC能够在体内进一步分化为神经元和神经胶质细胞。
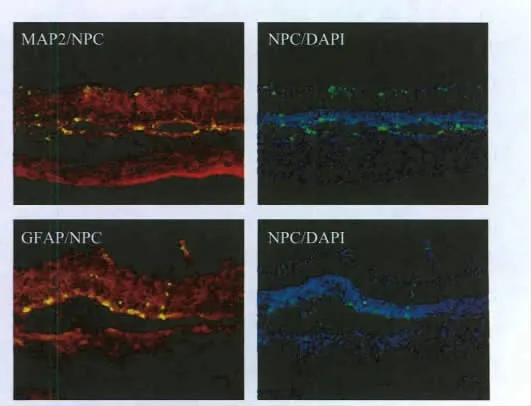
图4 带有GFP标记的NPC在视网膜下腔的分化和迁移(标尺:50 μm)Fig.4 Differentiation and migration of NPC after subretinal injection(bar:50 μm)
3 讨 论
视网膜的退行性疾病,如年龄相关性黄斑变性、视网膜色素变性等,病理改变都包括有神经细胞缺失和功能障碍。在神经系统退行性疾病,虽然神经损伤后能观察到少量的新生神经细胞,但由于疾病使NPC的微环境受到破坏,依靠内源神经干细胞修复神经组织的结构与功能的可能性较小。虽然使用流产胎儿组织、遗体捐献者组织等来源的供体细胞进行移植治疗可取得一定效果[1-2],但供体细胞来源的限制使相应的治疗研究无法开展。多能干细胞(ESC和iPSC)所具有的能分化为各种组织细胞的特性,为细胞替代治疗提供了近乎无限的细胞来源,其体外定向诱导分化和移植有望成为神经退行性疾病治疗的新途径[6]。由于干细胞移植后可能的成瘤性,ESC或iPSC通常要经诱导分化为不同阶段的神经细胞再用于治疗。其中,分化获得NPC进行治疗是最受关注的努力之一。NPC是一种具有持续分裂增殖能力,呈Nestin反应阳性而缺乏成熟细胞标记物并可以分化为神经元、星形胶质细胞和少突胶质细胞的神经祖细胞。在特定的微环境之中,NPC能对细胞因子、生长因子或趋化因子等外界信号做出反应,进行对称或不对称细胞分裂,从而在神经遭受损伤时进行一定的自我修复。
与ES细胞相比,iPS细胞具有类似的分化潜能,同时又具有ES细胞所不具备的自身优势,包括:iPS细胞可以是自体来源,可以建立与患者遗传背景非常接近的供体细胞,从而提供有针对性的个性化治疗。另外,iPS细胞的研究和应用也绕过了ES细胞研究所遇到的伦理障碍。因此,iPS细胞可能有更大的临床应用潜力。
目前,干细胞治疗大多在小鼠模型进行,在大鼠的研究工作还仅仅在起步阶段。这主要是干细胞技术在小鼠开展比较早而且比较成熟,而大鼠干细胞研究移植受到技术的困扰。但与小鼠相比,大鼠的遗传背景、生理调节、病理反应与人类更为接近[7],更适合作为人类疾病研究的动物模型。实验中所采用的RCS大鼠是经典的遗传性视网膜变性模型,最近几年被广泛应用于细胞移植治疗方面的研究[8-10]。相比SD大鼠药物诱导的视网膜变性模型(如碘酸钠诱导),RCS大鼠模型具有重复性高稳定性好等优点。大鼠ES细胞和iPS细胞建系的研究直到近年才取得突破性进展[4-5],甚至通过ES细胞同源重组技术获得了大鼠基因敲除动物模型[11]。体外诱导分化模型的建立也是ES/iPS细胞应用的重要方面,目前已有报道将大鼠ES细胞诱导分化为心肌细胞[12]和颗粒细胞,而在其向NPC分化方面,尚鲜有报道。本研究中,参考小鼠ES细胞的分化策略,首次将大鼠iPS细胞的定向诱导分化为NPC。这些分化获得的细胞能够表达NPC标志物Sox2和Nestin,具有较强的增殖能力。将大鼠iPS细胞分化得到的NPC移植到RCS大鼠视网膜下腔,发现这些细胞能够在疾病大鼠的视网膜下腔存活、迁移并且在体内进一步分化为神经元和胶质细胞。这一分化模型的建立对于更深入了解大鼠iPS/ES细胞及其研究和应用具有重要的参考价值。
本研究探讨了大鼠iPS细胞向NPC分化的方法以及这些NPC在大鼠视网膜下腔移植后的命运,初步证明这一诱导分化方法的可行性和潜力。进一步,尚需深入研究移植细胞的功能和安全性,以保证NPC移植的安全与有效。在本实验中诱导分化获得的NPC中尚有较高的全能性转录因子Oct4的表达(图2A)。其原因可能是外源基因的干扰,但其作为移植治疗的供体细胞,全能性因子意味着有成瘤性的可能。NPC的分化策略需要进一步优化和完善。
[1] Radtke ND.Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium[J].Am J Ophthalmol,2008,146(2):172-182.
[2] Jin ZB.Induced pluripotent stem cells for retinal degenerative diseases:a new perspective on the challenges[J].J Genet,2009,88(4):417-24.
[3] Lindvall O.Clinical translation of stem cells in neurodegenerative disorders[J].Cell Stem Cell,2012,10(2):151-155.
[4] Li P.Germline competent embryonic stem cells derived from rat blastocyst [J].Cell,2008,135(7):1299-1310.
[5] Liao J.Generation of induced pluripotent stem cell lines from adult rat cells[J].Cell Stem Cell,2009,4(1):11-15.
[6] 李睿,崔红平.干细胞移植治疗眼科疾病的研究进展[J].同济大学学报:医学版,2011,32(3):105-110.
[7] Aitman TJ.Progress and prospects in rat genetics:a community view [J].Nature Genetics,2008,40(5):516-522.
[8] Hu Y.A novel approach for subretinal implantation of ultrathin substrates containing stem cell-derived retinal pigment epithelium monolayer[J].Ophthalmic Res,2012,48(4):186-191.
[9] Huo SJ.Transplanted olfactory ensheathing cells reduce retinal degeneration in Royal College of Surgeons rats[J].Curr Eye Res,2012,37(8):749-758.
[10] McGill,TJ.Transplantation of human central nervous system stem cells-neuroprotection in retinal degeneration.Eur J Neurosci,2012.35(3):468-477.
[11] Tong C.Production of p53 gene knockout rats by homologous recombination in embryonic stem cells[J].Nature,2010,467(7312):211-213.
[12] Cao N.In vitro differentiation of rat embryonic stem cells into functional cardiomyocytes[J].Cell Res,2011,21(9):1316-1331.
