土霉素对堆肥过程中酶活性和微生物群落代谢的影响
2013-12-09陈智学王小娟
陈智学,谷 洁,高 华,王小娟,陈 琳,胡 婷
(1. 西北农林科技大学理学院, 杨凌 712100; 2. 西北农林科技大学资源与环境学院, 杨凌 712100)
土霉素对堆肥过程中酶活性和微生物群落代谢的影响
陈智学1,谷 洁2,*,高 华2,王小娟2,陈 琳1,胡 婷2
(1. 西北农林科技大学理学院, 杨凌 712100; 2. 西北农林科技大学资源与环境学院, 杨凌 712100)
以猪粪和秸秆为试验材料,研究了土霉素对堆肥温度、种子发芽指数、C/N、纤维素酶、脲酶、过氧化氢酶以及微生物群落代谢的影响。结果表明, 0 mg/kg (对照处理)的堆肥在第2天上升到 50 ℃以上, 维持了 5 d,达到了无害化处理的要求。35 mg/kg土霉素处理(A1 处理)第4天升到 51.0 ℃,其高温期维持了 1 d。70 mg/kg 土霉素处理(A2 处理)第3天升到 50 ℃以上,高温期维持了 2 d。105 mg/kg 土霉素处理(A3 处理)和 140 mg/kg 土霉素处理(A4 处理)的温度在整个堆肥期间均未达到 50 ℃。在堆肥结束时各个处理的种子发芽指数均达到 80% 以上。CK(对照处理)、A1、A2、A3 和 A4 处理的 C/N 由 34.50 分别降为 16.64、16.07、19.48、18.45 和 19.83。堆肥的第1天,A1、A2、A3 和 A4 处理对纤维素酶活性的抑制率分别为 60.30%、21.30%、48.81% 和 76.05%,第3天,土霉素对纤维素酶活性起促进作用,在 4—30 d,A3、A4 处理对纤维素酶活性有抑制作用。在堆肥的前期(1—3 d),土霉素刺激脲酶活性,随着堆肥时间的延长,土霉素对脲酶活性由刺激变为抑制作用,在第18—30天 A3、A4 处理与 CK 相比有着显著的抑制作用。在堆肥第1天到第18天,土霉素基本上促进过氧化氢酶的活性,堆肥 18 d 之后土霉素对过氧化氢酶起着是抑制作用。用 Biolog (ECO Microplate)方法研究了土霉素对堆肥过程中微生物群落代谢的影响,结果表明,在升温期 CK 处理的平均颜色变化率AWCD (Average Well Color Development)在培养 60 h 之后大于其他处理,高温期 A2 处理的 AWCD 值最高,在降温期 CK 的 AWCD 值一直是最高的。对 Shannon 指数进行分析显示,堆肥的初始阶段土霉素降低微生物群落的功能多样性,随着时间的延长,土霉素增加微生物群落的功能多样性。对微生物利用六大类碳源分析表明, 140 mg/kg 的土霉素浓度能够改变微生物利用碳源的种类。
土霉素;堆肥;酶活性;微生物群落
随着集约化程度的提高和生产规模的扩大,我国养殖业产生的畜禽粪便己经对自然环境造成了严重的污染,成为制约集约化养殖业发展的主要问题之一[1]。抗生素具有促生长和杀菌作用,被很多国家广泛用于畜牧业,导致大量未被吸收的抗生素在畜禽粪便中残留[2- 4]。堆肥作为一种集粪便处理和资源再生利用于一体的生物处理方法,有生产成本低、生产过程不对环境造成二次污染、产品肥效较长、改良土壤等优点,在国内外受到了广泛的关注。
堆肥过程中的物质转化主要是在酶参与下进行的酶促反应,包括有机物的分解与合成,有机物的分解过程是水解酶类起催化作用的生物化学反应[5];土壤中合成新的稳定的有机化合物的过程是氧化还原酶起催化作用的生物化学反应[6]。目前,人们对畜禽粪便堆腐的研究,主要集中在堆腐条件的控制和一些重金属对堆腐过程的影响[7- 10],没有对堆腐过程中抗生素对酶活性及微生物群落多样性变化进行研究。我国已有 17 种抗生素、抗氧化剂、激素类药物用于饲喂畜禽,其中四环素类最多。四环素类抗生素主要有 3 种,即土霉素(Oxytetracycline, OTC)、四环素(Teracycline, TC)和金霉素(Chloroteracyline, CTC),约占抗生素总量的 57%[11]。张树清的研究结果表明,32 个猪粪样品中,土霉素、四环素、金霉素平均含量分别为 9.09、5.22、3.57 mg/kg[12],其中土霉素的含量在1.05—134.75 mg/kg。本试验通过露天堆肥的方式研究土霉素对堆肥过程中微生物群落功能多样性和酶活性的影响,旨在揭示土霉素在堆肥过程中的微生态效应。
1 材料与方法
1.1 供试材料
试验用的土霉素购自Sigma 公司,纯度为98%。以农家养殖厂猪粪、秸秆为堆肥材料,原材料的基本性质见表1。
1.2 试验设计
堆肥试验于 2011 年 11 月 3 日至 2011 年 12 月 4 日在西北农林科技大学资环学院堆腐试验场进行,堆肥为露天堆肥。把长约 3—5 cm 的小麦秸秆与猪粪混合,每个堆体添加猪粪 80 kg,秸秆 43 kg,使每个堆体的 C/N(碳氮比)为 34.50,加水调节含水率至 65%[13],最后形成直径约 1.5 m,高约 1m 的圆锥形堆体。实验设 5 个处理,根据张树清对 7 个省、市、自治区的规模化养殖场猪粪中土霉素的含量的测定结果(土霉素的含量在1.05—134.75 mg/kg)[12],分别添加土霉素的量(占猪粪干重的比例)如下:0 mg/kg (对照处理CK)、35 mg/kg (A1)、70 mg/kg(A2)、105 mg/kg (A3)、140 mg/kg (A4)。分别于第1、3、5、8、11、18 和 30天在堆体多点采集样品,混匀,4 ℃冰箱冷藏, 用于堆料酶活性和微生物群落代谢的测定。
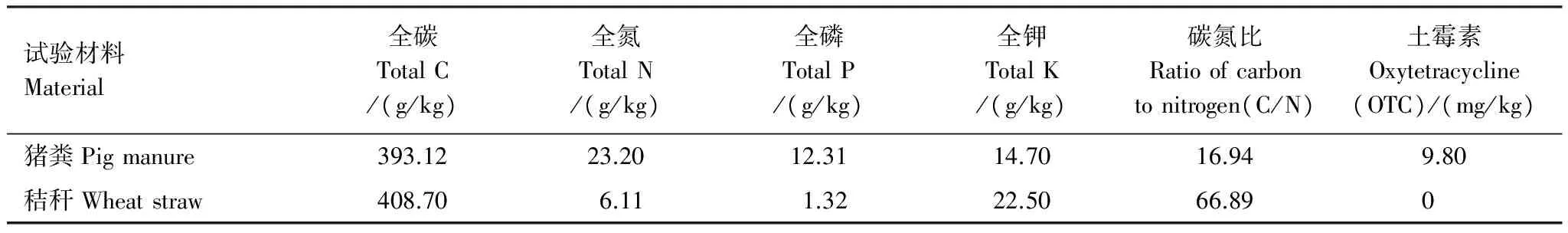
表1 堆肥所用原材料的基本性质(烘干样)
1.3 项目测定与方法
1.3.1 堆肥过程中温度的测定
每天10:00、17:00 测定堆肥温度,每个堆体插入 3 个温度计,以上、下午两次温度的平均值作为当天堆体的温度。
1.3.2 种子发芽指数的测定。
样品与蒸馏水按1 ∶10 比例充分混合,取10 mL 滤液以3 000 r/min 离心10 min,吸取5 mL上清液于铺有滤纸的培养皿中,放置10粒上海青种子,用蒸馏水作为对照,25 ℃黑暗条件下培养5 d,计算种子的发芽率,并用游标卡尺测量种子的根长。根据下列公式,计算种子的发芽指数(GI):

1.3.3 堆肥过程中酶活性的测定
酶活性测定参照关松荫的方法[14]。测定葡萄糖生成量以表征纤维素酶活性,单位为 mg葡萄糖·g-1·d-1表示。测定氨的生成量以表征脲酶活性,单位用 mg NH3-N·g-1·d-1表示。测定高锰酸钾的消耗量以表征过氧化氢酶活性,单位用0.001mol/L KMnO4·g-1·20min-1) 表示。
1.3.4 堆肥不同时期微生物群落功能多样性测定
本试验微生物群落功能多样性采用 Biolog 生态测试板测定。具体操作步骤如下:分别从第1天(升温期)、第5天(高温期)、第11天(降温期)的各个处理堆肥中部多点取样,混合后取 5 g 堆肥样品(干重计算),加入装有 45 mL 无菌生理盐水的三角瓶中,160 r/min振荡1 h,静置片刻后取上清液,将其用 0.85% 氯化钠无菌生理盐水稀释至 10-3倍。在超净工作台上,接种微生物悬浮液于 ECO 微平板中,每孔 150 μL。将接种的 ECO 板装入聚乙烯盒中置于 28℃ 暗箱中培养,连续培养 240 h,每 12 h 在 ELISA(Enzyme-linked Immun-osorbent Assay,酶联免疫吸附测定)微平板读数器上读数一次以采集数据[15]。
1.4 数据处理
平均每孔颜色变化率(AWCD)的计算公式为:AWCD=∑(Ci-R)/31,式中,Ci为各反应孔在590 nm下的光密度值;R为ECO板对照孔A1的光密度值;Ci-R小于零的孔,计算中记为零,即:Ci-R≥ 0。选取96 h的ECO板的读数结果,对其进行微生物群落多样性分析,微生物群落 Shannon 指数(H):H=-∑Pi×lnPi,式中Pi=(Ci-R)/∑(Ci-R),表示有碳源的孔与对照孔 A1 的光密度值之差与整板总差的比值。
数据的统计分析采用 Excel(V 2003)、SPSS(16.0)软件完成。
2 结果与分析
2.1 堆肥过程中温度的变化
温度的高低是决定堆肥成败的关键[16],根据《农业废弃物无害化处理标准》规定:在 50—55 ℃ 以上持续 5—7 d(或 55 ℃条件下保持 3 d 以上)可杀灭病原微生物,实现无害化。由表 2 可见,CK 处理堆肥在第2天上升到 50.7 ℃,第4天到达最高温度 52.7 ℃,高温期维持了5 d,达到了无害化处理的要求。A1 处理第4天升到 51.0 ℃且仅维持了1d。A2 处理第3天升到 50 ℃以上,最高温度 52.0 ℃出现在第4天,高温仅维持2d。A3 处理的温度在整个堆肥期间均未达到 50 ℃,最高温度 47.2 ℃ 出现在第4天。A4 处理的温度没有一天达到 50 ℃。第5天之后,各个处理的温度差异不大,这可能由于在前期土霉素杀死某些微生物,呈现出抑制效应[17],随着时间的延续,环境会产生抗性种群[18],增加堆料中微生物的代谢活性,导致温度恢复到正常水平。

表2 堆肥过程中温度的变化
数值为平均值±标准差(mean±SD),n=6;同一列数据中不同字母表示处理间差异显著(Plt;0.05);-: 未能达到标准
2.2 堆肥腐熟指标
种子发芽指数(GI)被认为是最敏感、最可靠的堆肥腐熟度评价指标。一般认为,当GI大于 80%时,就可以判断堆肥腐熟[19]。由表 3 可见,在堆肥结束时,A3和A4 处理的种子发芽指数分别是 78.48% 和70.68%,表明土霉素的浓度过高会对堆肥的品质造成较大的影响。CK 的 pH值最高,为8.78,A4 处理的 pH 值最低,为 8.56。 CK、A1、A2、A3和A4 处理的 C/N 由初始的 34.50 分别降为 16.64、16.07、19.48、18.45和19.83,说明经过堆肥化处理后,使得C/N 下降。

表3 堆肥腐熟指标
数值为平均值±标准差(mean±SD),n=3;同一列数据中不同字母表示处理间差异显著(Plt;0.05)
2.3 堆肥期间不同土霉素浓度对酶活性的影响
堆肥过程中物质转化是在酶参与下进行的酶促反应过程[20]。土霉素通过影响环境中微生物的种类与数量,进而对酶的分泌造成影响。
2.3.1 堆肥过程纤维素酶活性的变化
纤维素酶参与碳的循环[21]。从表 4 看出,纤维素酶活性随时间呈双峰曲线,在第1天,添加土霉素处理纤维素酶活性显著低于 CK(Plt;0.05),A1、A2、A3 和 A4 处理对纤维素酶活性的抑制率分别为 60.30%、21.30%、48.81% 和 76.05%。随着时间的延续,纤维素酶活性迅速增加,导致 A1 处理与 CK 的纤维素酶活性在第3天和第5天差异不显著。可能的原因是初期低浓度的土霉素对微生物分泌纤维素酶的活性有抑制作用,之后由于土霉素不断的降解[22],导致对纤维素酶的影响不大。对于 A2 和 A3 处理而言,土霉素对纤维素酶活性的影响比较复杂,可能由于随着堆肥时间的延长,土霉素抑制微生物的活性与作为营养物质刺激一些抗性微生物的活性共同作用[18]。A4 处理的纤维素酶活性在第3天之后处于一个低的水平,可见经过前期土霉素的毒性作用,140 mg/kg 土霉素处理对能够分泌纤维素酶的微生物有着抑制作用。
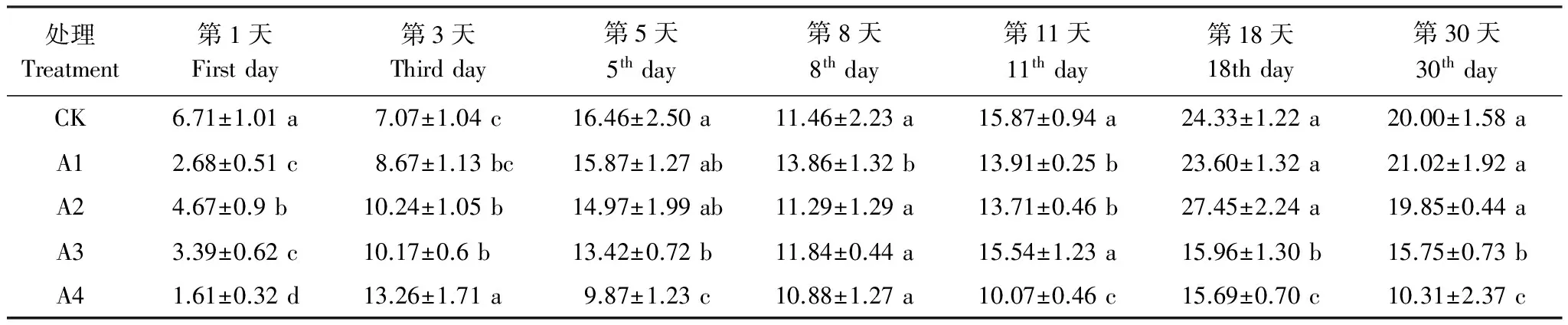
表4 堆肥过程中纤维素酶活性变化/(mg葡萄糖·g-1·d-1)
数值为平均值±标准差(mean±SD),n=3;同一列数据中不同字母表示处理间差异显著(Plt;0.05)
2.3.2 堆肥过程脲酶活性的变化
脲酶与氮代谢密切相关[23]。由表 5 可见,脲酶活性随时间也呈双峰曲线变化,但 A3 和A4 处理变化不明显。原因可能是堆肥初期原料中有机质含量高、营养丰富,促进了耗氧微生物生长和酶的合成,使酶活逐渐增至最大值[24]。由于高温的持续作用,微生物的数量和活性受到抑制,酶活性下降。谷洁研究发现在一定的温度期间堆料中脲酶活性变化与温度变化具有负相关关系[25],随着温度的下降,堆料里的微生物种群又开始活跃起来,在堆肥的第18天又达到一个高峰。经过有机物质的快速降解阶段(0—25 d)[26], 能量不足造成酶活性逐渐降低。
从表中还可以看出,在 1—3 d 添加土霉素处理脲酶活性比 CK 高,这与姚志鹏结果一致[27]。尽管土霉素对一些具有分泌脲酶功能的微生物有毒害作用,但即使这样,由于土霉素具有酰胺键结构,而脲酶以酰胺键作为底物,根据底物诱导原理,导致在堆肥前期土霉素对脲酶活性的正效应大于负效应。在堆肥的第5天,所有处理脲酶活性均达到最高值,处理之间差异不显著。随着时间的再延续,高浓度和极高浓度的土霉素对脲酶活性的抑制效应越来越明显,从第18天和第30天数据来看,A3 和 A4 处理脲酶活性与 CK 相比已下降至显著水平。而低浓度和中浓度土霉素未对堆料中脲酶活性产生显著的影响(Pgt;0.05)。这是由于堆肥后期,超过一定浓度的土霉素的积累毒害作用,导致微生物的密度降低,进而分泌脲酶的微生物比 CK 要少。

表5 堆肥过程中脲酶活性变化/(mg NH3-N·g-1·d-1)
数值为平均值±标准差(mean±SD),n=3; 同一列数据中不同字母表示处理间差异显著(Plt;0.05)
2.3.3 堆肥过程过氧化氢酶活性的变化
过氧化氢酶的活性与有机质的含量有关,与微生物数量也有关[13]。由表 6 可见,在第1天土霉素对过氧化氢酶活性有激活作用,A1、A2、A3 处理与 CK 差异显著(Plt;0.05),原因可能是一些微生物针对一定浓度的土霉素毒害作用的胁迫,需要分泌更多的过氧化氢酶[28],极高浓度土霉素的杀菌作用对过氧化氢酶活性产生的负效应与土霉素的胁迫产生的正效应相互作用造成 A4 处理与 CK 差异不显著。随着堆肥时间的延续,土霉素基本上是激活过氧化氢酶。在堆肥后期 CK 过氧化氢酶活性为 75.00 mL 0.001mol/L KMnO4·g-1·20min-1,显著高于其它处理(Plt;0.05),是由于堆料中的微生物对药物适应能力增强,土霉素的毒害作用减弱,同时土霉素的降解作用[22],导致分泌的过氧化氢酶减少[28]。
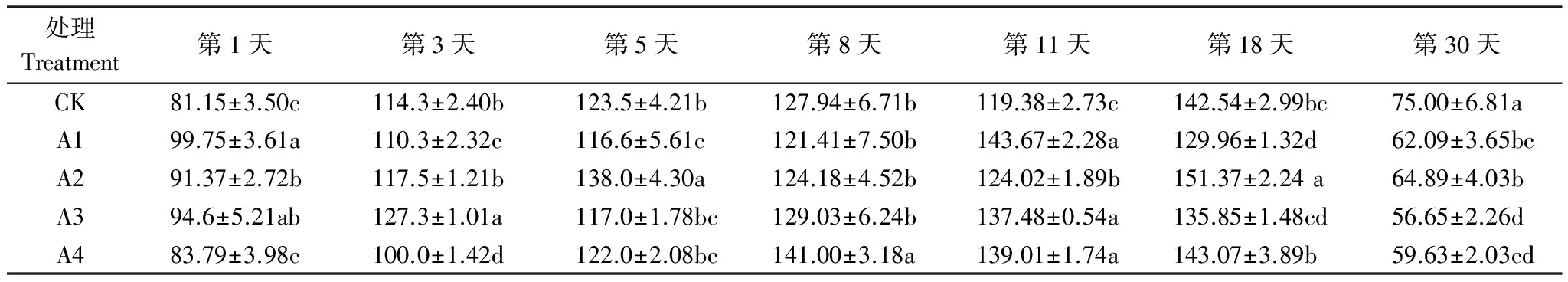
表6 堆肥过程中过氧化氢酶的变化/(mL 0.001mol/L KMnO4·g-1·20min-1)
数值为平均值±标准差(mean±SD),n=3; 同一列数据中不同字母表示处理间差异显著(Plt;0.05)
2.4 堆肥期间土霉素对微生物群落功能多样性的影响
2.4.1 ELISA 平均颜色变化率(AWCD)
AWCD 反映微生物对碳源的利用率,AWCD 值越大,表明堆料中微生物的活性越高,密度越大[29]。由图 1 可见,在升温期,CK 的 AWCD 值在培养 60 h后大于其他处理,表明升温期土霉素能够降低微生物活性。
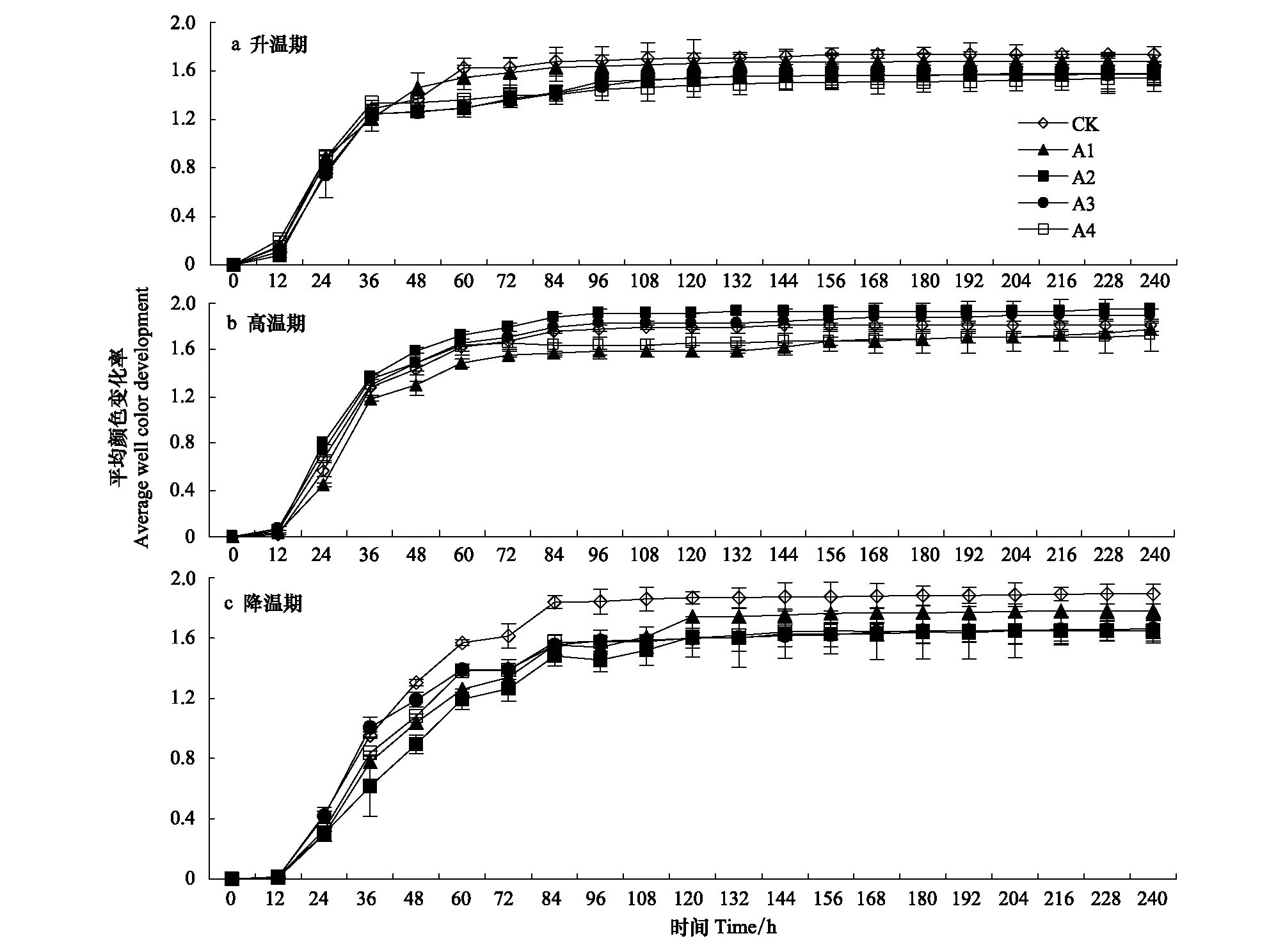
图1 不同时期不同处理平均颜色变化率AWCD随培养时间的变化Fig.1 AWCD changes with incubation time in different treatments during different periods
在高温期,A2 处理的 AWCD 值在整个培养过程高于其它的处理,可能是随着时间的增加,环境会产生抗性种群[18],对 AWCD 值产生正的效应,同时土霉素的毒害作用对 AWCD 值产生负的效应[17],两者相互作用使得在土霉素浓度占猪粪的比例为 70 mg/kg 时堆料的微生物活性最高。在降温期,CK 的 AWCD 值始终是最高的,在 AWCD 值趋于稳定之后(108 h 之后),土霉素的浓度越高,AWCD 值越低,表明在堆肥的后期,抗性微生物的大量死亡,造成微生物的密度较低。
2.4.2 微生物群落多样性指数分析
Shannon 多样性指数表示在颜色变化率一致的情况下,整个堆料微生物群落利用碳源类型的多与少,即功能多样性[30],Shannon 多样性指数越大,表明该堆料微生物系统的功能多样性越高。本试验采用 Biolog 微平板培养 96 h 的数据来进行微生物群落功能多样性分析。
在表 7 中,在升温期 CK 的 Shannon 指数最高,和 A2、A3 和 A4 处理差异显著(Plt;0.05);在高温期 A2 处理的 Shannon 指数最高,各个处理间的 Shannon 指数差异不显著(Pgt;0.05);在降温期 A4 处理的 Shannon 指数最高,CK 的 Shannon 指数是最低的,A4 与 CK 之间的差异显著(Plt;0.05)。可见在堆肥的初始阶段,堆料中土霉素含量为高浓度或极高浓度时能够显著降低微生物群落的功能多样性。随着时间的延长,土霉素能够增加堆肥中微生物群落的功能多样性。原因可能是在堆肥前期,土霉素能够杀死一些微生物,微生物群落功能多样性降低。随着堆肥时间的延长抗性微生物大量出现,堆料中的微生物群落的功能多样性增高。

表7 不同土霉素处理堆料微生物群落功能多样性指数
数值为平均值±标准差(mean±SD),n=3; 同一行数据中不同字母表示处理间差异显著(Plt;0.05)
2.4.3 堆肥微生物对六大类碳源的利用
堆料中微生物对不同碳源的利用情况反映了土壤微生物的代谢功能类群。从表 8 可以看出,在堆肥的3个期间,微生物对糖类、氨基酸类、羧酸类有着比较高的利用率,是因为这 3 类碳源是微生物代谢的基本物质,能够被大部分的微生物所利用。在升温期,A2、A3 和 A4 处理中的微生物对六大类碳源的利用与 CK 相比差异显著(Plt;0.05),表明在升温期添加的土霉素浓度超过 35 mg/kg 以上时,堆料中微生物无论是基础代谢还是次生代谢都受到了显著的抑制。在高温期,A4 处理中的微生物对糖类的利用相比于其他处理处于一个比较低的水平,可能是因为过高的土霉素浓度对微生物的基础代谢产生了抑制作用。在降温期,添加土霉素处理与 CK 对氨基酸和羧酸类的利用差异达到显著水平(Plt;0.05),A2 处理对氨基酸的利用是最低的,A3 处理对羧酸类利用是最低的,反映出土霉素添加对堆料中微生物利用碳源的能力产生了显著的影响。从整个堆肥过程来看,A1 处理只在高温期对多聚化合物,降温期对氨基酸和羧酸类利用与 CK 差异显著(Plt;0.05),表明低浓度的土霉素对微生物代谢能力的影响不大;A2 和 A3 处理在高温期对六大类碳源的利用与 CK 相比差异达到显著水平,随着堆肥时间的延长,A2 和 A3 处理与 CK 对碳源利用基本没有显著的差异。在整个堆肥期间,A4 处理堆料中微生物对六大类碳源的利用一直处于一个较低的水平,表明极高浓度的土霉素处理对堆料中的微生物利用碳源的能力产生显著的抑制作用。

表8 不同时期不同土霉素处理堆料微生物对 6 类碳源的利用/AWCD
数值为平均值±标准差(mean±SD),n=3; 同一列数据中不同字母表示处理间差异显著(Plt;0.05)
3 讨论
堆肥化是在一系列酶的作用下进行的,堆肥进程中的酶活性受到微生物的种类、温度、pH值等环境因素的影响[31]。王丽平等人[32]指出土霉素污染对土壤生物化学性质的影响主要发生在土霉素进入土壤的初期,随着时间的增加,影响逐渐减弱和消失。本文研究土霉素对堆肥温度的影响表明土霉素能够对堆肥的温度造成一定影响,这可能是在堆肥前期土霉素的毒害作用造成微生物大量死亡,整体代谢活性偏低的结果。Boles[33]等研究发现土壤中 1 mg/kg的四环素可显著抑制土壤脱氢酶和磷酸酶的活性。姚志鹏[27]采用室内培养试验研究了土霉素对土壤过氧化氢酶、磷酸酶、脲酶、蔗糖酶和脱氢酶活性的影响,表明在培养第1天,100 mg/kg 土霉素处理对脲酶具有显著的刺激作用,以后土霉素对脲酶活性影响不明显,而对土壤过氧化氢酶、磷酸酶、蔗糖酶和脱氢酶主要体现抑制作用。本文的酶活性研究结果表明,140 mg/kg 土霉素浓度处理能够对纤维素酶活性产生抑制作用;对脲酶的影响是在堆肥初期(1—3 d) 起刺激作用,堆肥后期(18 d 之后)起抑制作用;在堆肥的 1—18 d 对过氧化氢酶活性基本上起促进作用,堆肥后期,抑制过氧化氢酶活性。本文的酶活性研究结果与上述作者的研究结果有不一致的地方,主要体现在土霉素对脲酶活性的影响,本试验研究结果是,在后期土霉素的浓度达到105 mg/kg 时对脲酶活性起着显著的抑制作用,而前人研究结果是后期土霉素浓度的高低对脲酶活性不会产生显著影响。可能是因为本次试验是在堆肥环境中进行的,温度波动较大,导致微生物的种群和数量变化较大,同时微生物分泌的胞外酶的量受到堆肥温度的影响较大。
土壤微生物是土壤生态系统中的重要组成部分。刘锋[17]等人研究了抗生素对土壤微生物呼吸的影响,结果表明四环素对土壤呼吸影响不大,Dijck[34]等研究发现饲料添加剂中的抗生素对土壤和水环境中典型微生物的生长有明显的影响。Biolog 微平板法广泛的被用于环境微生物群落方面的研究[35],通过测定Biolog 微平板中的吸光值表明土霉素在整个堆肥期间主要对堆料中微生物的活性起着抑制作用,说明在整个堆肥期间其毒害作用是一直存在的。而对微生物群落的功能多样性的影响主要体现在添加高浓度和极高浓度土霉素的堆料中,具体表现是随着堆肥时间的延续,在超过一定浓度土霉素的胁迫作用下,抗性物种大量产生,堆肥中微生物群落的功能多样性增加,由此可见,土霉素对微生物的种类和数量能够产生影响,并进而影响微生物的代谢活性和群落功能多样性,这与前人的研究结论一致。
4 结论
(1)土霉素能够对堆肥的温度造成一定影响,这种影响主要体现在高温期的维持时间,一般而言土霉素的浓度越高,对温度的影响越大。
(2)土霉素添加浓度达到105 mg/kg时,能够对堆肥的种子发芽指数造成显著的影响。
(3)土霉素的浓度越高对堆料中酶活性的影响越大,通过3种酶活性活性变化趋势分析,在堆肥开始阶段,土霉素一般能够激发酶的活性,但随着时间延长,土霉素的毒性作用开始显现出来,对酶活性的影响逐渐由正效应变为负效应。
(4)土霉素对微生物群落代谢的影响体现在:超过一定浓度的土霉素(大于105 mg/kg)对微生物的群落代谢产生显著的影响。
[1] Tiquia S M, Tam N F Y, Hodgkiss I J. Microbial activities during composting of spent pig-manure sawdust litter at different moisture contents. Bioresource Technology, 1996, 55(3): 201- 206.
[2] Montforts M H M M, Kalf D F, van Vlaardingen P L A, Linders J B H J. The exposure assessment for veterinary medicinal products. The Science of the Total Environment, 1999, 225(1/2): 119- 133.
[3] Hamscher G, Sczesny S, Höper H, Nau H. Determination of persistent Tetracycline residues in soil fertilized with Liquid manure by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry. Analytical Chemistry, 2002, 74(7): 1509- 1518.
[4] Wang J, Gu X J, Zhao J. Function of Soil enzyme activities in indicating soil fertility inLeylusechinensissteppe. Journal of Agro-Environment Science, 2006, 25(4): 934- 938.
[5] Acosta-Martínez V, Bell C W, Morris B E L, Zak J, Allen V G. Long-term soil microbial community and enzyme activity responses to an integrated cropping-livestock system in a semi-arid region. Agriculture, Ecosystems and Environment, 2010, 137(3/4): 231- 240.
[6] Chen W, Wu L, Frankenberger W T, Chang A C. Soil enzyme activities of long term reclaimed wastewater-irrigated soils. Journal of Environmental Quality, 2008, 37(5): 36- 42.
[7] Smårs S, Gustafsson L, Beck-Friis B, Jönsson H. Improvement of the composting time for household waste during an initial low pH phase by mesophilic temperature control. Bio Resource Technology, 2002, 84(3): 237- 241.
[8] Zaval M A L, Funamizu N, Takakuwa T. Modeling of aerobic biodegradation of feces using saw dust as a matrix. Water Research, 2004, 38(5): 1327- 1339.
[9] Guo X L, Gu J, Gao H, Qing Q J, Sun W, Chen Z X, Zhang W J, Li H L. Effect of Zn on physicochemical characteristics and hydrolase activities during composting of agricultural waste in high temperature and static state. Plant Nutrition and Fertilizer Science, 2011, 17(3): 638- 645.
[10] Zhang W J, Gu J, Gao H, Zhang H B, Liu Q, Li H L. Effects of heavy metals Zn on oxidoreductase activity during cocomposting of pig manure and straw. Journal of Agro-Environment Science, 2011, 30(2): 383- 388.
[11] Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (Vas) in the environment. Chemosphere, 2006, 65(5): 725- 759.
[12] Zhang S Q, Zhang F D, Liu X M, Wang Y J, Zou S W, He X S. Determination and analysis on main harmful composition in excrement of scale livestock and poultry feedlots. Plant Nutrition and Fertilizer Science, 2005, 11(6): 822- 829.
[13] Cao H L, Wang Q, Hu Q P, Chen W L. Optimized technology for aerobic fermentation of dairy manure to produce bioorganic fertilizer by inoculating compound microbes. Transaciions of the Chinese Society of Agricultural Engineering, 2009, 25(1): 189- 193.
[14] Guan S Y. Soil Enzymes and Methodology. Beijing: China Agriculture Press, 1983: 260- 339.
[15] Classen A T, Boyle S I, Haskins K E. Community-level physiological profiles of bacteria and fungi: Plate type and incubation temperature influences on contrasting soils. FEMS Microbiology Ecology, 2003, 44(3): 319- 328.
[16] Macgregor S T, Miller F C, Psarianos K M. Composting process control based on interaction between microbial heat output and temperature. Applied and Environment Microbiology, 1981, 41(5): 1321- 1330.
[17] Liu F, Ying G G, Zhou Q X, Tao R, Su H C, Li X. Effects of antimicrobial drugs on soil microbial respiration. Environmental Science, 2009, 30(5): 1280- 1285.
[18] Diao X P, Sun Y J,Sun Z J, Shen J Z. Effects of three kinds of veterinary drugs on microbe respiration in different soils. Journal of China Agricultural University, 2006, 11(2): 293- 298.
[19] Huang G F, Wu Q T, Meng Q Q, Huang H Z. Substance changes and maturity evaluation during pig manure composting. Journal of South China Agricultural University, 2002, 23(3): 1- 4.
[20] Guan J F. Microbial ecology and artificial inoculation during the theromophilic composting process of municipal refuse. Sichuan Environment, 2000, 19(3): 21- 30.
[21] Gu W J, Zhang F B, Xu P Z, Xie K Z, Tang S H, Chen J S, Huang X. Inoculum additions during composting: impacts on microbial populations and enzyme activity. Journal of Agro-Environment Science, 2009, 28(8): 1718- 1722.
[22] Zhang S Q, Zhang F D, Liu X M, Wang Y J, Zhang J F. Degradation of antibiotics and passivation of heavy metals during thermophilic composting process. Scientia Agricultura Sinica, 2006, 39(2): 337- 343.
[23] Benitez E, Nogales R. Enzyme activities as indicators of the stabilization of sewage sludge compostingwithEiseniafoetida. Bioresource Technology, 1999, 67(3): 297- 303.
[24] Pao Z, Cui Z J, Su B L. Characterization of biochemistry and degradation of plant inhibited materials during high temperature composting. Agro-Environmental Prothection, 2001, 20(4): 206- 209.
[25] Gu J, Li S X, Qing Q J, Li L M, Gao H. Changes of some hydrolase activities during agricultural waste materials composting in high temperature and static state. Chinese Agricultural Science Bulletin, 2005, 21(5): 32- 35.
[26] Shen Q R, Wang R B, Wang Y, Xu G H, Xu L, Biochemical characteristics of composting. Journal of Nanjing Agricultural University, 1996, 20(2): 51- 57.
[27] Yao Z P, Li Z J, Lang Y C, Zhang Y Q, Yao J H, Xie X Y. Dynamic responses of soil enzymatic activities to oxytetracycline in soil. Plant Nutrition and Fertilizer Science, 2009, 15(3): 696- 700.
[28] Liu L L, Lin K F, Su A H, Yang S S, Zhang M. Effects of tetrabromobisphenol A on soil enzyme activities. Environmental Pollution and Control, 2008, 30(6): 13- 17.
[29] Choi K H, Dobbs F C. Comparison of two kinds of Biolog micro plates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Journal of Microbiological methods, 1999, 36(3): 203- 213.
[30] Zabinski C A, Gannon J E. Effects of recreational impacts on soil microbial communities. Environmental Management, 1997, 21(2): 233- 238.
[31] Liu F, Ying G G, Yang L H. Terrestrial ecotoxicological effects of the antimicrobial agenttriclosan. Ecotoxicology and Environmental Safety, 2009, 72(1): 86- 92.
[32] Wang L P, Zhang M K. Effects of oxytetracycline pollution on soil biological properties. Journal of Agro-Environment Science, 2009, 28(7): 1434- 1438.
[33] Boles S, Alonso C, Pro J, Fernández C, Carbonell G, Tarazona J V. Toxicity of the antimicrobial oxytetracycline to soil organism in a mult-species soil system and influence of manure coaddition. Journal of Hazard Materials, 2005, 122(2): 233- 241.
[34] Dijck P V, Vande V H. Sensitivity of environmental microorganism to antimicrobial agents. Applied Environmental Microbiology, 1976,31(2): 332- 336.
[35] Xi J Y, Hu H G, Qian Y. Application of biolog system in the study of microbial community. Acta Microbiologica Sinica, 2003, 43(1):138- 141.
参考文献:
[4] 王娟, 谷雪景, 赵吉. 羊草草原土壤酶活性对土壤肥力的指示作用. 农业环境科学学报, 2006, 25(4): 934- 938.
[9] 郭星亮, 谷洁, 高华, 秦清军, 孙薇, 陈智学, 张卫娟, 李海龙. 重金属Zn对农业废弃物静态高温堆腐过程中理化性质和水解酶活性的影响. 植物营养与肥料学报, 2011, 17(3): 638- 645.
[10] 张卫娟, 谷洁, 高华, 张洪宾, 刘强, 李海龙. 重金属锌对猪粪堆肥过程中氧化还原类酶活性的影响. 农业环境科学学报, 2011, 30(2): 383- 388.
[12] 张树清, 张夫道, 刘秀梅,王玉军, 邹绍文, 何绪生. 规模化养殖畜禽粪主要有害成分测定分析研究. 植物营养与肥料学报, 2005, 11(6): 822- 829.
[13] 曹慧玲, 王琦, 胡青平,陈五岭. 添加复合菌剂好氧发酵牛粪生产生物肥料的工艺优化. 农业工程学报, 2009, 25(1): 189- 193.
[14] 关松荫. 土壤酶及其研究法. 北京: 中国农业出版社, 1983: 260- 339.
[17] 刘锋, 应光国, 周启星, 陶然, 苏浩昌, 李旭. 抗生素类药物对土壤微生物呼吸的影响. 环境科学, 2009, 30(5): 1280- 1285.
[18] 刁习平, 孙英健, 孙振钧, 沈建忠. 3 种兽药对土壤微生物呼吸的影响. 中国农业大学学报, 2006, 11(2): 293- 298.
[19] 黄国锋, 吴启堂, 孟庆强, 黄焕忠. 猪粪堆肥化处理的物质变化及腐熟度评价. 华南农业大学学报,2002, 23(3): 1- 4.
[20] 官家发. 高温堆肥发酵工艺处理城市生活垃圾过程中的部分微生物学问题. 四川环境, 2000, 19(3): 21- 30.
[21] 顾文杰, 张发宝, 徐培智, 解开治, 唐拴虎, 陈建生, 黄旭. 接种菌剂对堆肥微生物数量和酶活性的影响. 农业环境科学学报, 2009, 28(8): 1718- 1722.
[22] 张树清,张夫道, 刘秀梅, 王玉军, 张建峰. 高温堆肥对畜禽粪中抗生素降解和重金属钝化的作用. 中国农业科学, 2006, 39(2): 337- 343.
[24] 朴哲, 崔宗均, 苏宝林. 温堆肥的生物化学变化特征及植物抑制物质的降解规律. 农业环境保护, 2001, 20(4): 206- 209.
[25] 谷洁, 李生秀, 秦清军, 李明雷, 高华. 水解类酶活性在农业废弃物静态高温堆腐过程中的变化. 中国农学通报, 2005, 21(5): 32- 35.
[26] 沈其荣, 王瑞宝, 王岩, 徐国华, 余玲. 堆肥制作中的生物化学变化特征. 南京农业大学学报, 1996, 20(2): 51- 57.
[27] 姚志鹏, 李兆君, 梁永超, 张永清, 姚建华, 解晓瑜. 土壤酶活性对土壤中土霉素的动态响应. 植物营养与肥料学报, 2009, 15(3): 696- 700.
[28] 刘莉莉, 林匡飞, 苏爱华, 杨莎莎, 张梅. 四溴双酚A 对土壤酶活性的影响. 环境污染与防治, 2008, 30(6): 13- 17.
[32] 王丽平, 章明奎. 土霉素污染对土壤生物学性质影响的初步研究. 农业环境科学学报, 2009, 28(7): 1434- 1438.
[35] 席劲瑛, 胡洪营, 钱易. Biolog 方法在环境微生物群落研究中的应用. 微生物学报, 2003, 43(1): 138- 141.
EffectofOxytetraeyeline(OTC)ontheactivitiesofenzymeandmicrobialcommunitymetabolicprofilesincomposting
CHEN Zhixue1, GU Jie2,*, GAO Hua2, WANG Xiaojuan2, CHEN Lin1, HU Ting2
1CollegeofSciences,NorthwestAgricultureandForestryUniversity,Yangling712100,China2CollegeofNaturalResourcesandEnvironment,NorthwestAgricultureandForestryUniversity,Yangling712100,China
An outdoor experiment was conducted to study the effect of oxytetraeyeline addition on composting temperature, seed germination index, ratio of carbon to nitrogen, cellulose, urease, catalase and microbial community metabolism during composting of pig manure mixed with wheat straw. The results showed that composting temperature was reached to 50 ℃ in the second day of composting and lasted for 5 days on treatment without addition of oxytetraeyeline (Control check,CK), which could meet the need of the requirement of harmlessness. The composting temperature was above 51.0 ℃ in the fourth day of composting with addition of 35 mg/kg oxytetracycline (A1 treatment), and the high temperature period maintained for 1 day. The temperature was above 50 ℃ in the third day of composting where 70 mg/kg oxytetracycline was added (A2 treatment), and the high temperature period only hold on for 2 days. The temperature could not reach to 50 ℃ over the whole time of composting on both A3 and A4 treatments where 105 mg/kg and 140 mg/kg of oxytetracycline were spiked respectively. The germination indices (GI) of seeds, which contained in the compost materials, were higher than 80% for all treatments at the end of the composting. The C/N ratios for all treatments were decreased from an initial value of 34.50 to 16.64, 16.07, 19.48, 18.45 and 19.83, respectively, when composting completed. Activities of cellulose on treatments those receiving oxytetracycline were inhibited by 60.30%, 21.30%, 48.81% and 76.05%, respectively, over CK treatment in the first day of the composting, and they were increased in the third day. Nevertheless, activities of cellulase were inhibited under A3 and A4 treatments compared with CK from day 4 to day 30. The activity of urease was increased by addition of oxytetracycline in the first 3 days, since then on, it was decreased. The higher concentrations of oxytetracycline (A3 and A4) had a significant inhibitory effect on activity of urease from day 18 to day 30. The catalase activity was enhanced generally by the addition of oxytetraeyeline from day 1 to day 18 compared to CK, from then on it was decreased over CK. The effect of oxytetracycline addition on microbial community metabolic profiles during composting was assayed with Biolog (ECO Microplate) method. The results showed that AWCD (Average Well Color Development) values of CK treatment were the highest after 60 h incubation during temperature raising period of the compost. The highest AWCD values were observed on A2 treatment during the high temperature period. AWCD values under CK were greater than other treatments over cooling period. Shannon index results suggested that the oxytetracycline addition could reduce the functional diversity of microbial communities in the initial stage of the composting, in contrast, it could increase the functional diversity of microbial communities at other stages of composting. The carbon source utilization data showed that the addition of 140 mg/kg of oxytetracycline could significantly change the types of carbon sources used by microorganisms.
oxytetraeyeline; composting; enzymatic activities; microbial community
国家自然科学基金资助项目(40871119,41171203);农业部948资助项目(2010-Z20)
2012- 07- 09;
2013- 02- 27
*通讯作者Corresponding author.E-mail: gujoyer@sina.com
10.5846/stxb201207090961
陈智学,谷洁,高华,王小娟,陈琳,胡婷.土霉素对堆肥过程中酶活性和微生物群落代谢的影响.生态学报,2013,33(21):6957- 6966.
Chen Z X, Gu J, Gao H, Wang X J, Chen L, Hu T.Effect of Oxytetraeyeline (OTC) on the activities of enzyme and microbial community metabolic profiles in composting.Acta Ecologica Sinica,2013,33(21):6957- 6966.
