长江口及东海春季底栖硅藻、原生动物和小型底栖生物的生态特点
2013-12-09孟昭翠徐奎栋
孟昭翠,徐奎栋
(中国科学院海洋研究所,海洋生物分类与系统演化实验室,青岛 266071)
长江口及东海春季底栖硅藻、原生动物和小型底栖生物的生态特点
孟昭翠,徐奎栋*
(中国科学院海洋研究所,海洋生物分类与系统演化实验室,青岛 266071)
利用Ludox-QPS方法并结合沉积环境因子的综合分析,研究了2011年4月采自长江口及东海10个站位以底栖硅藻、纤毛虫和异养小鞭毛虫为代表的微型底栖生物及小型底栖生物的组成、丰度和生物量、分布及生态特点。结果表明,底栖硅藻的丰度 (5.92 × 104个/10 cm2) 和生物量 (83.29g C/10 cm2) 远高于纤毛虫 (丰度为1036 个/10 cm2,生物量为3.33g C/10 cm2)、异养小鞭毛虫 (丰度为4451 个/10 cm2,生物量为2.51g C/10 cm2) 和小型底栖生物 (丰度为(1947 ± 849) 个/10 cm2,生物量为(49.01± 22.05)g C/10 cm2)。在鉴定出的11个小型底栖生物类群中,线虫占小型底栖生物总丰度的90%和总生物量的37%。底栖硅藻生物量在长江口及东海海域呈由近岸向外海逐渐降低的分布特点,而底栖纤毛虫、异养小鞭毛虫及小型底栖生物的分布则正相反。在垂直分布上,76%的硅藻和80%的线虫分布在0—2 cm沉积物表层,仅1%的硅藻和6%的线虫分布在5—8 cm分层。统计分析表明,底栖硅藻的现存量与沉积物中叶绿素a含量呈极显著的正相关,与底层水温度呈弱的正相关;该海域底栖原生动物和小型底栖生物的分布受多个因子而非单一环境因子的共同作用。对比分析表明,长江口及东海单位体积沉积物中的硅藻丰度较水体中的硅藻丰度高2个数量级,沉积物中相当部分的叶绿素a含量可能系底栖硅藻所贡献;表层8 cm沉积物中纤毛虫的丰度约是上层30 m水柱中纤毛虫丰度的30倍,生物量约是后者的40倍。尽管纤毛虫在生物量上远小于小型底栖生物,但其估算的生产力约是后者的3倍;而异养小鞭毛虫由于个体更小,其周转率可能较纤毛虫更高。长江口及东海陆架区原生动物和小型底栖生物的高现存量及生产力预示着其在该海域生态系统中的重要作用。
微型底栖生物;小型底栖生物;现存量;分布;长江口;东海
微型底栖生物 (microbenthos) 是指生活于沉积物表面和底内,被0.22 μm滤膜存留的所有单细胞原核和真核微型生物[1- 2];小型底栖生物 (meiobenthos) 是指分选时能通过0.5 mm孔径的网筛,但被0.042 mm孔径网筛 (深海研究通常用0.031 mm) 所阻留的一类底栖生物。已有的研究表明,底栖生态系统中存在一个类似浮游生态系统微食物网的底栖微/小食物网,即由微微型和微型生物及小型后生动物组成的底栖食物网,应被视为一个完整的功能群[3]。微型和小型底栖生物内部及两者之间通过复杂的营养关系,在碳源的回收、利用、向高营养级的传递及能量流动中起着重要的枢纽作用[4- 6]。微藻是底栖生态系统中的主要初级生产者,底栖硅藻作为微藻的主要组成部分,是一些海洋动物幼体和经济类软体动物的饵料;原生动物既是细菌和微藻的主要捕食者,也是很多小型底栖动物的重要饵料来源;而小型底栖生物也是许多经济鱼、虾和贝幼体阶段等的优质饵料。微小型底栖生物的群落结构、多样性格局和生物量变动会对整个微食物网及近岸浅海生态系统产生影响,从而直接或间接地影响海洋渔业资源。
微型底栖生物个体微小、多样性高、功能复杂,尤其底栖纤毛虫个体极其脆弱、鉴定需经过特殊的染色,且需从沉积物中有效分离和提取出来。目前对微型底栖生物的研究,总体上处于起步阶段。国际上同时对微型底栖生物各类群的研究较少,已有的数份工作基本局限于近岸潮间带生境[4- 6]。近年来国内对我国近岸海域的底栖细菌、微藻、原生动物的现存量及分布特点等分别进行了研究[7- 8],仅Meng等 从整体上报道了黄海陆架海域微型底栖生物各类群的现存量及生态特点[9]。国际上对小型底栖生物的研究较早,有关河口、陆架水域小型底栖生物的生态学研究已有较为详尽的报道[10]。国内相关研究启动于渤海[11- 12],相继在东海、黄海和南海陆续开展[13- 15],但涉及长江口邻近海域的研究较少[15- 17]。
东海长江口、舟山附近海域是重要的渔业和养殖基地,同时也是赤潮高发区。长江径流、沿岸流以及台湾暖流等水团的交汇,对长江口邻近海域的海洋生态系统有重要影响。本研究系国家重点基础研究发展计划 (973) 水母调查专项的一部分,旨在了解长江口及东海海域底栖硅藻、纤毛虫、异养小鞭毛虫为代表的微型底栖生物和小型底栖生物的类群构成、丰度、生物量及分布特征及其与环境因子的关系,阐释其在该海域丰度和生物量上的重要性和潜在的生态作用,为进一步了解长江口及东海底栖生态系统的能流及与水母发生的关系提供基础资料。
1 材料与方法
1.1 调查海域与样品采集
2011年4月6—25日搭乘中国科学院海洋研究所“科学三号”考察船,在“973”水母调查专项支持下,对长江口及东海海域 (2931—3159N,12223—12530E) 10个站位 (4个断面L、M、N、PN) 进行了底栖生物及沉积物环境因子调查 (图1)。

图1 长江口及东海采样站位图 Fig.1 Sampling stations in the Changjiang Estuary and East China Sea
利用0.1 m2改进型Gray-Ohara箱式采泥器在每一站位采集3箱未受扰动的沉积物样品,用内径为2.3 cm的注射器改造的采样管采集8 cm长芯样7个 (随机选取一箱采集3管,其它两箱各采2管) 按0—2 cm、2—5 cm、5—8 cm进行分层,其中将4个芯样 (含3个重复样,1个备份样) 的各分层进行瓶装,用终浓度为2%冷戊二醛溶液固定,4 ℃避光保存用于微小型底栖生物分析;另外3个芯样的相应分层合并后装入封口袋,-20 ℃冷冻保存, 用于沉积物的粒度、叶绿素a、脱镁叶绿素a、有机质及含水量测定。
1.2 样品分析方法
沉积物中以底栖硅藻、纤毛虫和异养小鞭毛虫为代表的微型底栖生物及小型底栖生物利用Ludox-QPS染色方法进行分析[18- 19],主要步骤为首先利用Ludox HS 40密度梯度离心法从沉积物中提取获得底栖生物样品,后经过定量蛋白银染色 (QPS),获得微型及小型底栖生物的银染制片。封片置于Nikon E80i显微镜100—1000倍下,依据相关文献资料对微小型底栖生物进行鉴定和计数[10, 20- 23]。硅藻仅计数保留较完整色素体的底栖生个体,沉降到海底的浮游类群未计入。
微型和小型底栖生物的生物量通过测量个体大小后换算为生物体积或个体重量进行估算,以μg C/10 cm2或μg C/cm3表示。将镜检记录的每种生物的长、宽、高,根据大体几何形状换算成生物体积或依据相应的系数转换成个体重量[24]。测量一般随机选取20个生物个体 (如果个体不足20则全部计数),取平均值。微型和小型底栖生物的各类群依据相应的系数将生物体积或个体重量转换为生物量[2,24- 25]。
沉积物粒度分析采用Cilas (940L) 型激光粒度仪进行。沉积物叶绿素a和脱镁叶绿素a利用Turner II荧光光度计测定。有机碳利用总有机碳分析仪Vario TOC Cube (Elementar, Germany) 测定,有机质含量为有机碳含量乘以系数1.724。含水量根据沉积物烘干 (80 ℃,48 h) 前后质量的减少来计算。水深及底水层温度、盐度数据来自随船温盐深测定仪 (CTD) 现场测定。
1.3 数据统计分析
采用Surfer 8.0绘制站位图及各生物类群丰度和生物量的等值线图。采用SPSS 15.0统计软件对微小型底栖生物各类群的丰度与环境因子进行相关分析。为使数据正态分布,原始数据经过log(x+1)转化处理。利用PRIMER 6 (Plymouth Routines in Multivariate Ecological Research) 软件包中的Cluster分析各研究站位纤毛虫各物种及其丰度的等级聚类;利用BIOENV分析,即通过计算环境因子非相似性矩阵与生物群落结构 (各物种/类群及其丰度) 的非相似性矩阵之间的相关性,找出与生物群落结构相关性最高的环境因子组合。
2 结果
2.1 长江口及东海海域的环境因子
研究海域各调查站位的平均水深为(44 ± 24) m,随着离岸距离增大,水深逐渐加深,最浅处为近岸的PN1站 (13 m),最深处为离岸最远的PN7站 (100 m)。底层水温度平均为(11.9 ± 1.5) ℃ (除L1站),最高水温见于N1站 (13.8 ℃),最低水温出现于L6站 (9.5 ℃)。底层水盐度平均为(33.0 ± 1.4)(除L1站),其变化趋势与水深相似,同样位于离岸最远的PN7站的盐度最大 (34.2),PN1站盐度最小 (29.8)。沉积物类型从极细粉砂到细砂,中值粒径为6—202m。沉积物有机质含量平均为(0.52 ± 0.22)%,最高值出现于PN1站 (1.03%),最低值出现于L6站 (0.27%)。表层2 cm沉积物叶绿素a平均含量为(0.74 ± 0.55)g/g沉积物干重,沉积物脱镁叶绿素a平均含量为(2.47 ± 1.43)g/g沉积物干重,两者的最高值均出现于N1站 (1.89g/g, 4.47g/g),最低值均见于长江口近岸的L1站 (0.11g/g, 0.66g/g) (表1)。

表1 长江口及东海海域研究站位的环境因子
-: 示数据缺失; WD: 水深 Water depth; BWT: 底层水温 Bottom water temperature; BWS: 底层水盐度 Bottom water salinity; Md: 沉积物中值粒径 Median grain size of sediment ; Chla沉积物叶绿素a Sediment chlorophyll a; Pha: 沉积物脱镁叶绿素a Sediment phaeophytin a; OM: 沉积物有机质 Sediment organic matter
2.2 底栖硅藻、纤毛虫、异养小鞭毛虫及小型底栖生物的水平分布
2011年4月长江口及东海表层0—8 cm沉积物中微小型底栖生物的丰度和生物量在各站位间的差异较大 (图2,图3)。底栖硅藻的丰度为 (5.92 ± 6.18) × 104个/10 cm2,生物量为(83.29 ± 94.59)g C/10 cm2,其丰度和生物量在长江口及东海海域整体呈现由近岸向外海逐渐降低的趋势,最高值出现在N1站 (1.60×105个/10 cm2, 243.78g C/10 cm2),最低值见于L1站 (53 个/10 cm2, 0.0059g C/10 cm2) (图1,图2)。就4个断面来看,N断面底栖硅藻的丰度和生物量最高,其次是PN、M断面,L断面的最低。本研究中共发现硅藻5种,隶属于5属,齿状藻属 (Odontella)为最优势类群,其次为曲舟藻 (Pleurosigma) 和菱形藻 (Nitzschia)。
底栖纤毛虫的平均丰度为(1036 ± 515) 个/10 cm2(合14 个/cm3),其分布趋势与硅藻相反,4个断面均由近岸向外海逐渐增加,最大值出现于L6站 (1737 个/10 cm2),最小值见于L1站 (246 个/10 cm2) (图1,图2);底栖纤毛虫的生物量为(3.33 ± 1.63)g C/10 cm2,生物量整体分布趋势与丰度分布相近,但在调查海域南部形成以PN4站 (6.29g C/10 cm2) 为中心的高值区,最小值出现于M1站 (0.97g C/10 cm2) (图1,图2)。就4个断面来看,PN断面底栖纤毛虫的丰度和生物量最高,其次是N、L断面,最后是M断面。
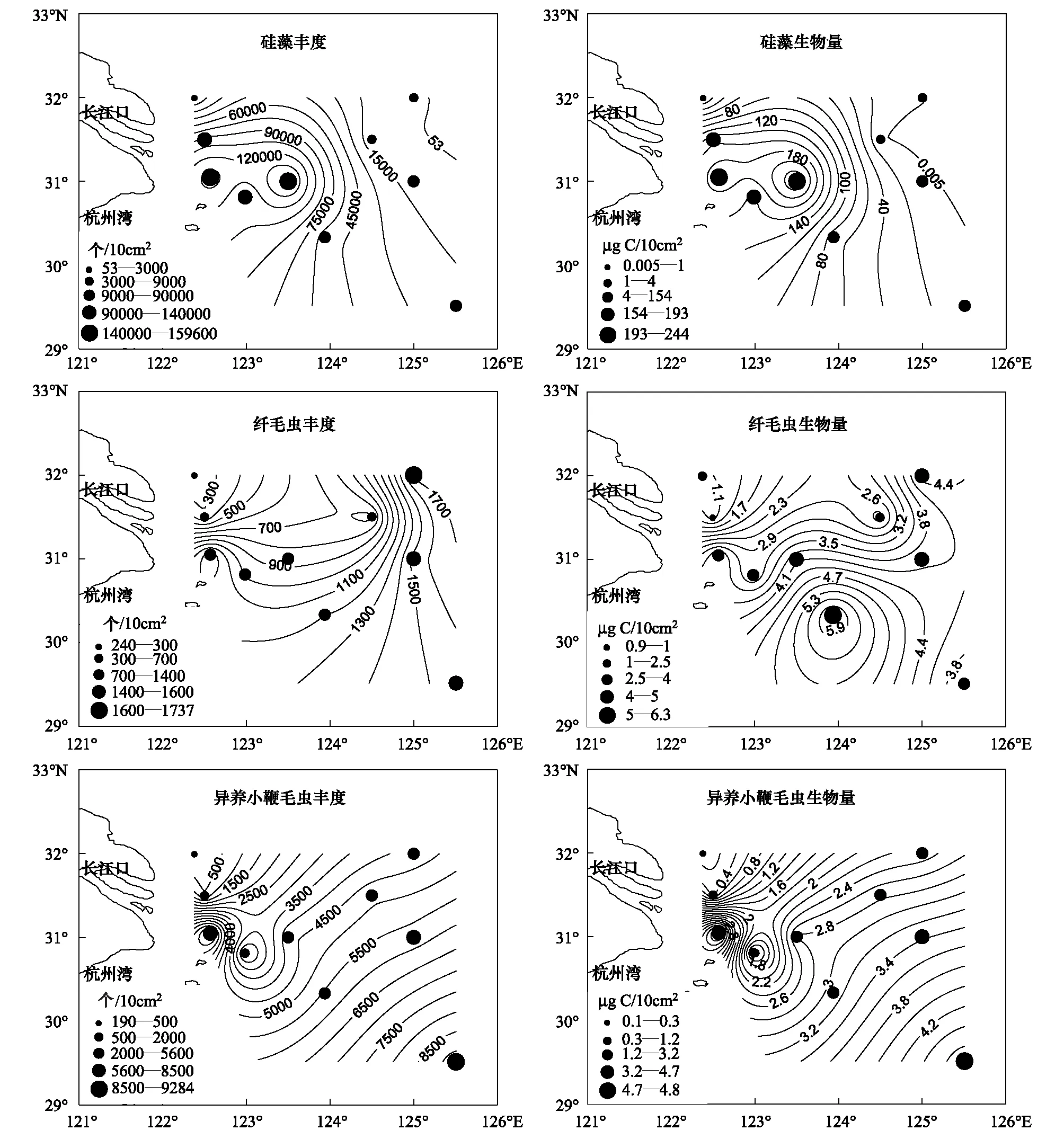
图2 长江口及东海海域底栖硅藻、纤毛虫及异养小鞭毛虫的丰度和生物量分布图Fig.2 The abundance and biomass of benthic diatoms, ciliates and heterotrophic microflagellates in the upper 8 cm of sediments from the ten stations in the Changjiang Estuary and East China Sea
底栖异养小鞭毛虫的丰度为(4451 ± 2990) 个/10 cm2(合56 个/cm3),生物量为(2.51 ± 1.63)g C/10 cm2,其丰度和生物量呈现从L1站到PN7站方向逐渐增加的趋势,并在硅藻最丰富之一的PN1站位处形成一个高值中心,但最高值出现于离岸最远的PN7站 (9284 个/10 cm2, 4.76g C/10 cm2) (图1, 图2)。底栖异养小鞭毛虫的丰度和生物量在4个断面的分布情况与硅藻相同。
小型底栖生物的平均丰度为(1947 ± 849) 个/10 cm2(合(24 ± 11) 个/cm3),平均生物量为(49.01±22.05)g C/10 cm2((0.61 ± 0.28)g C/cm3)。其丰度的分布趋势与所涉微型底栖生物的分布不同,在调查海域的中心区域丰度值较高,长江口近岸及外海的丰度较低,最高值出现在N1站 (3831 个/10 cm2),其次为M1站 (2841 个/10 cm2),最低值见于M4站 (910 个/10 cm2) (图1,图3)。生物量的分布趋势整体上由近岸到外海增大,最高值出现在L6站 (84.1g C/10 cm2),但最低值出现在PN7站 (16.80g C/10 cm2) (图1,图3)。就4个断面来看,N断面的小型底栖生物的丰度最高,其次是M、L断面,最后是PN断面;而生物量是M断面最高,其次是N、L断面,最后是PN断面。
在鉴定出的11个小型底栖生物类群,线虫在丰度上占绝对优势,丰度为(1755 ± 803) 个/10 cm2,占小型底栖生物总丰度的90.15%,其分布趋势与小型底栖生物一致 (图3);生物量为(18.03 ± 8.52)g C/10 cm2,生物量的分布趋势与小型底栖生物相反,整体为由近岸到外海逐渐降低 (图3)。其他常见类群为桡足类 (丰度占小型底栖生物总丰度的2.24%)、多毛类 (2.05%)、甲壳类幼体 (1.98%) 和动吻类 (1.79%)。但生物量上的贡献依次为线虫 (36.80%)、多毛类 (35.30%)、其他 (13.51%)、桡足类 (6.49%)、动吻类 (2.96%)、介形类 (2.88%) 等。
2.3 底栖硅藻、纤毛虫、异养小鞭毛虫及小型底栖生物的垂直分布
2011年4月长江口及东海海域所研究微小型底栖生物的丰度随沉积物深度的增加而减少 (图4)。调查站位沉积物表层0—2 cm中硅藻丰度为 (4.47 ± 5.47) × 104个/10 cm2,占总数的76%;23%分布在2—5 cm分层 (1.37 × 104个/10 cm2);仅1%分布在5—8 cm分层 (762 个/10 cm2)。底栖纤毛虫约有75%分布在0—2 cm (848 个/10 cm2),6%分布在5—8 cm分层 (47 个/10 cm2)。底栖异养小鞭毛虫垂直分层较硅藻和纤毛虫不明显,约有61%分布在0—2 cm (2716 个/10 cm2),14%分布在5—8 cm分层 (616 个/10 cm2)。
小型底栖生物同样主要分布在沉积物表层0—2 cm。线虫在表层丰度为1397 个/10 cm2,占总数的80%,次表层和底层所占丰度比例分别为14%和6%。小型底栖生物其他类群中,动吻类在表层的比例高达96%,甲壳类幼体和桡足类的比例均为92% (图4)。

图3 长江口及东海小型底栖生物和线虫的丰度和生物量分布图Fig.3 The abundance and biomass of meiobenthos and nematodes at the ten stations in the Changjiang Estuary and East China Sea

图4 长江口及东海底栖硅藻、纤毛虫、异养小鞭毛虫及小型底栖生物主要类群的垂直分布Fig.4 Vertical distribution of benthic diatoms, ciliates, heterotrophic microflagellates and the main groups of meiobenthos at the ten stations in the Changjiang Estuary and East China Sea
2.4 底栖纤毛虫群落结构特征
本研究中共发现纤毛虫15纲/亚纲,23目,58属91种,其中85种鉴定到属/种。裂口纲 (Litostomatea) 种类数最多 (21种),其次是前口纲 (Prostomatea, 13种)、异毛纲 (Heterotrichea, 11种) 和腹毛亚纲 (Hypotrichia, 10种)。前口纲在丰度及生物量上均为最优势的类群 (丰度占41.1%,生物量占49.1%),其次是核残迹纲 (Karyorelictea),丰度仅占2.5%,但由于个体较大,生物量占总量的17.5%,再次是钩刺亚纲 (Haptoria, 丰度占9.4%,生物量占10.5%) (图5)。在本研究中出现的缘毛亚纲 (Peritrichia) 类群多外栖于线虫或桡足类体表,少数为群体类群。
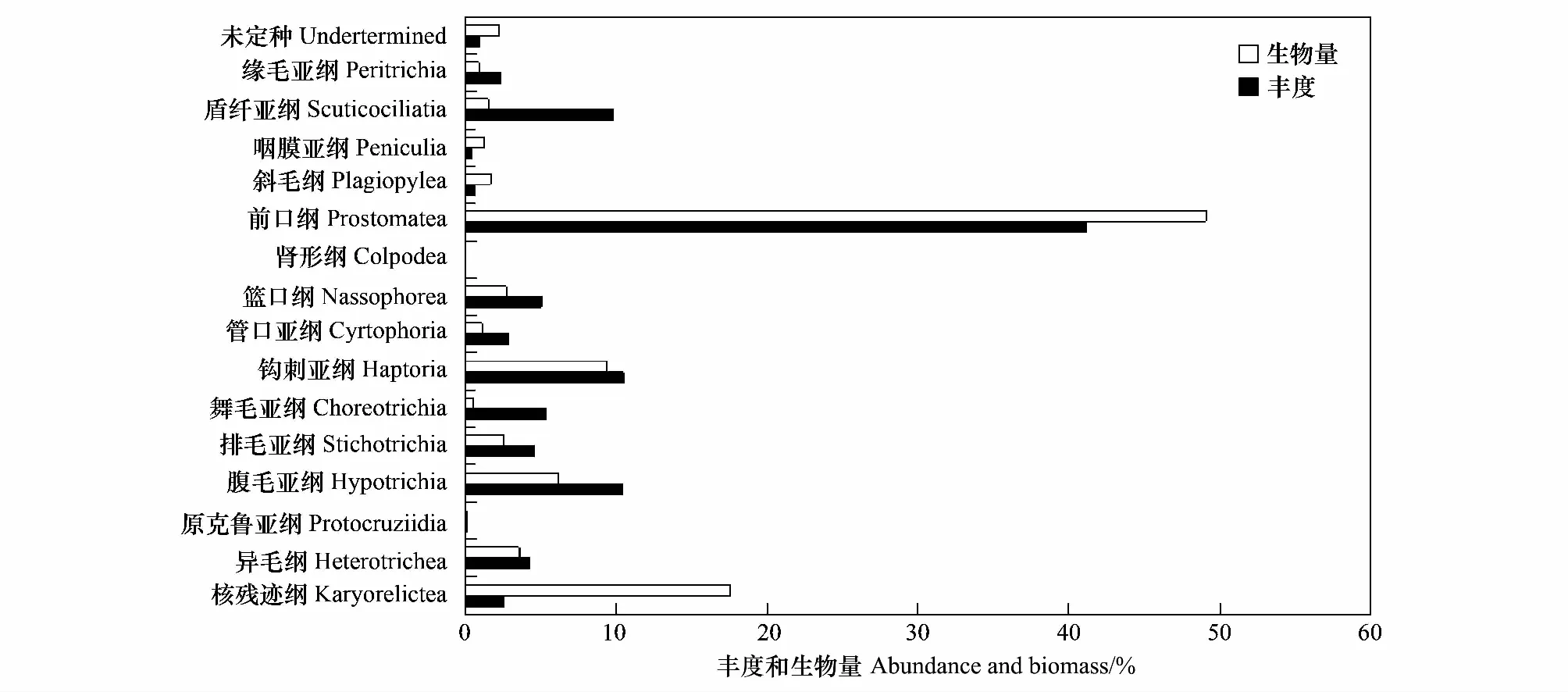
图5 长江口及东海海域底栖纤毛虫主要类群丰度和生物量百分比Fig.5 Proportions of main benthic ciliate assemblages in abundance and biomass at the ten stations in the Changjiang Estuary and East China Sea
依据有关纤毛虫食性的文献及对纤毛虫食物泡的镜检观察,肉食性纤毛虫计有41种,菌食性29种,藻食性14种,杂食性9种。肉食性纤毛虫主要是前口纲的裸口虫属 (Holophrya)、钩刺亚纲及核残迹纲的代表种类,在0—8 cm沉积物中其丰度占总丰度的42.4%,由于此类虫体个体较大其生物量占总生物量的68.1%。菌食性纤毛虫主要优势类群为楯纤虫属 (Aspidisca)、游仆虫属 (Euplotes)、表列虫属 (Epiphyllum)、中圆虫属 (Metacystis) 及盾纤亚纲 (Scuticociliatia) 的一些类群,其丰度占43.1%,生物量占20.0%。藻食性纤毛虫主要类群为乳突盘毛虫 (Discotrichapapillifera)、佛瑞环须虫 (Peritromusfaurei) 及偏体虫属 (Dysteria) 的类群,其丰度仅占10.4%,生物量占6.1%。其他无选择性的杂食性纤毛虫丰度仅占3.2%,生物量占3.5%。
对研究站位纤毛虫群落结构进行的Cluster分析结果表明,在22.23%的相似性水平上,长江口及东海的10站位分成了两组 (图6),经SIMPROF检验分成两组的纤毛虫群落结构具有显著差异 (Plt;0.001)。其中最邻近长江口的L1和M1站位分为一组,其特点为水较浅 (18m, 25m),底层水盐度及脱镁叶绿素a含量较低 (表1)。另外一组包含其余8个站位,可分成3个亚组,但3个亚组间的纤毛虫群落结构无显著差异。其中亚组Ⅰ包含N1和PN4站位,两站位具有相近的水深、底层水温度和盐度以及沉积物中值粒径 (表1);亚组Ⅱ包括M4、L6和PN1站位;亚组Ⅲ包括PN2、PN7和N3 (图6)。

图6 长江口及东海底栖纤毛虫群落结构的聚类分析 Fig.6 Cluster analysis of ciliate communities at the ten stations in the Changjiang Estuary and East China Sea
2.5 微小型底栖生物各类群丰度与环境因子的关系
统计分析表明,2011年4月长江口及东海海域沉积物中底栖硅藻丰度与沉积物叶绿素a含量呈极显著正相关 (P=0.002),与底层水温度呈正相关关系 (P=0.028),桡足类丰度与水深及沉积物中脱镁叶绿素含量、甲壳类幼体丰度与水深均呈正相关关系 (P=0.046,P=0.027,P=0.050),小型多毛类丰度与底层水温度呈负相关关系 (P=0.017)。
BIOENV分析表明,纤毛虫群落结构与底层水盐度与沉积物中脱镁叶绿素a含量的组合最相关 (R=0.503,P=0.018);沉积物中叶绿素a和脱镁叶绿素a含量的组合是解释所涉微型底栖生物群落结构变动的最佳环境因子组合 (R=0.396,P=0.022),而小型底栖生物群落结构与除底层水温和沉积物有机质含量以外的其他环境因子 (包括水深、底层水盐度,沉积物中叶绿素a,脱镁叶绿素a和中值粒径) 的组合相关性最强 (R=0.381,P=0.008)。
3 讨论
3.1 底栖硅藻、原生动物和小型底栖生物的现存量
在长江口及东海海域,迄今尚没有底栖硅藻丰度和生物量的相关报道。高亚辉等报道长江口邻近海域春季表层和中层海水中浮游硅藻的丰度为 (0.43—23.3) × 103个/L (平均4.61 × 103个/L)[26],较本研究自表层8 cm沉积物中检获的硅藻平均丰度 (740 个/cm3) 低了约2个数量级。在潮间带砂质和泥质沉积物中,底栖硅藻是初级生产力的重要组成部分[27]。Epstein报道表层3 cm细砂质沉积物中硅藻数量达9.1 × 105个/cm3[4];Lei等报道表层3 mm砂质沉积物中硅藻数量为105—107个/cm3[27]。相较于此,本研究自长江口及东海陆架区获得的硅藻丰度不仅明显低于自潮间带的数据,而且也低于自黄海陆架区的底栖硅藻丰度 (1.35 × 104个/cm3)[9]。主要原因可能在于,硅藻作为自养生物其生长需要一定的光强,长江口及东海的站位水深虽较黄海的站位略浅,但长江、钱塘江及地表径流等携带的大量悬浮泥沙进入海洋,导致长江口及东海近岸海域海水透明度低,能够到达海底的光较弱,从而抑制了硅藻的生长。这可从长江口附近水深仅18 m的L1站即可看出,该站位水体中含有大量泥沙,透明度低,底栖硅藻数量最少,该站水体中浮游硅藻的丰度也明显低于临近的M1站和PN1站。而离岸稍远的N1站,水质明显较清,尽管水深达51 m,却是本研究中硅藻丰度和生物量量最高的站位。
有关离岸海域底栖纤毛虫和异养小鞭毛虫的相关报道极少,目前尚缺少长江口及东海海域异养小鞭毛虫丰度和生物量的相关报道。Meng等曾报道黄海陆架海域沉积物中纤毛虫的丰度为(33 ± 36) 个/cm3((2433 ± 2675) 个/10 cm2),生物量为(0.10 ± 0.10) μg C/cm3((7.81 ± 8.27) μg C/10 cm2);异养小鞭毛虫的丰度为(30 ± 33) 个/cm3((2650±2864)个/10 cm2),生物量为(0.02 ± 0.03) μg C/cm3((1.85 ± 2.04) μg C/10 cm2)[9]。与此相比,本研究海域底栖纤毛虫的丰度及生物量较黄海陆架区域低,而异养小鞭毛虫的丰度和生物量则较黄海陆架海区高。与自潮间带报道的底栖纤毛虫和异养小鞭毛虫的丰度(约为10—103个/cm3)相比[4- 5,29],本研究所获底栖纤毛虫和异养小鞭毛虫丰度明显偏低。然而,对长江口及东海相同站位的浮游纤毛虫的研究结果显示,上层30 m水柱中的纤毛虫丰度为34 (7—68) 个/10 cm2,生物量为0.08 (0.03—0.12) μg C/10 cm2[30]。如此,该海域表层8 cm沉积物中的纤毛虫丰度 (1036 个/10 cm2) 约为浮游纤毛虫丰度的30倍,生物量 (3.33g C/10 cm2) 则是后者的约40倍。由此可见,底栖纤毛虫在该海域的作用不容忽视。
长江口及东海的小型底栖生物在丰度上高于底栖纤毛虫,但明显低于异养小鞭毛虫,而生物量则远高于后二者。本研究检获的小型底栖生物主要类群构成与中国其他海域相似,丰度与相同海域的研究结果接近或略高[15- 17],低于渤海、北黄海[11- 13],高于南黄海、东海和南海[13- 14]。与丰度数据不同的是,所获小型底栖生物的生物量低于我国已有的报道。造成差异的主要原因是对小型底栖生物生物量的估算方法不同造成的,本研究系通过直接测量各类群个体大小计算的实际生物量,而已有的报道数据基本不经由测量个体大小,而是通过经验系数估算所得。如果将本研究获得的个体数量通过各类群个体干重的经验系数计算获得其干重生物量,并依据Feller 等转换为有机碳生物量[25],则估算的小型底栖生物生物量将是本研究结果的14倍。由此,通过经验系数获得的所研究海域的小型底栖生物生物量仅低于黄海[13],高于同一海域及我国其它海域的研究结果[12,14- 17]。可见,不测量个体实际大小,而通过经验系数获得的小型底栖生物的生物量将不同程度地高估其实际生物量,尤其是对处于繁殖季节的线虫而言。而且,因海域及季节的差异,小型底栖生物各类群的个体大小往往差异较大。如王家栋等研究表明北黄海小个体线虫较多[13],若采用传统的个体干重的经验系数计算生物量,无疑会造成对生物量不同程度的高估。
3.2 底栖硅藻、原生动物和小型底栖生物的分布及与环境因子的关系
本研究表明,长江口及东海海域沉积物中硅藻与纤毛虫、异养小鞭毛虫及小型底栖生物具有不同的分布特点。整体来看,底栖硅藻的丰度和生物量在长江口及东海呈现由近岸向外海逐渐降低的分布特点,而作为其摄食者的底栖纤毛虫、异养小鞭毛虫及小型底栖生物的现存量分布则与此相反,向外海呈增大趋势。而且,小型底栖生物丰度和生物量的分布不相一致,其丰度在长江口近岸及东海外海较低,高值区出现在调查海域中心区域的N1站;生物量则在东海呈向外海逐渐增大的趋势,生物量高值区出现在最北部且远离长江口的L6站。L6站沉积物中值粒径为最大,因砂含量高,有机质保存积累相较困难,故沉积物有机质含量最低,但沉积物类型是个体较大的底栖桡足类所喜爱的生境,也是纤毛虫数量最多的站位。然而,作为初级生产力状况和微小型底栖生物食物供给及底质环境状况指标的沉积物叶绿素a含量明显较低。综合来看,该站底栖环境较好。
研究表明,许多底栖环境因子 (如水深、温度、盐度、沉积物粒径及食物可得性等) 对底栖生物的分布具有调控作用,但影响微小型底栖生物数量分布的常常是多因子的共同作用[4- 6,17]。长江口和东海是一个诸多环境因子相互作用和影响的较为特殊的生态系统。长江口是陆源物质输入东海的主要场所,长江、钱塘江两大江河的冲淡水把大量的悬浮泥沙和丰富的营养盐带入海洋,且在长江径流、东海沿岸流、台湾暖流、杭州湾环流的共同作用下,长江冲淡水由入海口开始向东北偏转,盐度也由近岸到东北方向逐渐增大。在此背景下,所研究海域的底栖纤毛虫和异养小鞭毛虫未见与任何单一环境因子的关联,仅纤毛虫群落结构与底层水盐度和沉积物脱镁叶绿素a含量的组合具有相关性。对研究站位纤毛虫群落结构进行的Cluster分析表明,长江口及东海10个站位的纤毛虫群落结构可分成具有显著性差异的两组,其中邻近长江口的L1和M1站位分为一组,其生境特点为水浅、底层水盐度和脱镁叶绿素a含量低,脱镁叶绿素a含量的高低代表着沉积物中已死亡及沉降的藻类的多寡。受长江冲淡水的影响,这两个站位水体悬浮物多,水体浑浊,导致叶绿素a含量较低,其中L1站是调查站位中沉积物叶绿素a和脱镁叶绿素a含量最低的,也是底栖纤毛虫、异养小鞭毛虫和底栖硅藻数量最少的站位。
而底栖硅藻丰度除与沉积物叶绿素a含量呈极显著的正相关关系外,仅与底层水温度有正相关关系,表明温度是影响底栖硅藻种类组成和数量分布的主要因子之一,它不仅影响底栖硅藻的生长发育,而且对酶的活性、营养物的吸收利用及细胞分裂周期等诸多方面都存在不同程度的影响[31]。因此,对于底栖硅藻增长率的估算模型中,温度是一个极重要的参数[32]。小型底栖生物中的桡足类丰度与水深及沉积物中脱镁叶绿素含量、甲壳类幼体丰度与水深均呈正相关关系,但无法据此解释其何以相关。而作为小型底栖生物中最丰富类群的线虫,则未见与任何底栖环境因子相关。同样地,小型底栖生物作为一个整体也未见与单一环境因子的相关关系,而是与包括水深、沉积物中叶绿素a,脱镁叶绿素a和中值粒径等因子的组合具有相关性。这些结果表明,该海域微小型底栖生物的数量分布是受多个环境因子共同影响和作用所致。
3.3 底栖硅藻、纤毛虫及小型底栖生物的生产力及相对贡献
海洋初级生产力是指海洋中初级生产者通过同化作用将无机物转化为有机物的能力,初级生产所获得的颗粒或溶解有机物是海洋生态系统食物网的起点,海洋中一切有机体的食物来源都直接或间接地依靠海洋初级生产。硅藻是初级生产者的重要组分,对初级生产力具有重要贡献。纤毛虫是微型底栖动物的重要组分,既作为细菌、藻类等的捕食者,又为小型及大型动物所摄食,在海洋生源要素循环中起着重要作用。本研究没有直接测定微小型底栖生物的生产力,依据公式估算长江口及东海表层5 cm沉积物中的初级生产力,以及底栖硅藻、纤毛虫及小型底栖生物的生产力。
已有研究表明,在海洋潮间带沉积物中初级生产力为5—570 mg C m-2d-1[33]。沉积物中初级生产力的估算按照Davis等[34]:P= 9.57 + 0.35 Chl a,式中P为初级生产力总量 (mg C m-2h-1),Chl a为沉积物叶绿素a的含量 (mg/m2)。根据该公式估算,本研究站位表层5 cm沉积物中的初级生产力约为703 mg C m-2d-1(29 mg C m-2h-1)。对底栖硅藻的增长率估算依据Montagnes等[32]:μ-2.40 ×0.85T- 0.0056 logV×T+ 1.10,其中μ为硅藻的增长率 (d-1),V为硅藻的体积 (m3),T为温度 (℃);生产力通过其增长率 (μ) 和生物量 (B) 来估算:P=μ×B。由此,获得的研究站位表层5 cm沉积物中硅藻的生产力估算值为39 mg C m-2d-1。估算的底栖初级生产力与Meng等 自黄海陆架区估算的数据 (601 mg C m-2d-1) 接近[9],明显高于商栩等自长江口盐沼湿地获得的数据 (189 mg C m-2d-1)[7],但低于尹晖等 自乳山湾滩涂养殖区 (68.40—92.98 mg C m-2h-1)[35]和宁修仁等自象山港潮滩报道的数据 ((45.1 ± 46.8) mg C m-2h-1)[36],略低于焦念志等报道的东海春季水体初级生产力 (200—2770 mg C m-2d-1)[37]。
需要指出的是,本研究所估算的初级生产力并非实测值,而是通过沉积物叶绿素a含量计算所得。由于沉积物表层相当部分的叶绿素a可能来源于水体中浮游植物的沉降,以此估算的底栖初级生产力必然会不同程度地高估其实际值。另一方面,底栖初级生产力不仅与叶绿素a的含量相关,而且与海底的光强密切相关,长江口及东海因海水透明度低,到达海底的光较弱,由此必然影响沉积物中的初级生产力。本研究发现,底栖硅藻的数量和沉积物叶绿素a含量有极显著的相关关系,由此推测沉积物中相当部分的叶绿素a含量可能系底栖硅藻所贡献。因此,通过叶绿素a估算的底栖初级生产力,可能低估了底栖硅藻对底栖初级生产力的贡献。
在海洋底栖生态系统中,小型底栖生物常被认为在生物量上仅次于大型底栖动物。本研究显示,长江口及东海的小型底栖生物在生物量上低于底栖硅藻,但远高于底栖纤毛虫和异养小鞭毛虫为代表的原生动物。但原生动物因个体微小,周转率高,因而在底栖生物生产力中所占的比例可能更大。底栖纤毛虫的生产力可通过其增长率和生物量来估算,增长率的估算依据Müller[38]:lnμm=1.52 × lnT- 0.27 × lnV- 1.44,式中μm为纤毛虫的增长率 (d-1),T为温度 (°C),V为纤毛虫的体积 (m3)。由此,估算本航次底栖纤毛虫的平均生产力约为4.2 mg C m-2d-1。若以P= 9B估算小型底栖生物的生产力,则小型底栖生物的平均生产力为1.2 mg C/ m-2d-1。如此,底栖硅藻生物量约为小型底栖生物生物量的1.7倍,而生产力则高达32.5倍;底栖纤毛虫尽管在生物量上远低于小型底栖生物,但其估算的生产力约是后者的3倍;而异养小鞭毛虫由于个体更小,生物量更大,其周转率无疑更高,但目前尚无可靠的公式进行估算。依据经验公式无疑会造成对底栖硅藻、纤毛虫及小型底栖生物生产力估算的偏差,但从一个侧面大致廓出了所研究微型底栖生物在长江口及东海海域沉积物中的巨大资源量和高生产力。微型和小型底栖生物数量上的显著性联系着功能上的重要作用,成为底栖微食物网乃至浅海生态系统能流研究中不可或缺的组成部分。
致谢:中国科学院海洋研究所“科学三号”科考船全体人员及本课题组赵峰和丁军军协助采样,赵峰协助沉积物环境因子测定及部分图表处理,天津科技大学魏浩教授提供CTD数据,特此致谢。
[1] Mare M F. A study of a marine benthic community with special reference to the micro-organisms. Journal of the Marine Biological Association of the United Kingdom, 1942, 25: 517- 554.
[2] HY/T 140—2011 Specifications for the survey of marine microbenthos. Beijing: Standards Press of China, 2011.
[3] Kuipers B R, de Wilde P A W J, Creutzberg F. Energy flow in a tidal flat ecosystem. Marine Ecology Progress Series, 1981, 5: 215- 221.
[4] Epstein S S. Microbial food webs in marine sediments. Ⅰ. Trophic interactions and grazing rates in two tidal flat communities. Microbial Ecology, 1997, 34: 188- 198.
[5] Hamels I, Sabbe K, Muylaert K, Vyverman W. Quantitative importance, composition, and seasonal dynamics of protozoan communities in polyhaline versus freshwater intertidal sediments. Microbial Ecology, 2004, 47: 18- 29.
[6] Dietrich D, Arndt H. Biomass partitioning of benthic microbes in a Baltic inlet: relationships between bacteria, algae, heterotrophic flagellates and ciliates. Marine Biology, 2000, 136: 309- 322.
[7] Shang X, Guan W B, Zhang J. Distribution characteristics and contribution to total primary production of microphotobenthos in the salt marshes of the Changjiang Estuary. Acta Oceanologica Sinica, 2009, 31(5): 40- 47.
[8] Du Y, Xu K, Warren A, Lei Y, Dai R. Benthic ciliate and meiofaunal communities in two contrasting habitats of an intertidal estuarine wetland. Journal of Sea Research, 2012, 70: 50- 63.
[9] Meng Z, Xu K, Lei Y. Community composition, distribution, and contribution of microbenthos in offshore sediments from the Yellow Sea. Continental Shelf Research, 2011, 31: 1437- 1446.
[10] Higgins R P, Thiel H. Introduction to the study of meiofauna, Washington DC: Smithsonian Institution Press, 1988: 488.
[11] Zhang Z N, Li Y G, Tu L H, Yu Z S. Preliminary study on the ecology of the benthic meiofauna in the Huanghe river Estuary and its adjacent waters. Oceanologia et Limnologia Sinica, 1989, 20(3): 197- 208.
[12] Mu F H, Zhang Z N, Guo Y Q. Abundance and biomass of the benthic meiofauna in the Bohai Sea. Journal of Ocean University of Qingdao, 2001, 31(6): 897- 905.
[13] Wang J D, Lei Y L, Xu K D, Du Y F. An investigation on the biomass, abundance and distribution of meiofauna under the cold water mass and its surrounding areas of the Yellow sea. Oceanologia et Limnologia Sinica, 2011, 42(3): 359- 366.
[14] Du Y F, Xu K D, Meng Z C, Wang J D. Spatial distribution of meiofauna in relation to environmental factors in the South China Sea. Oceanologia et Limnologia Sinica, 2010, 41(2): 199- 207.
[15] Zhang Z N, Lin K X, Zhou H, Han J, Wang R Z, Tian S Y. Abundance and biomass of meiobenthos in autumn and spring in the East China Sea and the Yellow Sea. Acta Ecologica Sinica, 2004, 24(5): 997- 1005.
[16] Hua E, Zhang Z N, Zhang Y. Abundance and biomass of meiobenthos in the Changjiang (Yangtze River) estuary and its adjacent waters. Acta Ecologica Sinica, 2005, 25(9): 2234- 2242.
[17] Wang X G, Wang C S, Zhang D S, Hong L S, Yang D. Abundance and biomass of meiofauna in the Changjiang Estuary and its adjacent continental shelf waters in spring, 2007. Acta Ecologica Sinica, 2010, 30(17): 4717- 4727.
[18] Du Y F, Xu K D, Lei Y L. Simultaneous enumeration of diatom, protozoa and meiobenthos from marine sediments using Ludox-QPS method. Chinese Journal of Oceanology and Limnology, 2009, 27: 775- 783.
[19] Xu K, Du Y, Lei Y, Dai R. A practical method of Ludox density gradient centrifugation combined with protargol staining for extracting and estimating ciliates in marine sediments. European Journal of Protistology, 2010, 46: 263- 270.
[20] Lynn D H, Small E B. Phylum Ciliophora // Lee J J, Leedale G F, Bradbury P C, eds. An Illustrated Guide to the Protozoa. Kansas: Society of Protozoologists, 2002: 371- 656.
[21] Song W B, Warren A, Hu X Z. Free-living ciliates in the Bohai and Yellow Seas, China. Beijing: Science press, 2009: 518.
[22] Jin D X, Cheng Z D, Lin J M, Liu S C. Marine benthic diatoms in China (Ⅰ). Beijing: Ocean press, 1985: 323.
[23] Jin D X, Cheng Z D, Liu S C, Ma J X. Marine benthic diatoms in China (Ⅱ). Beijing: Ocean press, 1992: 437.
[24] Nozais C, Perissinotto R, Tita G. Seasonal dynamics of meiofauna in a South African temporarily open/closed estuary (Mdloti Estuary, Indian Ocean). Estuarine, Coastal and Shelf Science, 2005, 62: 325- 338.
[25] Feller R J, Warwick R M. Energetics// Higgins R P, Thiel H, eds. Introduction to the study of meiofauna. London: Smithsonian Institute Press, 1988: 181- 196.
[26] Gao Y H, Yu Q B, Qi Y Z, Zhou J Z, Lu D D, L Y, Cheng C P. Species composition and ecological distribution of planktonic diatoms in the Changjiang River estuary during Spring. Chinese Journal of Applied Ecology, 2003, 14(7): 1044- 1048.
[27] MacIntyre H L, Geider R J, Miller D C. Microphytobenthos: The ecological role of the “secret garden” of unvegetated, shallow-water marine habitats. I. Distribution, abundance and primary production. Estuaries, 1996, 19: 186- 201.
[28] Lei Y, Stumm K, Volkenborn N, Wickham S A, Berninger U. Impact ofArenicolamarina(Polychaeta) on the microbial assemblages and meiobenthos in a marine intertidal flat. Marine Biology, 2010, 157: 1271- 1282.
[29] Lee W J, Patterson D J. Abundance and biomass of heterotrophic flagellates, and factors controlling their abundance and distribution in sediments of Botany Bay. Microbial Ecology, 2002, 43: 467- 481.
[30] Ding J. Community structure and distribution of nano- and microzooplankton in relation to jellyfish occurrence in the Yellow Sea and East China Sea [D]. Beijing: Graduate University of Chinese Academy of Sciences, 2012.
[31] Zhu G H, Chen G T, Yang J Y. Benthic nano- and microalgae on intertidal zone in Nanji Archipalego. Donghai Marine Science, 1994, 12(2): 16- 28.
[32] Montagnes D J S, Franklin, D J. Effect of temperature on diatom volume, growth rate, and carbon and nitrogen content: Reconsidering some paradigms. Limnology and Oceanography, 2001, 46: 2008- 2018.
[33] Matheke G, Horner R. Primary Productivity of the Benthic Microalgae in the Churchi Sea Near Barrow, Alaska. Journal Fisheries Research Board of Canada, 1974, 31(11): 1779- 1786.
[34] Davis M W, David McIntire C. Effects of physical gradients on the production dynamics of sediment-associated algae. Marine Ecology Progress Series, 1983, 13: 103- 114.
[35] Yin H, Sun Y, Shi X Y, Jiang S X, Meng W, Song J Z, Chen Y Z. Biomass and primary productivity of the microphytobenthos on mudflats of the Rushan Bay east flow area. Marine Fisheries Research, 2006, 27(3): 62- 66.
[36] Ning X R, Liu Z L, Cai Y M. Standing crop and productivity of the benthic microflora living on tidal flats of the Xiangshan Bay. Acta Oceanologica Sinica, 1999, 21(3): 98- 105.
[37] Jiao N Z, Wang R, Li C L. Primary production and new production in spring in the East China Sea. Oceanologia et Limnologia Sinica, 1998, 29(2): 135- 140.
[38] Müller H, Geller W. Maximum growth rates of aquatic ciliated protozoa: the dependence on body size and temperature reconsidered. Archiv für Hydrobiologie, 1993, 126: 315- 327.
参考文献:
[2] HY/T 140—2011 海洋微型底栖生物调查规范. 北京: 中国标准出版社, 2011.
[7] 商栩, 管卫兵, 张经. 长江口盐沼湿地底栖微藻的分布特征及其对有机质产出的贡献. 海洋学报, 2009, 31(5): 40- 47.
[11] 张志南, 李永贵, 图立红, 于子山. 黄河口水下三角洲及其邻近水域小型底栖动物的初步研究. 海洋与湖沼, 1989, 20(3): 197- 208.
[12] 慕芳红, 张志南, 郭玉清. 渤海小型底栖生物的丰度和生物量. 青岛海洋大学学报, 2001, 31(6): 897- 905.
[13] 王家栋, 类彦立, 徐奎栋, 杜永芬. 黄海冷水团及周边海域夏初小型底栖动物现存量及空间分布研究. 海洋与湖沼, 2011, 42(3): 359- 366.
[14] 杜永芬, 徐奎栋, 孟昭翠, 王家栋. 南海小型底栖动物生态学的初步研究. 海洋与湖沼, 2010, 41(2): 199- 207.
[15] 张志南, 林岿旋, 周红, 韩洁, 王睿照, 田胜燕. 东、黄海春季小型底栖生物丰度和生物量研究. 生态学报, 2004, 24(5): 997- 1005.
[16] 华尔, 张志南, 张艳. 长江口及邻近海域小型底栖生物丰度和生物量. 生态学报, 2005, 25(9): 2234- 2242.
[17] 王小谷, 王春生, 张东声, 洪丽莎, 杨丹. 长江口及其陆架春季小型底栖生物丰度和生物量. 生态学报, 2010, 30(17): 4717- 4727.
[21] 宋微波, A. 沃伦, 胡晓钟. 中国黄渤海的自由生纤毛虫. 北京: 科学出版社, 2009: 518.
[22] 金德祥, 程兆第, 林均民, 刘师成. 中国海洋底栖硅藻类 (上卷). 北京: 海洋出版社, 1982: 323.
[23] 金德祥, 程兆第, 刘师成. 中国海洋底栖硅藻类 (下卷). 北京: 海洋出版社, 1992: 437.
[26] 高亚辉, 虞秋波, 齐雨藻, 邹景忠, 陆斗定, 李扬, 陈长平. 长江口附近海域春季浮游硅藻的种类组成和生态分布. 应用生态学报, 2003, 14(7): 1044- 1048.
[30] 丁军军. 黄东海微小型浮游动物群落结构与分布及水母发生的影响[D]. 北京: 中国科学院研究生院, 2012.
[31] 朱根海, 陈国通, 杨俊毅. 南麂列岛潮间带的微小型底栖藻类. 东海海洋, 1994, 12(2): 16- 28.
[35] 尹晖, 孙耀, 石晓勇, 姜守轩, 孟伟, 宋建中, 陈永柱. 乳山湾东流区滩涂底栖微藻现存量和初级生产力. 海洋水产研究, 2006, 27(3): 62- 66.
[36] 宁修仁, 刘子琳, 蔡昱明. 象山港潮滩底栖微型藻类现存量和初级生产力. 海洋学报, 1999, 21(3): 98- 105.
[37] 焦念志, 王荣, 李超伦. 东海春季初级生产力与新生产力的研究. 海洋与湖沼, 1998, 29(2): 135- 140.
Ecologicalcharacteristicsofbenthicdiatoms,protozoaandmeiobenthosinthesedimentsoftheChangjiangEstuaryandEastChinaSeainspring
MENG Zhaocui, XU Kuidong*
DepartmentofMarineOrganismTaxonomyandPhylogeny,InstituteofOceanology,ChineseAcademyofSciences,Qingdao266071,China
Using the newly developed Ludox-QPS method, we investigated the community composition, abundance and biomass, and distribution of benthic diatoms, ciliates and heterotrophic microflagellates (HMF) and meiobenthos in combination with the analysis of benthic environmental variables at ten stations in the Changjiang (Yangtze) Estuary and East China Sea in April 2011. The benthic diatoms were dominant both in the abundance (5.92 × 104ind/10 cm2) and biomass (83.29g C/10 cm2), followed by benthic ciliates (abundance: 1036 ind/10 cm2, biomass: 3.33g C/10 cm2) and HMF (4451 ind/10 cm2, 2.51g C/10 cm2). The abundance of meiobenthos in the upper 8 cm of sediments was (1947 ± 849) ind/10 cm2and the biomass was (49.01 ± 22.05)g C/10 cm2. Among the 11 meiobenthos groups identified, nematodes accounted for 90% of the total abundance and 37% of the total biomass. The biomass of benthic diatoms was distinctly higher in the coastal region than that in the offshore area, while the distribution pattern of benthic ciliates, HMF and meiobenthos was exactly opposite. On average 76% of diatoms and 80% of nematodes were distributed in the 0—2 cm sediment layers, while the respective proportions were only 1% and 6% in the 5—8 cm layers. Statistical analyses showed that the standing crops of benthic diatoms had significantly positive correlation with sediment chlorophyll-a contents and weak positive correlation with bottom water temperature, and benthic protozoa and meiobenthos might be structured by the interaction of multiple rather than single environmental variables. Our data indicate that the density of benthic diatoms in the sediments was very high, about two orders magnitude higher per unit volume than that in the water column of the Changjiang Estuary and East China Sea, where a great proportion of sediment chlorophyll a was contributed by benthic diatoms. The benthic ciliate abundance in the upper 8 cm of sediments were 30 times higher and the biomass was 40 times higher than those in the water column of upper 30 m of the Changjiang Estuary and East China Sea. Although the biomass of ciliates was lower than that of meiobenthos, their production was up to 3 times higher than that of meiobenthos. The relative turnover rate of heterotrophic microflagellates might even be much higher due to their small size. The high standing crops and production of benthic protozoa and meiobenthos indicate their important role in the ecosystem structure and function of the Changjiang Estuary and East China Sea.
microbenthos; meiobenthos; standing crops; distribution; changjiang estuary; east China Sea
国家重点基础研究发展计划 (973) 项目 (2011CB403604);中国科学院知识创新工程重要方向项目 (KZCX2-EW-Z-5) ;中国科学院海洋研究所“一三五”专项资助项目(2012IO060104)
2012- 07- 09;
2012- 10- 26
*通讯作者Corresponding author.E-mail: kxu@qdio.ac.cn
10.5846/stxb201207090964
孟昭翠,徐奎栋.长江口及东海春季底栖硅藻、原生动物和小型底栖生物的生态特点.生态学报,2013,33(21):6813- 6824.
Meng Z C, Xu K D.Ecological characteristics of benthic diatoms, protozoa and meiobenthos in the sediments of the Changjiang Estuary and East China Sea in spring.Acta Ecologica Sinica,2013,33(21):6813- 6824.
