棉花不同外植体对卡那霉素敏感性的研究
2013-12-03马玲玲魏延宏朱华国
马玲玲,魏延宏,朱华国,张 薇
(石河子大学农学院新疆兵团绿洲生态农业重点实验室,石河子832003)
随着生物技术的飞速发展,植物遗传转化已经成为应用生物学研究的热门课题之一[1],基因枪介导的转化没有宿主范围的限制,靶受体类型广泛,是除农杆菌介导法之外应用最广泛的一项遗传转化技术[2,3]。在转基因植物中广泛使用的标记基因是卡那霉素抗性基因(nptⅡ),该基因编码的新霉素磷酸转移酶(NPT)能使植物产生抗卡那霉素特性[4],卡那霉素通过干扰植物细胞叶绿体及线粒体的蛋白质合成,引起植物绿色器官的黄化,最终导致植物细胞的死亡[5]。它在实验室主要用作区分转基因植物细胞和非转基因植物细胞的标记[6],已报道利用该选择标记基因超过30个属的植物得到了遗传修饰[7],尤其在棉花等双子叶植物上的表现很有效。由于不同植物、不同外植体对卡那霉素的反应不同[8],转化前对不同外植体进行卡那霉素敏感性测定,有助于提高转化时卡那霉素的抗性筛选效率。
目前,人们已对棉花的遗传转化做了较为系统的研究,豇豆、陆地棉下胚轴等材料的卡那霉素敏感性差异有相关报道[9-13],但适用于基因枪介导的转化的卡那霉素敏感性研究报道较少,特别是海岛棉茎尖的卡那霉素敏感性研究还未见报道。本研究以海岛棉茎尖、陆地棉茎尖和胚性愈伤组织为试验材料,研究在基因枪法介导的棉花转化体系中不同浓度的卡那霉素对棉花外植体的影响,确定棉花不同外植体的卡那霉素筛选浓度和筛选时间,为基因枪法介导的棉花遗传转化奠定基础。
1 材料及方法
1.1 材料
新疆自育海岛棉品种新海13号、陆地棉品种新陆早33号和新陆早33号的胚性愈伤组织,由石河子大学农学院作物遗传育种实验室提供。
1.2 方法
1.2.1 相关培养基的配制方法
MSB培养基即MS无机盐+B5维生素;高渗培养基:MSB(0.3 mol/L甘露醇+0.3 mol/L山梨醇);恢复培养基:MSB培养基;茎尖的生芽培养基:MSB(0.5 mg/L 6-BA);胚性愈伤组织的增殖培养基:MSB(0.5 mg/L IBA+0.15 mg/L KT+1.0 g/L谷氨酰胺+0.5 g/L天冬酰胺+1 g/L活性炭)。培养基中加入2.5 g/L Phytagel,调整pH值6.0,高压灭菌后加入卡那霉素溶液,摇匀后分装。
1.2.2 茎尖的获取和培养方法
茎尖材料来自于暗培养箱中培养4 d、光照培养1 d的无菌苗,在超净工作台上无菌切取。切取及放置方法:首先切去微张的2片子叶,然后在距顶端1~1.5 cm的下胚轴处切开,得到长度为1~1.5 cm、含分生组织的茎尖材料。将茎尖进行无菌培养,竖放在培养基中,下端插入培养基0.5 cm左右,在光照培养室中培养。继代方法:切去茎尖下端长有愈伤和褐化的部分,重新竖插到新的培养基上。
1.2.3 棉花不同外植体的卡那霉素敏感性检测
茎尖的生芽培养基设置7个Kana浓度梯度:30、60、90、120、150、180 和 210 mg/L,不含 Kana 的为对照组。观察、记录不同浓度Kana下茎尖上端芽的生长状况和Kana反应时间及茎尖下端愈伤组织生长情况和褐化程度。
胚性愈伤组织(EC)的增殖培养基设置7个Kana浓度梯度:30、45、60、75、90 和 105 mg/L,不含 Kana 的为对照组,每瓶培养基取0.1 g生长状况相近的EC进行培养。观察其生长情况,测定各个阶段胚性愈伤组织的重量。其中,胚性愈伤组织增加的重量=胚性愈伤组织总重量—初始重量。
2 结果与分析
2.1 海岛棉新海13号茎尖再生的卡那霉素敏感性变化
2.1.1 新海13号茎尖上端(芽)在不同卡那霉素浓度中的反应
生长15 d时,茎尖上端萌芽、长出2~3片叶,对照组叶片生长正常;30~210 mg/L的卡那霉素处理,茎尖上端生长缓慢,叶片出现不同程度的萎缩,严重的整个叶片干枯死亡,部分老叶片上中部和叶柄部有褐化斑块、老叶从柄端开始干枯而死(图1)。生长35 d时,30~210 mg/L的处理,随着Kana浓度增加,落叶和干枯现象愈加严重,筛选效果较佳,如表1所示.生长60 d时,90~210 mg/L的处理,茎尖上端的叶片全部脱落。

图1 茎尖上端在含不同Kana浓度培养基中生长15 d的情况Fig 1 The growth situation of the stem tip top in different kanamycin concentrations for 15d
2.1.2 新海13号茎尖下端在不同卡那霉素浓度中的反应
茎尖培养时,在茎尖下端会出现愈伤组织生长及褐化现象,由图2可知:30~90 mg/L的卡那霉素处理,茎尖下端长出愈伤组织,并随Kana浓度的升高逐渐减少,而且切口处褐化死亡严重;120~180 mg/L的处理,愈伤组织几乎不生长,但是褐化程度随Kana浓度的增加而加重。

图2 茎尖下端在含不同Kana浓度培养基中生长15 d的情况Fig 2 Changs for the stem tip bottom in different kanamycin concentrations for 15d
由表1可知,生长35 d时,90~210 mg/L的处理中90%以上的茎尖被严重抑制。120 mg/L的处理,可以排除茎尖下端愈伤组织对茎尖上端的抑制,也可以排除茎尖下端切口处褐化对茎尖上端的影响,也不会影响筛选后茎尖的根诱导。因此,根据被严重抑制的茎尖比例和培养时间,结合下端愈伤组织和褐化的情况,新海13号的Kana敏感性浓度是120 mg/L,35 d即可筛选出抗性茎尖。

表1 生长35 d(继代一次)的新海13号茎尖的生长情况Table 1 The growth situation of stem tips which grew for 35d and subcultured once
2.2 新陆早33号茎尖再生的卡那霉素敏感性变化
2.2.1 新陆早33号茎尖上端(芽)在不同卡那霉素浓度中的反应
生长20 d时,对照组茎尖上端叶片生长正常;30~210 mg/L卡那霉素处理,茎尖上端出现干枯、萎缩和死亡现象。与新海13号相比,反应出现的时间更早,枯萎的程度更重。30 mg/L的处理,75%的茎尖上端的生长被严重抑制;60 mg/L的处理,大部份茎尖上端的生长被严重抑制;90~210 mg/L的处理,所有的茎尖上端枯萎,浓度越高叶片枯萎现象越严重(图3-a)。
2.2.2 新陆早33号茎尖下端在不同卡那霉素浓度中的反应
与新海13号茎尖相似,新陆早33号茎尖下端也长出愈伤组织,下端切口处出现不同的褐化现象。对照组和30~60 mg/L的处理中,茎尖下端的愈伤组织生长严重并呈递减趋势,与新海13号茎尖相比,新陆早33号茎尖下端的愈伤组织相对较硬且由茎尖内部向外膨胀生长,下端切口处褐化发黑。90~210 mg/L的处理中,茎尖下端没有发育成愈伤组织的现象,切口处的褐化程度随着Kana浓度的升高加重,严重时坏死,如图3-b所示。
由以上现象和表2中的数据可以得出,培养20 d时,新陆早33的茎尖在60 mg/L处理中,大部分茎尖的生长被Kana严重抑制;在90 mg/L处理中,全部茎尖的生长都严重被抑制。60 mg/L处理中茎尖下端愈伤生长严重,抑制了茎尖上端的生长,在筛选后会影响抗性茎尖的生根,因此90 mg/L的处理更合适。相比新海13号茎尖,新陆早33号下端的愈伤组织生长更快,褐化更早、更严重;同时,新陆早33号茎尖的Kana敏感性高于新海13号茎尖。

图3 茎尖上端(a)和茎尖下端(b)在含不同Kana浓度培养基中生长20 d的情况Fig 3 The growth situation of the stem tip top(a)and the stem tip bottom(b)for 20d in different kanamycin concentrations

表2 生长20 d(继代一次)的新陆早33号茎尖的生长情况Table 2 The growth situation of stem tips which grew for 20d and sub-cultured once
2.3 新陆早33号胚性愈伤组织再生的卡那霉素敏感性变化
不同Kana浓度中,新陆早33号的胚性愈伤组织(EC)表面的颜色会发生明显变化:培养7 d时,60 mg/L的卡那霉素处理,EC表面会出现淡粉色物质,60~105 mg/L的卡那霉素处理,随Kana浓度的增加增多;另外,随着培养时间的延长,60 mg/L的卡那霉素处理,EC的颜色逐渐变深(如图4 a→d);培养14 d左右时,颜色开始逐渐变为褐色至黑色;培养28 d时,大部分EC发黑死亡。75 mg/L和90 mg/L的卡那霉素处理,在培养7 d时褐化严重,胚性愈伤组织几乎不生长。

图4 新陆早33号EC在含60 mg/LKana的培养基中颜色的变化Fig 4 The color changes of EC along with the growth in the medium containing 60 mg/L kanamycin
胚性愈伤组织(EC)生长4周时,30~45 mg/L的处理中Kana对EC的抑制作用较小,60~105 mg/L的处理中抑制比较明显(见图5);EC生长8周时,EC在含Kana的处理中几乎不生长(见图6)。在处理6周以后,观察到在被 Kana抑制的褐色EC中,60~105 mg/L的处理出现了白色和绿色的胚状体,在含Kana的处理中胚状体并不褐化死亡。
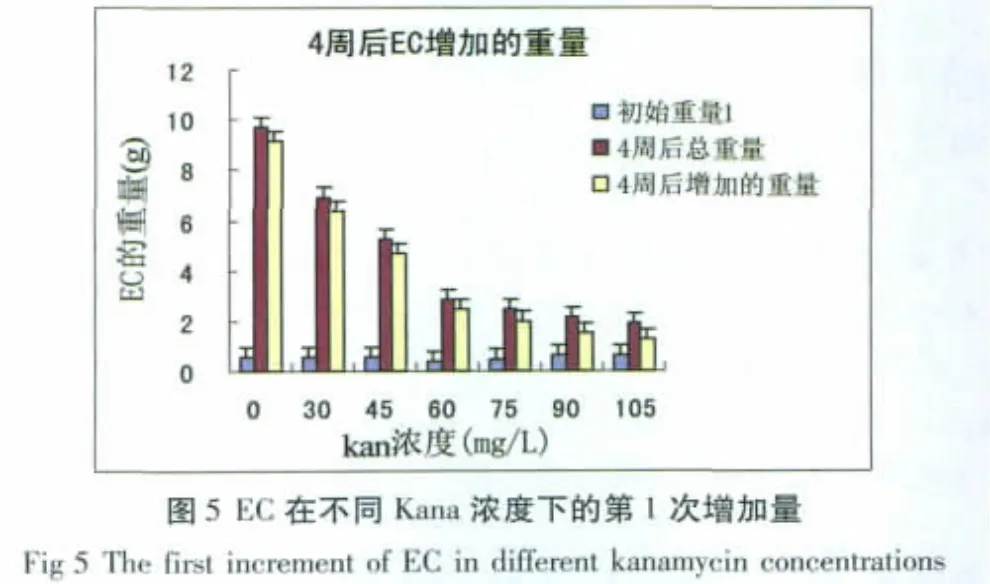

由此可以看出,新陆早33号EC的卡那霉素敏感性浓度是60 mg/L。由于EC数量密集,Kana也不影响EC的分化,筛选过程可以持续至长出胚状体。
3 讨论
3.1 海岛棉新海13号茎尖和新陆早33号茎尖在进行卡那霉素测试时,茎尖下端愈伤组织的生长,影响茎尖上端的营养吸收能力,抑制了茎尖的萌芽能力,干扰Kana筛选的准确度;茎尖下端切口处的褐化程度随Kana浓度的增长加重,高浓度Kana的处理中严重影响茎尖的再生。相对对照组,含有Kana的处理中,茎尖下端的愈伤长势明显较弱,并随Kana浓度的增加而减弱,说明Kana明显抑制外植体愈伤组织的诱导和增殖,张献龙在棉花的相关研究中也曾发现此现象[12]。
本试验结合茎尖愈伤组织的长势、褐化程度和Kana反应程度3个方面,确定在基因枪的转化处理中新陆早33号茎尖Kana筛选浓度为90 mg/L,筛选时间为20 d左右;李俊兰等人研究认为下胚轴的卡那霉素的浓度为100 mg/L[13],可推测同一陆地棉品种的下胚轴和茎尖的卡那霉素敏感性差异不大。在棉花茎尖的转化筛选中,茎尖下端切口处的褐化程度可在培养基中加入活性炭(1 g/L)来缓解。培养基中加入活性炭使茎尖迅速萌动,并吸收外植体切口渗出的酚类物质[14],减轻茎尖下端的褐化程度。
3.2 新陆早33号胚性愈伤组织(EC)进行卡那霉素筛选时,EC的颜色变化很明显,由粉色逐渐加深至褐色、黑色。EC表面的粉色物质是原花色素物质,原花色素在自然界的分布广泛,研究表明它在于油菜籽、葡萄、厚皮香等植物的皮中[15],Kana可能促进了 EC中该物质的产生。关于在Kana处理中出现胚状体这一现象,刘方等人的研究推测一定浓度的Kana影响了新的胚状体的产生;张文胜等人认为,Kana可能与盐胁迫作用相似,低浓度的盐对棉花胚胎发生具有某些促进作用[16]。
[1]刘 方,张宝红,刘志红,等.卡那霉素对棉花愈伤组织诱导和生长的影响[J].河南大学学报,1999,29(3):84-87.
[2]McCabe D E,Martinell B J.Transformation of elite cotton cultivar via particle bombardment of meristems[J].Biotechnology,1993,11(5):596-598.
[3]Finer J J,McMullen M D.Transformation of cotton(Gossypium hirsutum L.)via particle bombardment[J].Plant Cell Reports,1990,8:586-589.
[4]崔百明,封 玲,王爱英.转基因棉PCR与卡那霉素检测的比较[J].石河子大学学报(自然科学版),2000,4(2):103-106.
[5]王紫萱,易自力.卡那霉素在植物转基因中的应用及其抗性基因的生物安全性评价.中国生物工程杂志[J].2003,23(6):9-13.
[6]袁 鹰,刘德璞,王玉民,等.卡那霉素对大豆生长的抑制及筛选试验研究[J].大豆科学,2003,22(4):261-263.
[7]NaPJ Bijwet J P,Stiekema W J,司守钢.转基因植物中的卡那霉素抗性[J].生物技术通报,1998,1:29-31.
[8]张静妮,马晖玲,曹致中.紫花苜蓿不同品种对卡那霉素敏感性分析[J].草原与草坪,2005,5:30-33.
[9]金仁龙,朱 妹,张边江.不同培养条件对苏棉12号茎尖组织培养的影响[J].广东农业科学,2011,3:38-39.
[10]张慧军,石跃进,朱永红,等.棉花转基因工作中利用卡那霉素筛选试管再生株的研究[J].北京农业科学,2001,3:19-20.
[11]孙英坤,代其林,龚元亚,等.棉花遗传转化过程中外植体对卡那霉素敏感性的研究[J].吉林农业,2011.4(254):61-62.
[12]张献龙.抗生素对棉花愈伤组织诱导和生长的影响[J].华中农业大学学报,1996,2:123-126.
[13]李俊兰,张寒霜,高 鹏,等.卡那霉素对棉花下胚轴愈伤组织生长的影响[J].棉花学报,1997,9(4):209-212.
[14]于 娅,刘传亮,马峙英,等.适于基因枪转化的棉花茎尖培养及筛选体系初探[J].棉花学报,2003,15(5):274-278.
[15]张长贵,董加宝,王祯旭.原花色素及其开发应用[J].四川食品和发酵,2006,42(129):8-12.
[16]张文胜,张宝红,李秀兰,等.盐胁迫对棉花胚性愈伤组织增殖、胚胎发生及发育的影响[J].棉花学报,1996,8(4):189-192.
