运动联合紫杉醇对小鼠乳腺癌移植模型荷瘤生长影响的研究
2013-12-03李素萍
李素萍,矫 玮
1.Hanshan Normal University,Chaozhou 521041,China;2.Beijing Sport University,Beijing 100084,China.
乳腺癌严重威胁女性健康,其防治一直是研究的热点。随着医学模式的演变,乳腺癌的治疗观念也在不断更新。为了降低乳腺癌患者的死亡率、提高生存率,并力求维持患者身体的完整性,改善其生存质量,人们一直在努力寻找新的治疗手段。现在,人们逐渐认识到乳腺癌不仅是一种“慢性病”,也是一种“生活方式病”。对于糖尿病、高血压等慢性疾病,运动在其防治中作用突出[11],目前也有研究发现,运动在乳腺癌的预防、临床治疗后的康复中有积极作用[10,14,24]。然而,鉴于癌症的特殊性和复杂性,有关运动对乳腺癌的治疗有何影响,鲜有相关研究。运动可以加速血流速度,以往人们担心运动同样也会加速肿瘤组织的血液供应,使得瘤细胞增殖加快,加上癌症患者本身体能下降,因此,正处在治疗期的乳腺癌患者能否进行运动,学界一直持谨慎态度。如果这些患者可以运动,应该以什么样的方式、强度,以及频率去运动,都是困惑学界的问题。近年,有研究报道,有氧运动可以使乳腺癌组织的微环境“正常化”[16],这启示我们,癌细胞微环境的正常化或许可以影响乳腺癌细胞的生长;运动或许可以作为传统疗法的辅助手段,在乳腺癌的治疗中起一定的作用。
紫杉醇是针对G2晚期、M期的特异性药物,可干扰微管蛋白质的合成,抑制细胞正常有丝分裂的纺锤体形成,将细胞周期阻断在G2和 M期,导致癌细胞的死亡[5]。NF-κB的过度激活不仅能保护恶变细胞免受凋亡,从而促进肿瘤形成,还能促进癌细胞增殖。NF-κB的异常活化是乳腺癌发生、发展的重要病理、生理机制,这也是当前乳腺癌治疗的一个热点。规律的中等强度锻炼能降低与年龄有关的 NF-κB活性和p50、p65亚基的表达[21],运动能否调节乳腺癌细胞NF-κB的活性?能否增强抗癌药物的疗效?本研究通过制备4T1小鼠乳腺癌模型,施予规律的有氧运动、紫杉醇的单独及联合干预,以NF-κBp65、细胞凋亡为观测点,研究运动及其与紫杉醇联合使用在乳腺癌治疗期的作用。
1 材料与方法
1.1 实验动物和细胞株
1.实验动物
SPF级BALB/c小鼠(6~8周龄,雌性),购自北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2006-0009。小鼠饲养在北京市肿瘤防治研究所动物房(屏障环境),许可证号:SYXK(京)2011-0015。小鼠每笼4只群养,自由摄食、饮水,室温22℃~24℃,湿度50%±10%,人工12/12昼夜节律光照。每3天更换一次鼠料及清理饲养笼具。
2.细胞株 :4T1小鼠乳腺癌细胞,购自中国科学院细胞库,按常规贴壁细胞的培养方法培养,收集细胞后,用1640培养液洗涤2次,台盼蓝实验证实细胞活力≥95%,用1640培养液调整活细胞浓度为4×105/ml,备用。
1.2 主要仪器设备
SLY-RTML六道动物跑台、OLYMPUS IX51倒置显微镜、日本AIRTECH超净工作台、HERA cell 150CO2细胞培养箱、BD FACS Calibur流式细胞仪。
1.3 主要试剂
紫杉醇注射液(北京协和药厂)、ANXN V FITC APOPTOSIS DTEC KIT I(美 国 BD 公 司 )、NFκB p65 抗 体(BS1253)和IκB-α抗体(BS3601)(美国 Bioworld公司)、PIκBα抗体(9246)(美国 CST 公司)。
1.4 乳腺癌皮下移植模型的制备
碘伏消毒小鼠接种部位,用1ml注射器吸取4T1细胞悬液0.2ml(含有0.8×105个细胞)接种于小鼠右腋皮下,当肿瘤大小2mm×2mm时,判断为模型建立成功[8]。
1.5 动物分组及干预方案
小鼠购入安静饲养3天后,按体重随机分为正常对照组(N,8只)和模型组(64只)。模型组接种4T1乳腺癌细胞,建立小鼠乳腺癌模型。造模期间,运动干预组以7m/min的速度进行适应性跑步。建模成功后,按体重分为生理盐水组(C)、紫杉醇组(P)、运动组(E)和联合组(EP),共4组,每组16只(实验结束时,随机取8只用于指标测试,其余用于生存期的观察)。各组之间体重没有显著性差异(P>0.05)(表1)。P组和EP组小鼠腹腔内注射紫素(紫杉醇注射液,PACLITAXEL INJECTION,产品批号:110401,无色至淡黄色澄明黏稠的液体,规格为5ml:30 mg,北京协和药厂,批准文号:国药准字 H10980069),剂量为20mg/kg/w[23],C组和 E组小鼠每周按体重腹腔内注射等体积生理盐水。E组和EP组小鼠以17m/min的速度(中 等强度)持 续运动[12],跑台坡 度为0°,运动 30 min/次,5次/周,共5周。在小鼠运动中不进行电刺激。
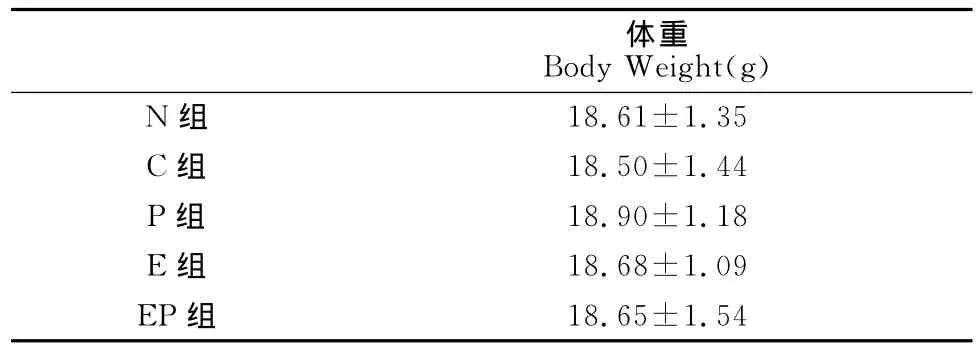
表1 本研究干预前各组小鼠的体重一览表Table 1 Body Weight of Mouse in Different Group before Experiment (X±S)
1.6 测试指标
每周用游标卡尺(精度0.02mm)测量荷瘤的最长径和最宽径各2次,处死小鼠前测量1次最长径和最宽径。按照公式[19]:V=0.52×a×b2(a为荷瘤最长径,b为与a垂直的最宽径)计算荷瘤体积。第5周干预结束后24h,各组随机选取8只小鼠,处死小鼠后剥离瘤体,仔细去除瘤体表面的增生血管、被膜等结缔组织后,称重(g),分为两份,一份制成单细胞悬液,采用Annexin V-FITC/PI复染法对荷瘤组织细胞的早期凋亡和晚期凋亡比例进行检测[7]。其实验原理是,在正常细胞中,磷脂酰丝氨酸(PS)分布在脂质双分子层的内侧。在细胞发生凋亡的早期,细胞膜首先发生翻转,磷脂酰丝氨酸由脂膜内侧翻向外侧,磷脂酰丝氨酸能与AnnexinⅤ发生特异性结合[7]。因此,Annexin V被作为检测细胞早期凋亡的灵敏指标之一,而AnnexinⅤ不能穿过细胞膜,因此,正常细胞不能够被AnnexinⅤ染上颜色。PI为核酸荧光染料,不能透过正常的细胞膜,只能进入已经破损的细胞膜,但在凋亡的中晚期细胞和坏死细胞,PI能够通过细胞膜而使细胞核红染。因此,将Annexin V与PI匹配使用,就可以定量分析凋亡细胞和坏死细胞。
另一份采用Western blotting实验检测荷瘤小鼠荷瘤组织中 NF-κBp65、IκBα和 Phospho-IκBα的表达,具体方法如下:
1.配胶:根据目的蛋白的分子量,配制12%的分离胶,5%的浓缩胶。
2.上样:每孔的上样量为10μl,蛋白量为20μg。
3.电泳:样品通过浓缩胶时恒压90V,约20min;当溴酚蓝进入分离胶后,电压改为160V,通过预染蛋白marker来确定电泳停止时间。
4.转膜:采用湿转法。300mA恒流,使用0.45μm孔径的 NC 膜,转 膜 时 间:IκBα转 膜 30min,P-IκBα转 膜 40 min,NF-κBp65转膜1.5h。转膜完成后,用丽春红S染色液对膜进行染色,观察转膜效果。
5.封闭:将膜完全浸没在3%的BSA-TBST中,室温轻摇1h。
6.一 抗孵育:用3%的 BSA-TBST 稀 释 一 抗,NF-κBp65和IκBα稀释比例为1∶2 000,P-IκBα稀释比例为1∶1 000,GAPDH稀释比例为1∶5 000。室温孵育10min,放4℃过夜。
7.洗膜:第2天从4℃冰箱中拿出膜,在室温孵育30 min。弃去一抗,用TBST洗膜3次,每次10min。
8.二抗孵育:用5%的脱脂奶粉-TBST稀释 HRP标记的二抗,稀释比例为1∶10 000,室温轻摇40min。
9.洗膜:弃去二抗,用TBST洗膜3次,每次10min。
10.显色反应:将ECL加到膜上后反应3~5min,胶片曝光10s~5min(曝光时间随不同光强度而调整),显影2min,定影。用自来水冲洗,去除残留的定影液后,室温晾干。
1.7 统计学处理
数据结果以平均数±标准差(X±S)表示,利用SPSS 13.0软件对数据进行统计分析。采用单因素方差分析,数据齐性用Tukey,不齐时采用Tamhane’s。生存时间采用Kaplan-Meier分析,用Log Rank检验进行两两比较,显著性水平定在0.05和0.01。
2 结果
2.1 不同干预手段对4T1乳腺癌模型小鼠瘤重与瘤体比的影响
EP组的瘤重和瘤体比小于C组的瘤重和瘤体比,有显著性差异(P<0.05),其他各组和C组相比,虽然瘤重和瘤体比都低于C组,但均无显著性差异(P>0.05,表2),提示运动联合紫杉醇有较好的控瘤效果。
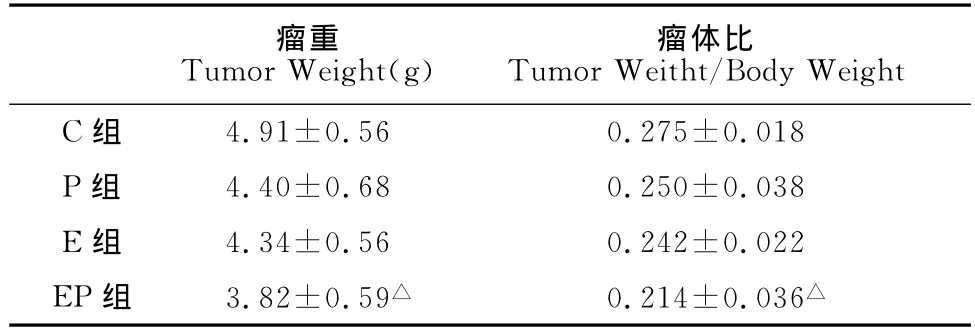
表2 本研究运动、紫杉醇及联合干预对4T1乳腺癌模型小鼠瘤重、瘤体比的影响一览表Table 2 Tumor Weight and Ratio of Tumor Weitht and Body Weight in 4T1Mouse in Different Group (X±S,n=8)
2.2 不同干预手段对4T1乳腺癌模型小鼠荷瘤体积的影响
在第1周开始干预前,各组小鼠荷瘤体积无明显差异(P>0.05),符合实验要求(图1)。在前2周,各组荷瘤体积增长缓慢。2周后,小鼠的荷瘤体积迅速增长,到实验结束时,C组小鼠荷瘤体积最大,和C组相比,EP组的荷瘤体积缩小,差异显著(P<0.05,表3),提示运动联合紫杉醇对荷瘤的增长有一定的抑制作用。
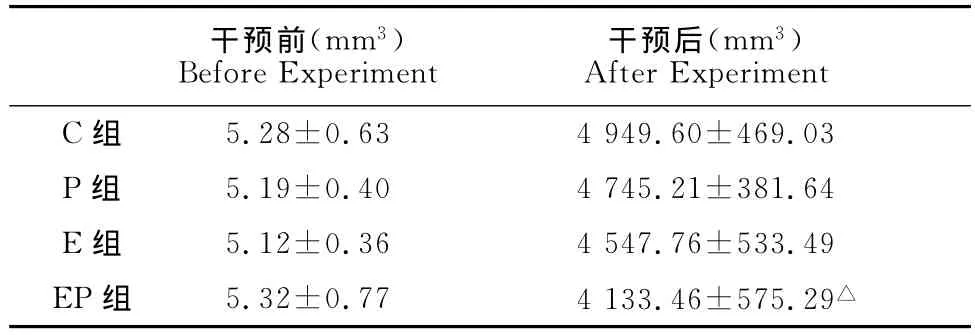
表3 本研究运动、紫杉醇及联合干预对4T1乳腺癌模型小鼠荷瘤体积的影响一览表Table 3 Changes of Tumor Volume in 4T1Mouse in Different Group (X±S,n=8)
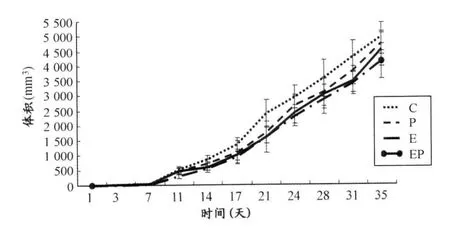
图1 本研究运动、紫杉醇及联合干预对4T1乳腺癌模型小鼠荷瘤体积的影响示意图Figure 1. Comparison of Tumor Volume of 4T1Mouse in Different Group
2.3 不同干预手段对4T1乳腺癌模型小鼠生存时间的影响
P组和C组相比,中位生存时间的差异具有显著性(P<0.05),说明紫杉醇可以延长荷瘤小鼠的存活时间(表4、图2)。E组、EP组和C组相比,差异非常显著(P<0.01),说明荷瘤小鼠以17m/min的速度运动,能延长其存活时间。EP组与P组和E组相比,其延长生存时间的差异也非常显著(P<0.01),提示中强度运动联合紫杉醇对延长荷瘤小鼠的存活时间有较好的效果。
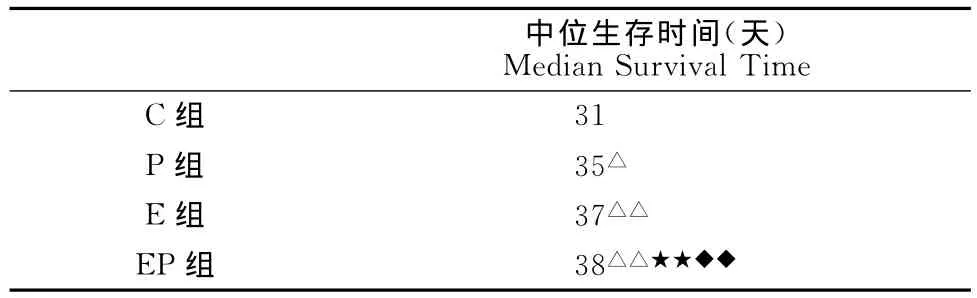
表4 本研究运动、紫杉醇及联合干预对4T1乳腺癌模型小鼠中位生存时间的影响一览表Table 4 The Median Survival Time in 4T1Mouse in Different Group (n=8)
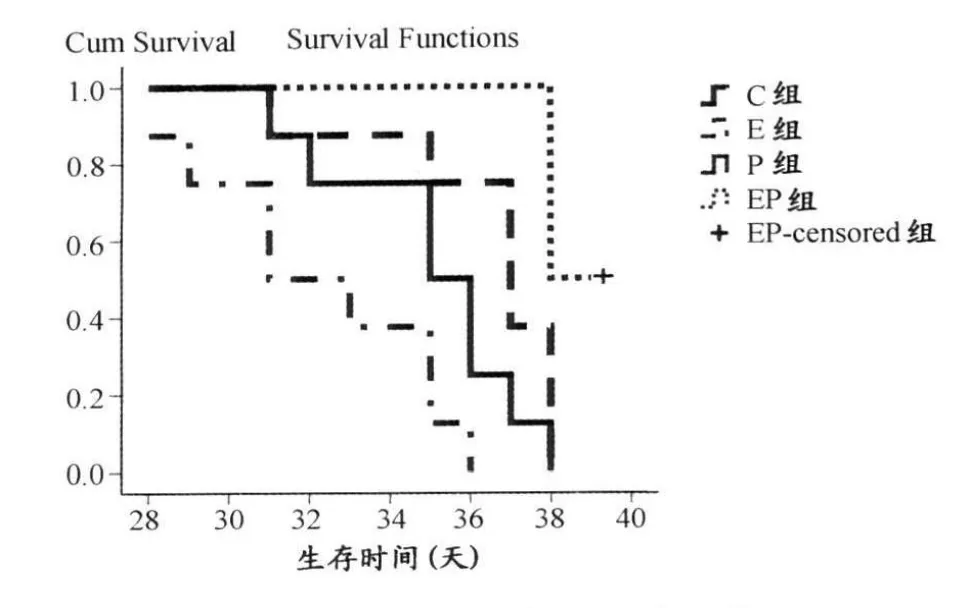
图2 本研究不同干预手段下的乳腺癌小鼠的生存曲线示意图Figure 2. Comparison of Survival Time of Mouse in Different Group
2.4 不同干预手段对4T1乳腺癌模型小鼠荷瘤组织细胞早、晚期凋亡的影响
与C组相比,EP组早期凋亡比例增加,有显著性差异(P<0.05),其他各组间相比,则无显著差异(P>0.05)(表5)。与C组相比,EP组晚期凋亡比例增加非常显著(P<0.01),与P组相比,EP组晚期凋亡比例增加显著(P<0.05),其他各组间相比,无显著差异(P>0.05,图3)。

表5 本研究运动、紫杉醇及联合干预对4T1小鼠荷瘤组织细胞早、晚期凋亡的影响一览表Table 5 Proportion of Early and Late Apoptosis of Tumor Cell in 4T1Mouse in Different Group (X±S,n=8)
2.5 不同干预手段对4T1乳腺癌模型小鼠荷瘤组织NF-κBp65、IκBα和 Phospho-IκBα蛋白光密度值的影响
与C组相比,EP组NF-κBp65的表达下降,差异非常显著(P<0.01),其他各组与C组相比无显著差异(P>0.05,表6)。各组IκBα的表达无显著差异(P>0.05)。与C组和P组相比,E组、EP组的Phospho-IκBα的表达下降,差异非常显著(P<0.01),提示运动对 Phospho-IκBα的表达有一定的下调作用(图4)。
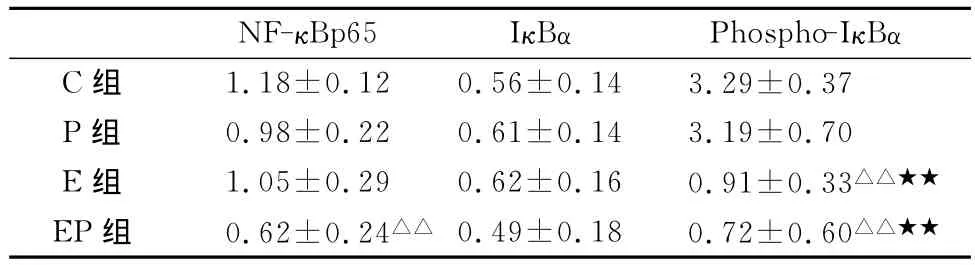
表6 本研究运动、紫杉醇及联合干预对4T1模型小鼠荷瘤组织 NF-κBp65、IκBα和Phospho-IκBα蛋白光密度值的影响一览表Table 6 Optical Density Value of NF-κBp65、IκBα and Phospho-IκBαin 4T1Mouse in Different Group (X±S,n=6①因试剂昂贵,每组测试了最少有效数6只。)
3 讨论
瘤重、瘤体比与荷瘤体积均反映荷瘤生长的情况。有关运动对荷瘤生长影响的相关研究目前较少,Sasvari认为,每天1h的10周规律运动可以减缓S-180肉瘤的生长[22]。从本实验结果看,干预结束时,模型各组小鼠的瘤体平均重4.42g,瘤体最大的在C组,达5.66g;最小的在EP组,为2.88g。各干预组的瘤重、瘤体比均小于C组,但除EP组外,其他各组和C组相比,瘤重和瘤体比降低均无显著性差异。从荷瘤体积来看,各干预组小鼠荷瘤的体积均小于C组,但只有EP组小鼠的荷瘤体积减小差异显著,提示17m/min的中强度运动联合紫杉醇对荷瘤的生长有明显的抑制作用,而运动、紫杉醇的单独干预对荷瘤的生长则没有明显的抑制作用,说明运动可以提高紫杉醇的疗效。中强度运动联合紫杉醇能较好的控制瘤体的增长,这可能与运动改变了紫杉醇在小鼠体内的分布有关[6],运动对紫杉醇在体内的分布产生了有利影响,使得较多的紫杉醇在荷瘤组织中聚集、可以对瘤细胞充分发挥其药效。
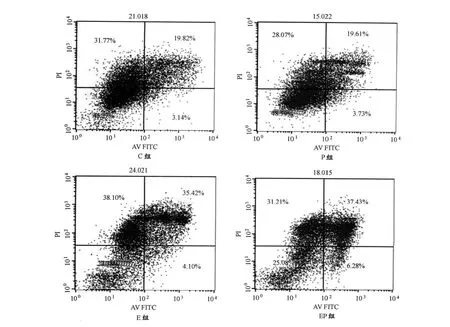
图3 本研究流式细胞仪检测4T1模型小鼠荷瘤组织细胞早、晚期凋亡的比例示意图Figure 3. Comparison of the Proportion of Early and Late Apoptosis of Tumor Cell in 4T1Mouse
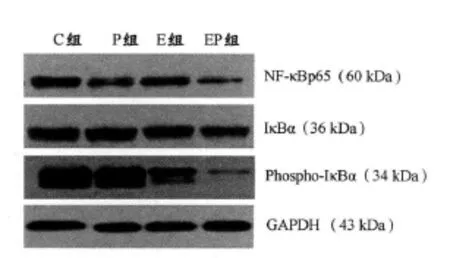
图4 本研究各组小鼠荷瘤组织NF-κBp65、IκBα和Phospho-IκBα的 Western blotting蛋白条带示意图Figure 4. Western Blotting of NF-κBp65,IκBα and Phospho-IκBαin 4T1Mouse
本研究发现,单纯的运动并没有促进荷瘤的增长,提示运动并不会导致瘤细胞快速增殖。结合生存时间看,E组小鼠的生存时间显著长于C组,这提示乳腺癌荷瘤小鼠进行17m/min的中强度运动有助于其“带瘤生存”。
研究表明,无论是单药还是联合用药,紫杉醇治疗乳腺癌都有较好的疗效,紫杉醇单药用于一线治疗晚期乳腺癌的有效率为32%~60%[18]。在本研究中,P组没有表现出很好的控瘤效果,其原因可能是,临床上紫杉醇的使用方法为静滴[5],而对于小鼠,静滴或静脉注射给药比较困难。小鼠尾静脉非常细小,加上紫杉醇在水中的溶解度极小,临床现行使用的紫杉醇注射液多使用聚氧乙烯蓖麻油来增加紫杉醇的水溶性。如果给小鼠进行静脉注射紫杉醇注射液,很容易导致小鼠尾静脉坏死,故本研究采用了腹腔注射的方法,因此,本实验中紫杉醇的药效可能没有最大程度地发挥。
乳腺癌模型动物的生存时间受动物品种、肿瘤细胞系、运动方式、运动强度、运动持续时间、抗癌药物等多种因素的影响。Jones等认为,8周的跑台运动联合多柔比星对乳腺癌裸鼠有影响[15],虽然该实验也是采用的跑台运动,运动强度也和本实验基本一致,但该实验选用的是裸鼠,其结果是只有多柔比星组能够显著提高荷瘤裸鼠的存活时间,而运动组和运动联合多柔比星组均未能显著提高乳腺癌裸鼠的存活时间,与本实验结果不一致。这可能和裸鼠没有免疫力,运动无法提高其自身免疫机能有关。
本研究中的生存时间是从给小鼠接种瘤细胞当天开始,到干预结束时各组小鼠的存活时间。在记录截止时,EP组有4只小鼠仍存活,其他组的小鼠都已死亡。通过Kaplan-Meier分析显示,EP组小鼠的生存率最高,且干预各组与C组相比,其平均生存时间均延长,说明紫杉醇、17 m/min的中强度运动、紫杉醇联合运动均能延长乳腺癌小鼠的存活时间。EP组与P组相比,其延长生存时间的差异非常显著,说明在使用药物的同时结合运动能起到了更好的效果。
Schipper认为,对于癌症,有效的治疗有时并不需要肿瘤的完全消退,机体的反应对癌症治疗最为重要[4]。从本实验结果看,适量运动虽然不能完全消除癌细胞,但是可以提高荷瘤小鼠的存活时间。
研究表明,影响凋亡的因素与肿瘤的发生、发展密切相关。细胞凋亡对肿瘤的生长起负调控作用,肿瘤的生长不仅与细胞增殖速度高有关,还与细胞死亡速率下降有关。在肿瘤细胞的增殖过程中,瘤细胞的凋亡常常被抑制,通过细胞凋亡途径诱导肿瘤细胞死亡,已成为当前肿瘤研究的热点之一。
有关运动与细胞凋亡的研究目前大多集中在运动与骨骼肌细胞、心肌细胞、肝细胞、淋巴细胞的凋亡[2,13,20],运动与肿瘤细胞的凋亡研究较少。本研究发现,单纯的运动和紫杉醇干预对乳腺癌小鼠体内癌细胞的增殖和凋亡作用不显著,这可能与选择的癌细胞恶性程度高有关,而17 m/min的中强度联合紫杉醇可以显著促进癌细胞早期凋亡和晚期凋亡的发生,这可能与17m/min的运动调节了NF-κB的活性有关。
在乳腺肿瘤组织中普遍存在NF-κB激活现象,在乳腺癌的发生、发展及转移中具有重要作用[17]。调控 NF-κB的活性对于抑制肿瘤生长是一种有效的治疗策略。目前,人们试图使用蛋白激酶抑制剂、免疫抑制剂等,从NF-κB激活的关键环节阻断其激活过程,以阻断NF-κB对抗凋亡基因、生长、转移等基因的调控,从而达到抑制甚至消灭肿瘤的目的[1]。由于NF-κB在真核细胞中广泛存在,它在免疫和其他防御应答中同样至关重要,事实上,也不能长时间阻止NF-κB的激活,因为,通过药物对NF-κB进行直接调控有很大的副作用。NF-κB在细胞中广泛存在,使用NF-κB抑制物有可能对正常细胞产生损害,尤其是B、T淋巴细胞[17],因此,寻找能适度调控 NF-κB活性的手段在乳腺癌的治疗中有重要的意义。
运动可以调节NF-κB的活性,但其作用与运动强度、持续时间、运动频率等有关。有研究认为,不管是离心、向心还是平坡运动,急性运动都能激活 NF-κB信号通路[3],而长期有规律的有氧运动会降低NF-κB的活性[21]。本实验发现,17m/min的中强度运动能显著下调 Phospho-IκBα的表达,说明17m/min的中强度运动可以减少IκBα的磷酸化。紫杉醇组NF-κBp65的表达没有明显下调,可能与紫杉醇在导致癌细胞发生周期阻滞的同时,也可能磷酸化Akt有关。活化的Akt可进一步激活NF-κB复合物p50/p65,使p65亚基转位入核,从而使肿瘤细胞对紫杉醇产生耐药性,降低疗效[9]。17m/min的中强度运动联合紫杉醇能显著下调NF-κBp65的表达,并减少IκBα的磷酸化,说明运动干预起到了类似NF-κB抑制剂的作用,有助于紫杉醇更好地发挥疗效。
4 结论
中强度运动联合紫杉醇能抑制乳腺癌模型小鼠荷瘤的生长,延长其生存时间。减少癌细胞IκBα的磷酸化,调节NF-κB的活性,促进瘤细胞的凋亡,可能是运动联合紫杉醇影响小鼠乳腺癌移植模型荷瘤生长的机制之一。
[1]陈庆永.陈道达.核因子-κB与乳腺癌的研究进展[J].国外医学外科学分册,2004,31(3):150-152.
[2]陈伟,樊新生,张廷妍,等.不同强度力竭运动大鼠运动后12h肝细胞凋亡的研究[J].北京体育大学学报,2010,33(2):59-63.
[3]陈艳梅,郝选明.运动训练对核转录因子kappaB信号通路及炎性基因影响的研究进展[J].体育学刊,2011,18(3):140-144.
[4]何裕民.癌症只是慢性病[M].上海:上海科学技术出版社,2008:82.
[5]李少林,任国胜,陈晓品,等.乳腺癌的基础理论和临床实践[M].北京:科学出版社,2008:246.
[6]马智超.运动联合载药纳米粒靶向给药系统应用于肿瘤治疗的探索性研究[D].扬州大学硕士学位论文,2010.
[7]汪谢丹.重组HSP70-4T1肿瘤抗原肽修饰树突状细胞的抗肿瘤作用[D].华中科技大学博士学位论文,2007.
[8]徐林,蒋正刚,李宝华,等.小鼠乳腺癌实验动物模型中CD4+CD25+调节性T细胞的变化及意义[J].复旦学报(医学版),2006,33(6):736-739.
[9]尹荟菁,程联胜.基因工程抗体增强紫杉醇诱导乳腺癌细胞SKBr3凋亡的作用[J].中国免疫学杂志,2007,23(3):229-233.
[10]BERNSTEIN L,PATEL A V,URSIN G,et al.Lifetime recreational exercise activity and breast cancer risk among black women and white women[J].J National Can Ins,2005,97(22):1671-1679.
[11]CHODZKO-ZAJKO W J,PROCTOR D N,FIATARONE SINGH M A,et al.Exercise and Physical Activity for Older Adults[J].Med Sci Sports Exe,2009,41(7):1510-1530.
[12]FERNANDO P,BONEN A,HOFFMAN-GOETZ L.Predicting submaximal oxygen consumption during treadmill running in mice[J].Can J Physiol Pharmacol,1993,71(10-11):854-857.
[13]FRENCH J P,HAMILTON K L,QUINDRY J C,et al.Exercise-induced protection against myocardial apoptosis and necrosis:MnSOD,calcium-handling proteins,and calpain[J].FASEB J,2008,22(8):2862-2871.
[14]GRAF C,PLATEN P.Sport and Breast Cancer—The Value of Physical Activity in the Primary and Secondary Prevention of Mammary Carcinomas[J].Eur J Sport Sci,2002,2(5):1-10.
[15]JONES L W,EVES N D,COURNEYA K S,et al.Effects of Exercise Training on Antitumor Efficacy of Doxorubicin in MDA-MB-231Breast Cancer Xenografts[J].Clin Can Res,2005,11(18):6695-6698.
[16]JONES L W,VIGLIANTI B L,TASHJIAN J A,et al.Effect of aerobic exercise on tumor physiology in an animal model of human breast cancer[J].J Appl Physiol,2010,108(2):343-348.
[17]KARIN M.Nuclear factor-κB in cancer development and progression[J].Nature,2006,441:431-436.
[18]NABHOLTZ J M,GLIGOROV J.The role of taxanes in the treatment of breast cancer[J].Expert Opin Pharmacother,2005,6(7):1073-1094.
[19]NAM J S,TERABE M,KANG M J,et al.Transforming Growth FactorβSubverts the Immune System into Directly Promoting Tumor Growth through Interleukin-17[J].Can Res,2008,68(10):3915-3923.
[20]PHANEUF S,LEEUWENBURGH C.Apoptosis and exercise[J].Med Sci Sports Exe,2001,33(3):393-396.
[21]RADÁK Z,CHUNG H Y,NAITO H,et al.Age-associated increase in oxidative stress and nuclear factorκB activation are attenuated in rat liver by regular exercise[J].FASEB J,2004,18(6):749-750.
[22]SASVARI M,TAYLOR A W,GAAL D,et al.The effect of regular exercise on development of sarcoma tumor and oxidative damage in mice liver[J].J Sports Sci Med,2011,10(1):93-96.
[23]SPARANO J A,WANG M,MARTINO S,et al.Weekly Paclitaxel in the Adjuvant Treatment of Breast Cancer[J].N Eng J Med,2008,358(16):1663-1671.
[24]STERNFELD B,WELTZIEN E,QUESENBERRY C P,et al.Physical activity and risk of recurrence and mortality in breast cancer survivors:findings from the LACE study[J].Can Epide-miol Biomarkers Prev,2009,18(1):87-95.
