妊娠晚期流感病毒感染对后代小鼠肺发育的影响*
2013-12-01周剑芳于在江舒跃龙
张 钰, 韦 红, 周剑芳, 于在江, 舒跃龙△
(1重庆医科大学附属儿童医院新生儿诊治中心,重庆400014;2中国疾病预防控制中心病毒病预防控制所,病毒基因工程国家重点实验室,北京100052)
既往流感大流行[1]以及季节性流感[2]统计资料显示,相对于正常非孕妇女,孕妇感染流感病毒后更易发展为重症病例甚至死亡。孕期感染流感病毒对母亲及发育中的胎儿均可造成负面影响,增加孕妇发生不良妊娠结局的风险性[1]。此外,孕妇感染流感病毒后机体免疫状态与宫内微环境的改变,可损害发育中胎儿的器官结构或功能,目前此方面的研究主要集中在神经系统[3],国内外尚无孕期流感病毒感染对后代肺发育影响的报道。
肺表面活性物质是由肺泡Ⅱ型上皮细胞和无纤毛的支气管与细支气管上皮细胞(Clara细胞)分泌的磷脂类和蛋白质的复杂混合物,具有降低肺泡表面张力、防止呼气末肺萎陷的重要作用[4]。肺表面活性蛋白(surfactant protein,SP)-B、-C在肺表面活性物质吸附于肺泡气-液交界面从而发挥其生理活性的过程中起关键作用,其合成和分泌受发育阶段、激素水平以及环境因素的调节[5]。本研究旨在探讨在肺发育的重要时期母亲流感病毒感染对后代小鼠肺组织形态以及SP-B和SP-C蛋白表达的影响。
材料和方法
1 材料
1.1 动物 孕15 d SPF级BALB/c小鼠,购自北京维通利华实验动物技术有限公司。
1.2 病毒 本研究所用病毒为流感病毒A/四川/SWL1/2009 H1N1(简称 SC/1),血凝滴度为128,病毒 TCID50为10-6.95/mL。该病毒分离自中国内地首例2009甲型H1N1流感病例,由国家流感中心分离保存。为消除孕鼠死亡、流产、死胎、死产、早产等偏倚因素对实验结果的影响,本研究选择非致死量病毒稀释液感染孕鼠。
1.3 药品与主要试剂 小鼠SP-B单克隆抗体(Abcam);兔SP-C多克隆抗体(Santa Cruz);小鼠βactin单克隆抗体(Bioworld);山羊抗兔 IgG抗体(KPL);兔抗小鼠IgG抗体(KPL)。总蛋白提取试剂盒(南京凯基公司);8% ~16%Tris-Gly预制胶(Invitrogen)。
1.4 主要仪器 Olympus BX51显微镜,ChemiDoc XRS图像采集系统(Bio-Rad)。
2 方法
2.1 动物分组与处理 将孕15 d小鼠随机分为对照组和感染组,每组8只。异氟烷轻度麻醉后,予对照组25μL灭菌PBS滴鼻;予感染组25μL SC/1病毒稀释液(稀释至10-3)滴鼻感染。移去分娩后的感染组孕鼠,以正常哺乳期BALB/c小鼠作为代母鼠,防止甲流感染母鼠哺乳对小鼠造成的不良影响。
2.2 标本收集与处理 小鼠出生当天记为P0。分别从各组随机抽取P0、P4、P7和P14小鼠各10只,腹腔注射10% 水合氯醛(0.3 mL/g)麻醉。剖开胸腔,迅速切取右肺,液氮速冻后冻存于-80℃冰箱用于Western blotting检测;取左肺放入多聚甲醛固定液中,制作石蜡切片(厚度约4μm)。
2.3 肺组织形态学观察 每例标本取连续的石蜡切片2张,苏木素-伊红(HE)染色,光镜下观察各组鼠的肺组织病理学改变。每张切片随机取不重叠的5个视野(×200),以10个视野的辐射状肺泡计数(radial alveolar counting,RAC)和肺泡隔厚度的均值作为该例标本的相应指标测定值。RAC测定参照文献[6]。
2.4 检测肺泡Ⅱ型上皮细胞数量 做SP-C的免疫组化染色,阳性细胞即为肺泡Ⅱ型上皮细胞。采用免疫组化SP法。石蜡切片常规脱蜡至水,3%过氧化氢室温封闭内源性过氧化物酶10~15 min,0.01 mol/L pH 6.0枸橼酸缓冲液微波修复抗原,正常山羊血清室温封闭非特异性抗原20~30 min;滴加兔抗小鼠SP-C多克隆抗体(抗体稀释度为1∶100),4℃冰箱孵育过夜,滴加生物素化山羊抗兔IgG室温孵育30 min,滴加过氧化物酶标记的链霉亲和素室温孵育30 min;DAB显色1~2 min;苏木素轻度复染,脱水、透明、中性树胶封片后光镜下观察。以胞浆中出现棕黄色颗粒沉着为阳性表达,以PBS代替Ⅰ抗作为阴性对照。每例标本取2张连续的石蜡切片,光镜下(×400)每张切片随机选取5个视野,应用Image-Pro Plus 6.0图像分析软件进行分析,计数阳性细胞数,最后取10个视野的平均值作为该例标本的肺泡Ⅱ型上皮细胞数量。
2.5 Western blotting检测肺组织SP-B和SP-C 按蛋白提取试剂盒说明书,提取肺组织总蛋白,BCA法蛋白定量。选择β-actin作为内参照;蛋白变性后取10μL待测蛋白按序加样电泳;电泳结束后转膜。TBS液4℃封闭过夜;分别加入Ⅰ抗(小鼠SP-B单克隆抗体,1∶100;兔 SP-C 多克隆抗体,1∶200)37 ℃孵育2 h;分别加入HRP标记的Ⅱ抗(兔抗小鼠IgG抗体,1∶5 000;山羊抗兔 IgG 抗体,1∶5 000)37 ℃孵育1 h。ECL化学发光,ChemiDoc XRS图像采集系统采集图像,采用Quanty One 4.62进行图像分析后作蛋白相对表达量分析。
3 统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS13.0软件包进行统计分析。对照组和感染组间的比较用t检验。以P<0.05为差异有统计学意义。
结 果
1 一般情况
用非致死量流感病毒稀释液滴鼻感染孕鼠后,孕鼠从第2天开始逐渐出现反应迟钝、精神不振、竖毛、弓背及呼吸急促等症状,孕鼠无死亡。无流产、死产或早产。对照组和感染组小鼠出生胎龄分别是(20.50 ±1.08)d和(20.40 ±1.17)d,差异无统计学意义;每窝出生小鼠数分别是5.50±0.85和5.40±0.97,差异无统计学意义。观察期内后代小鼠无死亡,未见唇周发绀、气促、呼吸困难等症状。
2 小鼠体重和肺组织重量的变化
随日龄增加,对照组小鼠体重和肺组织重量逐渐增加。感染组小鼠出生体重明显减轻[(1.24±0.20)g vs(1.66 ±0.23)g],其体重虽随日龄增加呈增加趋势,但P4、P7和P14体重仍较对照组小鼠轻,差异具有统计学意义(P<0.05)。感染组小鼠肺组织重量在各时点均比对照组小鼠稍重,但差异无统计学意义,见表1。
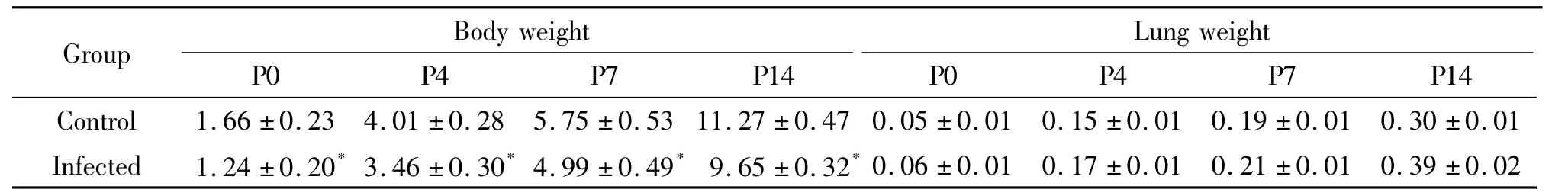
表1 各组小鼠体重和肺组织重量比较Table 1.Body weight and lung weight of the offsprings(g.Mean±SD.n=10)
3 肺组织病理学改变
对照组小鼠随鼠龄增加肺组织发育逐渐成熟,RAC逐渐增多;肺泡间隔厚度逐渐变薄。感染组小鼠肺间质轻度充血、水肿,局灶性肺泡隔增宽,RAC明显减少(P<0.05)。SP-C免疫组化染色计数肺泡Ⅱ型上皮细胞,对照组和感染组之间差异无统计学意义,见图1、2和表2。
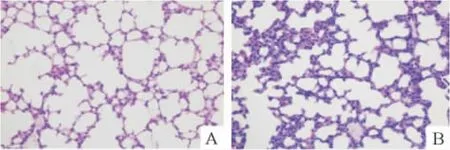
Figure 1.The pathological changes of lung tissues in offspring mice(HE staining, × 200).A:control group,no significant pathological changes;B:infection group,focal alveolar septal widening with pneumocyte hyperplasia and alveolar cell degeneration.图1 各组小鼠肺组织的典型病理学改变
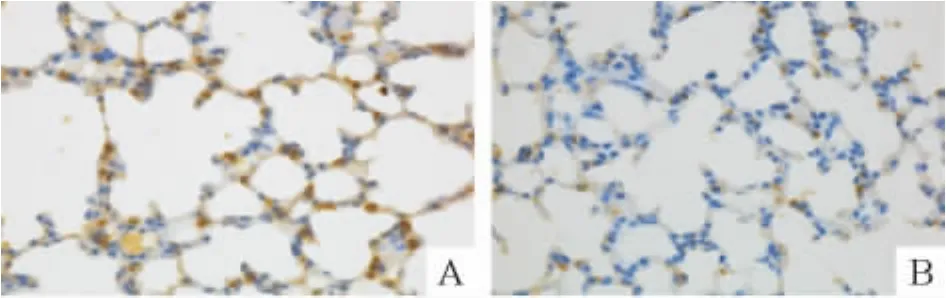
Figure 2.Surfactant protein C immunohistochemical staining of lung tissues in offspring mice(SP,×400).A:control group;B:infection group.图2 各组小鼠肺组织SP-C的免疫组化染色

表2 各组小鼠RAC和肺泡隔厚度比较Table 2.Radial alveolar counting and thickness of alveolar diaphragm in each group(mean±SD.n=10)
4 肺组织SP-B和SP-C蛋白表达的变化
对照组小鼠肺组织SP-B的表达在P0较高,之后呈逐渐降低的趋势;SP-C的表达在P0~P7呈升高趋势,在P7~P14呈下降趋势。与对照组相比,感染组小鼠肺组织SP-B的表达在P0较低,在其它各时点明显升高;SP-C的表达水平在P0较高,但在P4、P7和 P14均明显降低(P <0.05),见图3。
讨 论
母亲孕期感染流感病毒可对发育中的胎儿造成不良影响。本研究结果显示妊娠晚期流感病毒感染可造成胎儿的低出生体重(较对照组减轻约23%~27%),与 Mendez-Fiqueroa等[7]的报道一致。低出生体重是胎儿宫内生长受限的标志,是不良宫内微环境的反映,引起胎儿宫内生长受限最常见的原因是胎盘功能障碍[8]。Fatemi等[9]研究发现孕期流感病毒感染可引起胎盘组织结构和多种基因表达异常,说明母亲孕期感染流感病毒可能造成胎盘功能障碍,不能向发育中的胎儿输送足够的氧气和营养物质,从而影响胎儿生长发育。此外我们研究发现,直至P14感染组小鼠体重仍较对照组轻,提示母亲妊娠晚期感染流感病毒不仅影响胎儿宫内生长发育,而且对其出生后的体格生长仍有深远影响。
导致胎儿体格生长受限的因素也可能同样地对发育中的肺组织结构产生负面影响,从而影响胎儿生后的肺功能[10]。在本研究中,感染组小鼠肺间质充血、水肿;局灶性肺泡隔增厚,这些病理改变可能是小鼠肺组织重量轻度增加的原因;此外感染组小鼠肺泡发育程度较低,评价肺泡发育程度的重要指标RAC在各时点均明显减少,提示孕期流感病毒感染干扰了后代正常的肺发育进程。
肺表面活性蛋白的合成与分泌受肺发育过程中多种复杂因素的调控,是肺发育成熟与否的重要标志之一。本研究发现,随日龄增加,对照组小鼠肺组织SP-B和SP-C的表达呈动态变化,提示二者与肺发育过程密切相关。与对照组相比,感染组小鼠肺组织SP-B的表达在P0降低,而在其它检测时点明显升高,尤以P7升高明显;SP-C的表达在P0升高,但在其它各时点显著降低。感染组小鼠SP-B和SPC在P0的表达模式变化可能是呼吸建立的刺激及适应出生后呼吸功能需要的结果。SP-B表达从P4开始呈增高趋势,而小鼠肺泡化过程从P3开始[11],提示在孕期流感病毒感染造成后代小鼠肺组织结构破坏的情况下,可能通过上调肺组织内和肺发育相关的物质如SP-B,以在肺泡化的关键时期发挥代偿作用,增加肺泡结构的稳定性,维持肺的容积,试图使肺结构或功能恢复正常。这种代偿作用在早期短时间内表现活跃,至P7出现SP-B的表达高峰,之后SP-B表达虽仍较对照组升高,但渐呈下降趋势,说明这种代偿作用是有限的。
SP-C是肺泡Ⅱ型上皮细胞的特异分化标志物,本研究中我们发现母亲孕期流感病毒感染并未影响其后代肺泡Ⅱ型上皮细胞的数量,因此SP-C表达的减少提示生前病毒感染影响了SP-C合成或分泌的环节。研究资料显示SP-C合成与分泌减少可导致肺泡上皮变性、肺间质结构重塑及纤维化等多种肺组织非特异性病理改变[12],与多种儿童呼吸系统疾病密切相关[13]。然而我们在研究过程中未见感染组小鼠死亡,且无气促、呼吸困难等表现,可能是SP-C减少的程度尚不足以引起呼吸功能障碍,也可能是SP-B表达上调对呼吸功能代偿性调节的结果。妊娠晚期流感病毒感染引起的后代小鼠SP-B和SP-C表达模式变化是否会对肺组织结构与功能产生深远影响,以及其具体的影响机制是我们下一步研究的重点。
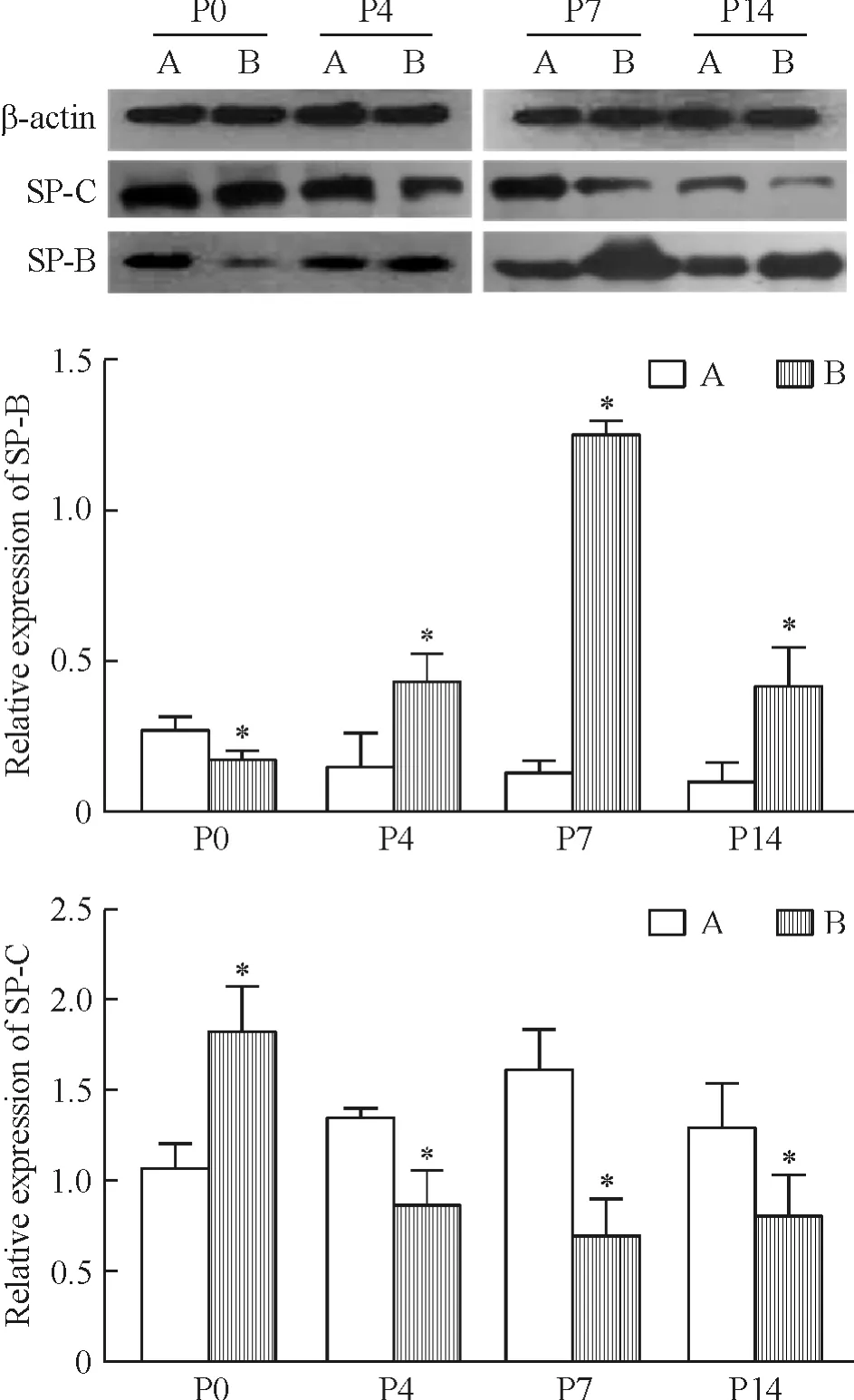
Figure 3.Western blotting analysis of SP-B and SP-Cprotein expression in lung tissues.A:control group;B:infection group.Mean ± SD.n=10.*P <0.05 vs A.图3 肺组织SP-B、-C蛋白相对表达水平分析
