微颗粒与急性冠脉综合征
2013-12-01易铁慈郑乐民李建平
易铁慈, 郑乐民, 李建平△
(1北京大学第一医院心内科,北京100034;2北京大学医学部心血管所,北京100191)
冠心病是目前世界上重要的死亡原因,给社会带来了沉重的负担。近年来,随着老龄化的到来,我国冠心病的发病率和死亡率迅速上升,所带来的社会和经济负担亦将进一步加重。急性冠脉综合征(acute coronary syndrome,ACS)是冠心病的一种较为严重的临床表现形式,具有较高的死亡率。ACS的发生与冠脉内斑块糜烂及破裂、血栓形成、血管痉挛等多因素导致急性或亚急性心肌供氧减少相关。一般认为,应激、炎症等导致血管内皮细胞损伤,引起斑块糜烂、破裂,血栓形成,引发ACS。
微颗粒(microparticle,MP)是细胞活化、凋亡过程中形成的微小颗粒。目前研究表明,MPs与人体多种病理生理过程,如自身免疫疾病、炎症、肿瘤、血栓性疾病等均相关。近年的研究发现,MPs参与了斑块的形成及破裂、凝血的启动以及血栓的形成,是冠心病,特别是ACS过程中的重要参与者,丰富了人类对冠心病发病机制的认识。
1 微颗粒简介
早在1946年研究者就发现,经过高速离心的血浆,其凝血时间比未经超离心的血浆要长,但其原因并不清楚。1967年,Wolf等发现了一些直径0.1~1 μm的具有促凝活性的“血小板灰烬(platelet dust)”,称之为 microparticles。近20余年,内皮细胞、单核细胞、淋巴细胞、红细胞等各种细胞来源的MPs先后被发现,其在斑块形成、血栓形成及炎症、血管功能调节、信号传递等过程中的作用也逐步被揭示。MPs是在细胞活化、凋亡过程中形成的直径约0.1~1μm的细小颗粒,其形成过程涉及细胞骨架的破坏、细胞膜磷脂分布的改变及颗粒形成。静息状态下,细胞膜在多种酶[包括内翻酶(flippase,静息状态激活,保持磷脂酰丝氨酸处于细胞膜内侧)、外翻酶(floppase,静息状态失活)和乱序酶(scramblase,静息状态失活)等]的共同作用下保持着严格的极性:磷脂酰胆碱、鞘磷脂处于细胞膜外层,磷脂酰丝氨酸(phosphatidylserine,PS)及磷脂酰乙醇胺处于细胞膜内层。同时,肌动蛋白、踝蛋白及黏着斑蛋白等构成完整的细胞骨架,协助维持细胞正常形态(图1A)。细胞活化或进入凋亡程序后会引起Ca2+内流,细胞内钙浓度增加,导致酶活性改变(内翻酶失活,外翻酶及乱序酶激活),细胞膜失去内外极性。同时,凝溶胶蛋白和钙蛋白酶等活化,引起肌动蛋白重组,细胞膜骨架破坏(图1B)。在上述细胞膜及细胞浆内多种酶作用下,导致细胞变形、收缩,最终细胞向外形成微小囊泡,即MP[1](图1C)。MPs的形成是一个有序、有选择性的过程,各细胞来源的MPs会带有其母细胞的标志物。比如,血小板来源的MPs(PMPs)携带有CD42b(GP Ib)、CD41a以及 GP IIb/IIIa等;内皮细胞来源的MPs(EMPs)携带有CD105(内皮糖蛋白)、CD144(血管内皮钙黏着蛋白)、CD31(血小板来源生长因子)及CD146等;单核细胞来源的MP(MMPs)可携带有PSGL-1(CD162,P-选择素糖蛋白配体 1)、CD11b及 CD14等。PMPs、MMPs等还常含有组织因子(tissue factor,TF)。利用这些细胞标志物有助于识别MP的细胞来源及其母细胞状态[2-5]。
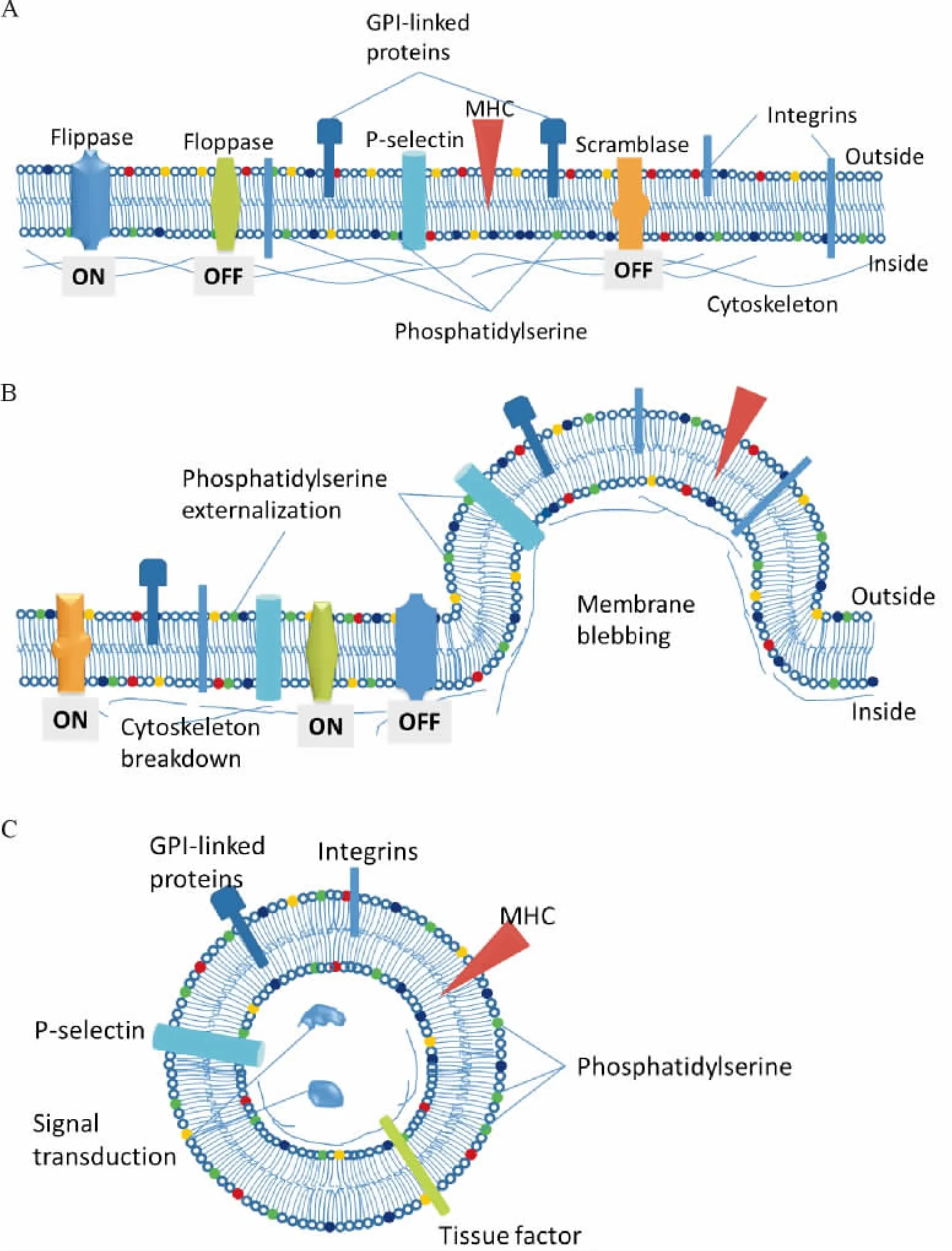
Figure 1.The formation and structure of microparticles.A:the cell membrane at rest,which is A well-structured entity characterized by a controlled transverse distribution of lipids and proteins:flippase activated,floppase and scrambase inactivated;phosphatidylserine mainly distributes at the outside of the membrane.B:when activated,the structure of cell membrane changes:phosphatidylserine is externalized and microparticleis is released.C:the structure of microparticle,which is a disseminated storage pool of bioactive effectors,implicated in a variety of fundamental processes.MHC:major histocompatibility complex;GPI:glycosylphosphatidylinositol.The schematic diagrams were modified according to“Hugel B,Martínez MC,Kunzelmann C,et al.Membrane microparticles:two sides of the coin[J].Physiology(Bethesda),2005,20:22-27”.图1 MPs的形成及结构示意图
循环血液中及斑块中均存在MPs,但其组成却存在较大差异。血液中的MPs以血小板来源的为主,大约占总数(29% ±7%)。其次为红细胞、白细胞来源的MPs。斑块内MPs的浓度为血浆中MPs浓度的200倍以上。斑块中MPs主要来自白细胞,包括巨噬细胞(29% ±5%),淋巴细胞(15% ±3%),粒细胞(8% ±1%),而几乎无血小板来源的MPs。相反,健康血管壁仅含极少量 MPs[6]。
2 MPs与ACS
ACS的产生与内皮细胞损伤、血小板活化聚集、血栓形成等密切相关。
2.1 MPs与内皮细胞损伤 内皮细胞在维持心血管系统健康状态中有非常重要的作用。健康的内皮细胞具有抗炎、抗凝及调节血管张力的作用,而活化或进入凋亡程序的内皮细胞则具有促进局部炎症、促进凝血的作用,导致血管舒张功能障碍,与ACS的发生密切相关。MPs既是内皮细胞活化与凋亡的标志,本身也还参与了促进内皮细胞损伤、活化的过程。
EMPs作为内皮细胞活化和凋亡的标志,再次证明了内皮细胞损伤与ACS关系。研究表明,血浆中CD31+EMP在初发心肌梗死患者中最高,再发心肌梗死及不稳定心绞痛患者次之,在稳定性心绞痛患者仍高于健康对照[7]。循环CD31+/CD42-EMP与STEMI时存在缺血危险的心肌的范围相关[8]。
MPs本身也促进内皮细胞的损伤、活化。斑块MPs能通过向内皮细胞细胞膜直接转移细胞间黏附分子 1(intercellular adhesion molecule 1,ICAM-1),使内皮细胞细胞膜上ICAM-1水平升高,促进单核-内皮细胞黏附。有症状患者的斑块MPs的这种作用更加明显[2]。PMPs还能通过上调内皮细胞环氧化酶2的表达、促进内皮细胞释放白细胞介素6(interleukin 6,IL-6)、IL-8等炎症介质,并直接释放氧自由基,促进内皮细胞的活化、损伤与凋亡[9]。
调节血管张力是内皮细胞的重要功能。MPs能引起内皮细胞一氧化氮合酶(nitric oxide synthase,NOS)下调,使一氧化氮(nitric oxide,NO)合成减少,导致内皮细胞凋亡,也损伤血管舒张功能[10]。CD31+/Annexin V+EMP水平与内皮细胞依赖的血管扩张功能密切相关,是血管功能失调的独立预测因子[11]。内皮祖细胞来源的 MPs(CD34+/KDR+)亦是血管僵硬度的独立预测因子,且独立于Framinghan评分[12]。此外,动物研究表明,PMPs是血栓素A2的来源,参与血管张力调节[13]。
2.2 MPs与斑块不稳定性 易损斑块容易发生斑块破裂和(或)糜烂,引起高促凝活性的脂核暴露,血小板迅速聚集导致血栓形成,导致不同类型的ACS。研究表明,斑块MPs参与了不稳定斑块的形成过程。除了可通过造成内皮细胞功能障碍、内皮细胞凋亡从而影响斑块的稳定性外,斑块内CD40+MPs可以促进内皮细胞增生和斑块内血管新生,增加斑块不稳定性[14]。此外,斑块MPs可促进单核细胞在局部的黏附与迁移[2],还是肿瘤坏死因子α转化酶(TACE/ADAM-17)的载体,TACE能够剪切TNF及其受体(TNFR-1和TNFR-2),促进人脐静脉内皮细胞表达内皮蛋白C受体(endothelial protein C receptor,EPCR)[15],促进局部炎症反应。另外,由血管内皮生长因子(vascular endothelial growth factor,VEGF)或成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)刺激形成的EMPs含有大量的金属蛋白酶亦可以破坏斑块纤维帽[16]。因此,通过多种途径,MPs与斑块不稳定有密切关系。
2.3 MPs与血栓形成 内皮功能受损、斑块出现糜烂或破溃后,局部迅速出现血小板聚集,形成血小板血栓。同时,凝血途径被启动,参与血栓的形成。研究表明,MPs参与了血栓的形成与增长。
2.3.1 MPs与血小板活化 ACS发生过程中存在血小板的活化、聚集。ACS患者循环中的 PMPs(CD31+/CD42b+)在发病第1 d达峰,且与hsCRP水平相关[17]。PMPs水平对ACS患者再发栓塞事件及不良预后有预测意义[18]。同时,斑块内MPs暴露于血液后,可与血液中的血小板相互作用,导致血小板黏附。目前认为,此过程通过多种途径实现:(1)血小板表达P-选择素,与MPs表面的PSGL-1结合,使MPs与血小板黏附,聚集于血栓形成部位;(2)通过MPs表面的PS与血小板表面CD36的相互结合,也引起两者的黏附,导致血栓不断增长;(3)通过CD15与TF实现与血小板的相互作用。既往认为,血小板黏附于血栓形成部位后,通过血小板之间的相互作用使血小板聚集形成血小板性血栓。而目前的研究显示,血小板的进一步聚集还有MPs的参与。在斑块中与循环中的MPs的参与下,血小板被活化,并黏附、聚集,形成血栓。
2.3.2 MPs的磷脂酰丝氨酸与凝血 MPs形成过程中部分PS转移至细胞膜外侧,因此MPs是循环中活性PS重要的携带者。PS是一种带负电荷的磷脂,可以结合凝血相关蛋白带有正电荷的γ-羟基谷氨酸(γ-hydroxyglutamic acid,Gla)结构域,促进各种凝血因子的聚集,提供反应表面,促进凝血。VII因子、IX因子、X因子和凝血酶原均包含Gla域,这些蛋白在PS表面形成多种重要凝血复合物(图2)。事实上,一旦出现磷脂酰胆碱转移至细胞膜外侧障碍,将导致血小板凝血酶原酶活性缺失,导致以出血为表现的 Scott’s综合征。
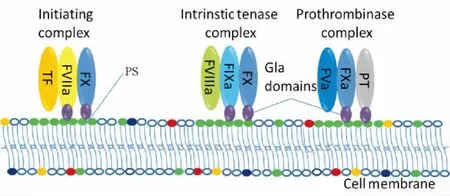
Figure 2.Coagulation complexes assemble on a phosphatidylserine(PS)surface.Anionic phospholipids such as PS(green)bind to the cationic γ-hydroxyglutamic acid(Gla)domains within the coagulation factors(FVIIa,FIXa,FXa,and prothrombin),and facilitate the formation of coagulation complexes(TF:FVIIa,FVIIIa:FIXa,and FVa:FXa).The schematic diagram was modified according to“Owens AP 3rd,Mackman N.Microparticles in hemostasis and thrombosis[J].Circ Res,2011,108(10):1284-1297”.图2 磷脂酰丝氨酸表面形成凝血复合物示意图
2.3.3 MPs的组织因子与血栓形成 TF是凝血因子VII/VIIa的受体,能激活X因子及IX因子,催化凝血反应(图2)。既往认为凝血过程可由血管内皮下TF暴露启动。研究表明,斑块内来源于单核-巨噬细胞、淋巴细胞的MPs可能是血管外TF的来源之一[19](图3A)。斑块脂核中的低密度脂蛋白能促进TF的表达和TF+MP的释放,抑制巨噬细胞对MPs的清除,使含有活性 TF的 MPs在斑块脂核中聚集[20](图3B)斑块糜烂、破裂后,斑块内的 MPs暴露于循环中,释放出大量活性TF,启动凝血通路,(图3C)。
之前认为,TF仅存在于内皮下。关于MP的研究对此说法提出了质疑。研究发现,循环中亦有大量 TF,主要由各种 MPs携带:EMPs、PMPs、MMPs及其它多种白细胞来源MPs均可携带TF。冠心病患者循环MPs存在强促凝活性,而阻断TF作用后,这种促凝活性被显著抑制[21]。静息状态下,机体通过多种途径抑制TF的促凝活性以防止高凝状态:(1)一些细胞(如内皮细胞)只有在活化或凋亡时才高表达TF;(2)静息状态细胞膜结合的TF只存在部分促凝活性,虽可以结合VII/VIIa因子,但无法活化X因子及IX因子;(3)循环中及MPs本身携带的组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)通过Xa因子依赖途径抑制TF/VIIa因子复合物的活性。这些抑制TF活性的过程被称为“TF加密(Tissue factor encryption)”[22]。细胞活化或凋亡过程中暴露的PS可以激活TF,使其促凝活性显著提
高。TF+MP/TFPI+MP此时也迅速上升,导致凝血活动加强。此外,TF二聚体在此时转变为TF单体,其大分子底物结合位点暴露,从而可与IX因子、X因子结合,发挥促凝作用[23]。血栓形成过程被启动之后,MPs上的PSGL-1与活化血小板、内皮细胞的P选择素相互作用,使血小板和MPs相互黏附,导致TF+MPs的聚集,形成局部高浓度的TF。一旦TF达到阈浓度,就可与VII因子形成复合物,启动凝血,促进血栓的继续增长。这是MPs参与纤维性血栓形成的主要途径。
2.3.4 MPs的其它参与凝血途径物质 除了TF之外,MPs还携带其它多种参与血栓形成过程的物质,如选择素、GP IIb/IIIa、花生四烯酸、血栓素A2等。EMPs表达极大 von Willebrand因子多聚体(ultralarge von Willebrand factor multimers,ULvWF),可促进血小板聚集[24]。此外,MPs可与结合的细胞融合,向靶细胞传递其携带的分子、蛋白等。如通过PS及P选择素与PSGL-1的共同作用,MMPs可与血小板融合,将其携带的PS和TF传递至血小板,引起血小板活化,促进凝血过程。这些物质也丰富了MPs参与ACS形成的途径,使MPs的作用更为复杂。
2.4 治疗措施对MPs的影响 近些年在治疗方面的快速进展使ACS的预后得到极大地改善。介入、他汀及ACEI/ARB等治疗手段所带来的获益得到越来越多的肯定,而其机制尚未明确。研究发现,多种处理将使ACS患者的MPs水平发生变化。介入治疗是ACS的重要治疗手段,极大地改善了患者的预后。STEMI患者堵塞血管开通前,其内的白细胞来源的CD11a+MPs及CD105+EMPs显著高于外周血,而血管再通后,2种MPs分别下降30%及42%,降至与外周血管一致的水平。然而,罪犯血管内的TF+MP水平在血管疏通后仍明显高于外周循环,提示冠脉即使在再灌注治疗成功后处于高凝状态[25]。介入治疗本身同时对血管是一种刺激。血管成形术后远端保护装置中收集的冠脉血样本中,能监测到高浓度的TF+MP;PCI术后8 h,循环PMP升高,且冠脉内MPs水平与“无复流”相关[17]。
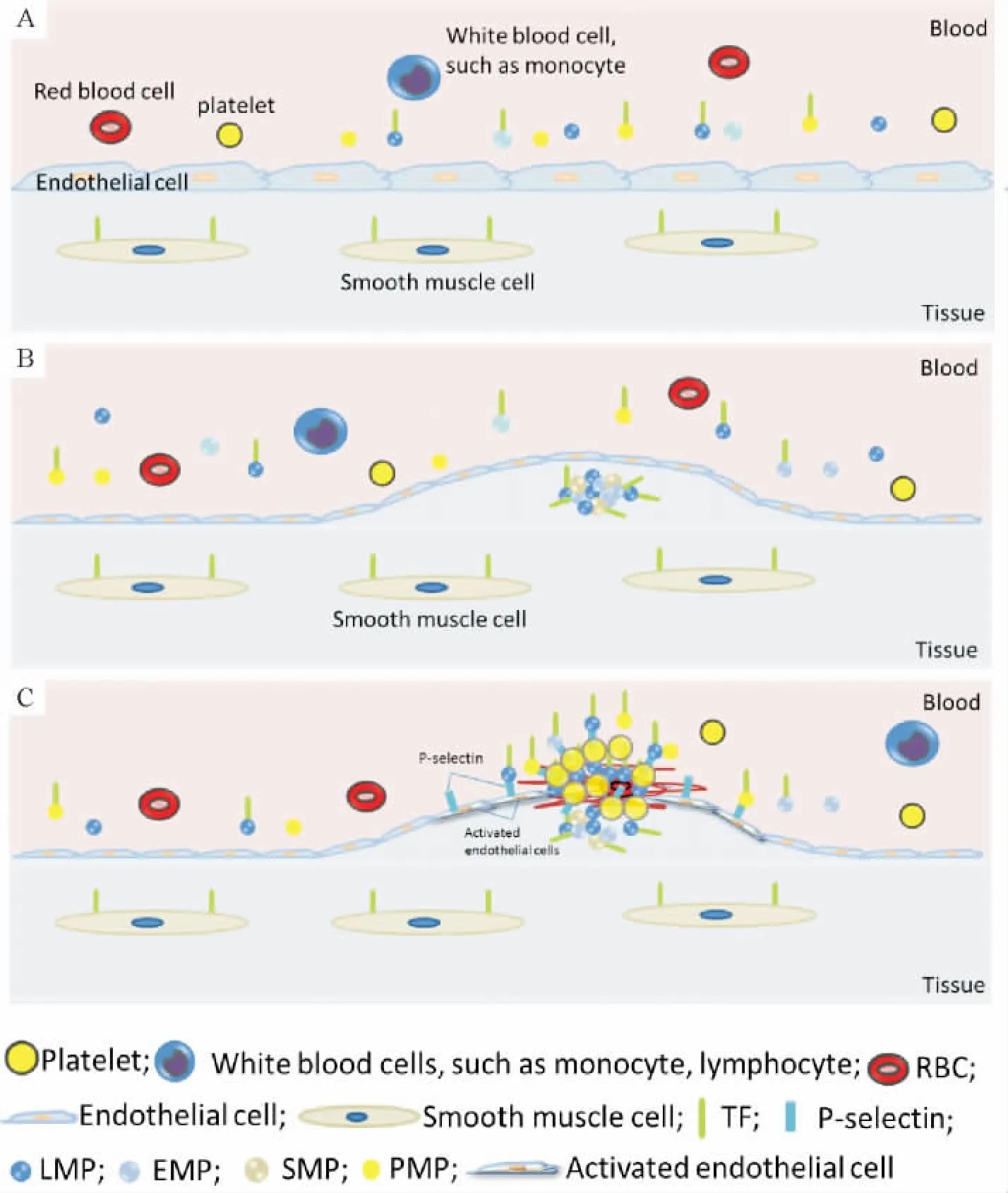
Figure 3.Microparticles,tissue factor and thrombosis.A:MPs at healthy vascular.There is rarely any MPs in the vessel wall,but there are MPs in the circulation.B:MPs aggregate in the atherosclerosis plaque,some of them with TF on their surface.C:formation of thrombus:following stimulation,endothelial cells activated and interact with MPs by P-selectin.The exposure of TF+MPs in the plaque leads to the adherence of platelets and the activation of coagulation pathway.The interaction between platelets and MPs results in the aggregation of both of them,leading to the formation of platelet thrombus,and the amplification of coagulation reaction and formation of more fibrin.The schematic diagrams were modified according to“Owens AP 3rd,Mackman N.Microparticles in hemostasis and thrombosis[J].Circ Res,2011,108(10):1284-1297”.图3 MPs通过与血小板相互作用及携带TF参与血栓形成

表1 MPs的急性冠脉综合征各个阶段的作用Table 1.The contribution of MPs in ACS
他汀、ACEI/ARB均为冠心病的基础治疗,其作用机制比较复杂,尚未得到充分的理解。通过对这些治疗手段对不同MPs水平影响的研究,有助于我们理解它们的作用机制。研究表明,他汀治疗能降低循环中EMPs的水平,这可能是他汀内皮保护作用的表现。合并2型糖尿病的高血压患者中MMPs显著升高,但应用ARB(氯沙坦)能降低MMPs水平,以及趋化因子、黏附因子水平。在ARB基础上加用他汀(辛伐他汀)可进一步降低炎症因子及MMPs的水平,再一次提供了ARB及他汀类药物抗炎作用的证据[26]。抗血小板药物如氯吡格雷合用阿司匹林、阿西单抗、依替巴肽均能抑制PMPs的释放。STEMI患者在PCI基础上应用阿西单抗处理后,以PMP为主的促凝性MP在术后第1天即显著减少,提示炎症反应的LMP则在发病后第6天也开始下降[27]。抗氧化剂[维生素C和二十碳五烯酸(一种不饱和脂肪酸)]、卡维地洛等均可降低循环MPs水平[17]。
3 总结与展望
综上所述,MPs作为各种细胞活化、凋亡过程中的产物,在ACS过程中,既是内皮功能受损、血小板活化等过程的标志,也可能参与了ACS的发生。研究表明,MPs与动脉粥样硬化斑块的损伤、破溃以及凝血与血栓形成的过程均相关。然而,MPs的研究仍有很多值得进一步努力的地方。首先,MPs的研究方法目前没有统一的标准。因为MPs的颗粒极小,目前应用的流式细胞仪很多对其检测并不准确,不同型号的流式细胞仪的监测结果亦不具可比性,使不同实验之间难以进行横向比较,也难以广泛用于临床。其次,MPs来源众多,参与的生理病理过程极其复杂,多数研究局限于相关性研究,而其参与此过程的分子机制尚不明确,需要更多的研究探索。另外,临床应用上,已有研究表明多种基础治疗手段均会对MPs有影响。目前有线索提示,MPs可能成为良好的治疗靶点,但仍需进一步的基础和药理学研究作为支持。比如,由于斑块MPs启动初步的血小板聚集和血栓形成,而循环中MPs是促进血栓进一步增长的重要因素,如能阻断循环中MPs参与血栓形成的过程,则可能达到既能有效防治血栓事件,又不带来出血风险的效果。总之,关于MPs的研究,有望丰富对包括ACS在内的多种疾病的理解,并可能带来治疗这些疾病新的突破口。
