Mas基因沉默对血管紧张素-(1-7)拮抗血管紧张素Ⅱ诱导的大鼠肾间质成纤维细胞活化的影响*
2013-12-01范珊珊贺红焰夏纪毅张奉莲
范珊珊, 贺红焰, 夏纪毅, 陈 枫, 张奉莲, 刘 建△
(泸州医学院附属医院1肾病内科,2病理教研室,3分子与免疫研究室,四川泸州646000)
肾素-血管紧张素系统(renin-angiotensin system,RAS)与肾脏纤维化密切相关。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)作为RAS的主要生物活性肽,主要通过作用于AngⅡ1型受体(AngⅡ type 1 receptor,AT1受体)促进多种致纤维化细胞因子及炎症因子的合成分泌,引起细胞外基质(extra cellular matrix,ECM)生成增多、积聚,参与肾脏纤维化的发生发展[1]。血管紧张素-(1-7)[angiotensin-(1-7),Ang-(1-7)]是近年来研究较多的RAS新成员,具有拮抗AngⅡ、扩血管、调节水钠、抗氧化及抗增殖等作用[2]。我们的前期研究亦证实Ang-(1-7)能够拮抗AngⅡ诱导的大鼠肾间质成纤维细胞活化,减少ECM的合成[3]。近年来,大多数学者认为Ang-(1-7)与G蛋白偶联受体Mas结合发挥主要作用,已有体外研究发现Ang-(1-7)可抑制AngⅡ诱导的大鼠近曲小管细胞的增殖及细胞外基质的分泌,而该作用可被Mas受体拮抗剂D-Ala(7)-Ang-1-7所阻断[4]。但亦有研究显示Ang-(1-7)可能存在其它非Mas受体[5]。目前,对于Ang-(1-7)是否通过与Mas受体结合发挥拮抗AngⅡ诱导肾间质成纤维细胞活化的作用尚无相关报道。本研究将体外培养大鼠肾间质成纤维细胞,观察Mas表达抑制后对Ang-(1-7)拮抗AngⅡ诱导肾间质成纤维细胞活化的影响,了解Mas受体在其中的作用,为临床治疗肾脏纤维化提供进一步的理论依据。
材料和方法
1 材料
大鼠肾间质成纤维细胞株NRK-49F由四川大学华西医学院惠赠;RNA提取试剂盒(北京天根);RTPCR试剂盒(大连宝生物);HiPerFect Transfection Reagent(Qiagen);Mas抗体(Santa Cruz);Ⅰ型胶原(collagenⅠ,ColⅠ)检测 ELISA 试剂盒(R&D);Ang-(1-7)、AngⅡ和抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(Sigma);免疫组织化学试剂盒(北京中杉金桥);siRNA由上海吉玛公司设计合成。Mas siRNA序列 1正义链 5’-CC UGACCAGAGCUUUCAAATT-3’, 反 义 链 5’-UUUGAAAGCUCUGGUCAGGTT-3’;序列 2 正义链 5’-GACCAAUCAAAUAUGACAUTT-3’,反义链 5’-AUGUCAUAUUUGAUUGGUCTT-3’;序列 3 正义链 5’-GCCAUUACUACACAAUCGUTT-3’,反义链 5’-ACG AUUGUGUAGUAAUGGCTT-3’;阴性序列正义链 5’-UUCUCCGAACGUGUCACGUTT-3’,反 义 链 5’-ACGUGACACGUUCGGAGAATT-3’。
2 方法
2.1 细胞培养 复苏NRK-49F,采用含10%胎牛血清和1%双抗的DMEM/F12培养基,置于37℃、5%CO2恒温培养箱中培养。取对数生长期的NRK-49F细胞稀释成1×108/L细胞悬液用于实验。
2.2 有效Mas siRNA的筛选
2.2.1 细胞转染 将细胞接种至6孔板上,实验分组:(1)Mas siRNA-1组:加入含Mas siRNA序列1的转染液;(2)Mas siRNA-2组:加入含siRNA序列2的转染液;(3)Mas siRNA-3组:加入含siRNA序列3的转染液;(4)阴性对照组:加入含siRNA阴性序列的转染液;(5)正常对照组:只加入转染试剂;转染步骤参照HiPerFect Transfection Reagent说明书进行,并对siRNA和转染试剂用量进行优化,每孔加入siRNA 1×10-5mol/L和HiPerFect Transfection Reagent 12μL,每组设3个复孔,转染后48 h检测转染效率。
2.2.2 RT-PCR 检测 Mas mRNA 用 Trizol试剂提取细胞总RNA,以GAPDH作内参照,参照逆转录试剂盒说明书逆转录为cDNA。Mas上游引物5’-GTGGTGAAGATACGGAAGA-3’,下游引物 5’-GCTGCTATTGATGGTGGA-3’,扩增片段长度为 192 bp;GAPDH上游引物 5’-CCTCAAGATTGTCAGCAAT-3’,下游引物 5’-CCATCCACAGTCTTCTGAGT-3’,扩增片段长度为141 bp。将逆转录产物进行PCR,扩增条件:94℃预变性5 min,94℃ 30 s,53℃ 30 s,72℃ 1 min,共30个循环,72℃ 5 min。电泳后,以Mas和内参照电泳条带的吸光度比值作为各组Mas mRNA表达的比较。
2.2.3 Western blotting检测Mas蛋白 加入细胞裂解液裂解细胞,置冰上10 min后4℃ 15 000 r/min离心5 min,收集上清液,即为提取的蛋白。经12%聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后电转移到PVDF膜上,5%脱脂奶粉室温封闭2 h,Ⅰ抗4℃孵育过夜,Ⅱ抗室温孵育1 h。加入化学发光剂显影曝光后,采用 Quantity One 4.4.0软件测灰度值,分析结果。
2.3 有效Mas siRNA对Ang-(1-7)拮抗AngⅡ的影响
2.3.1 实验分组 按不同的干预因素分6组:(1)正常对照组:仅加入含10%胎牛血清的DMEM/F12培养基;(2)AngⅡ组:培养基中加入AngⅡ;(3)Ang-(1-7)组:培养基中加入Ang-(1-7);(4)Ang-(1-7)+AngⅡ组:同时加入 AngⅡ和 Ang-(1-7);(5)阴性siRNA对照组[Ang II+Ang-(1-7)+negative siRNA]:阴性siRNA转染48 h后加入AngⅡ和Ang-(1-7);(6)Mas siRNA转染组[Ang II+Ang-(1-7)+Mas siRNA-2]:Mas siRNA序列2转染48 h后加入 AngⅡ和Ang-(1-7)。上述各组中AngⅡ终浓度均为1×10-6mol/L,Ang-(1-7)的终浓度均为1 ×10-5mol/L。
2.3.2 细胞免疫化学法检测α-SMA 将上述分组加入药物干预72 h后,取出6孔板中细胞爬片,4%多聚甲醛固定10 min,0.1%Triton X-100处理30 min,之后操作按免疫组织化学染色试剂盒说明书要求进行,DAB显色后封片,倒置显微镜下观察阳性信号,照相。
2.3.3 ELISA法检测ColⅠ 将上述分组加入药物干预72 h后,收集细胞上清液,每组设6个复孔,操作按ColⅠ-ELISA试剂盒说明书,于波长450 nm的全光谱分光光度计上读取吸光度,取均数。
3 统计学处理
数据以均数±标准差(mean±SD)表示,使用SPSS 11.5软件进行统计学分析,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 RT-PCR结果
转染后48 h,RT-PCR结果显示,阴性对照组与正常对照组Mas mRNA表达无明显差异(P>0.05);各转染组与正常对照组和阴性对照组相比,Mas mRNA表达均下降,其中以Mas siRNA-2组下降最明显(P <0.05),见图1。
2 Western blotting结果
转染后48 h,Western blotting结果显示,阴性对照组与正常对照组Mas蛋白表达无明显差异(P>0.05);各转染组与正常对照组和阴性对照组相比,Mas蛋白表达均下降,其中以Mas siRNA-2组下降最明显(P <0.05),见图2。
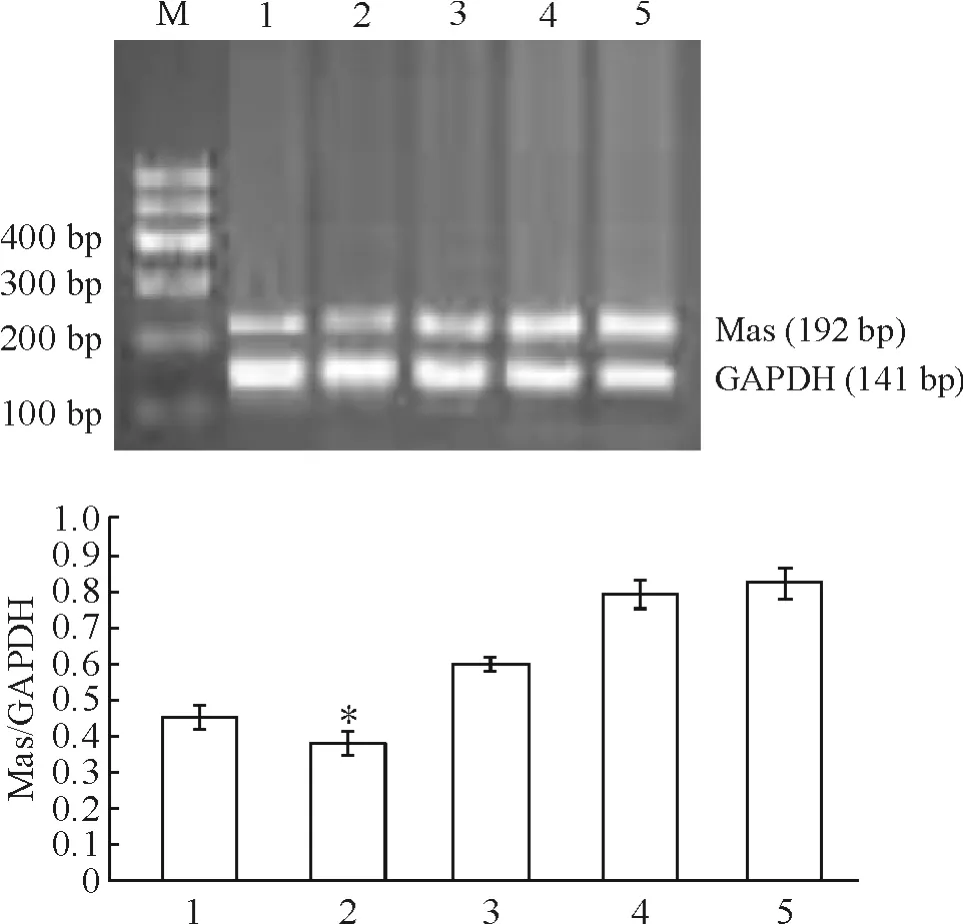
Figure 1.Expression of Mas mRNA in NRK-49F cells measured by RT-PCR.M:DNA marker.1:Mas siRNA-1;2:Mas siRNA-2;3:Mas siRNA-3;4:negative siRNA;5:normal control.Mean ± SD.n=3.*P < 0.05 vs other groups.图1 RT-PCR 检测细胞Mas mRNA的表达
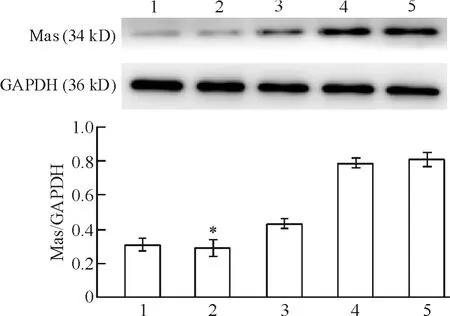
Figure 2.Expression of Mas protein in NRK-49F cells measured by Western blotting.1:Mas siRNA-1;2:Mas siRNA-2;3:Mas siRNA-3;4:negative siRNA;5:normal control.Mean ± SD.n=3.*P <0.05 vs other groups.图2 Western blotting检测细胞Mas蛋白的表达
3 细胞免疫化学结果
干预72 h后,AngⅡ组α-SMA表达增加,而AngⅡ+Ang-(1-7)组与AngⅡ组比较α-SMA表达下降(P<0.05),Ang-(1-7)组与正常对照组仅有少量α-SMA表达。Mas siRNA转染组较AngⅡ+Ang-(1-7)组和阴性 siRNA对照组 α-SMA表达增加(P<0.05),见图 3。
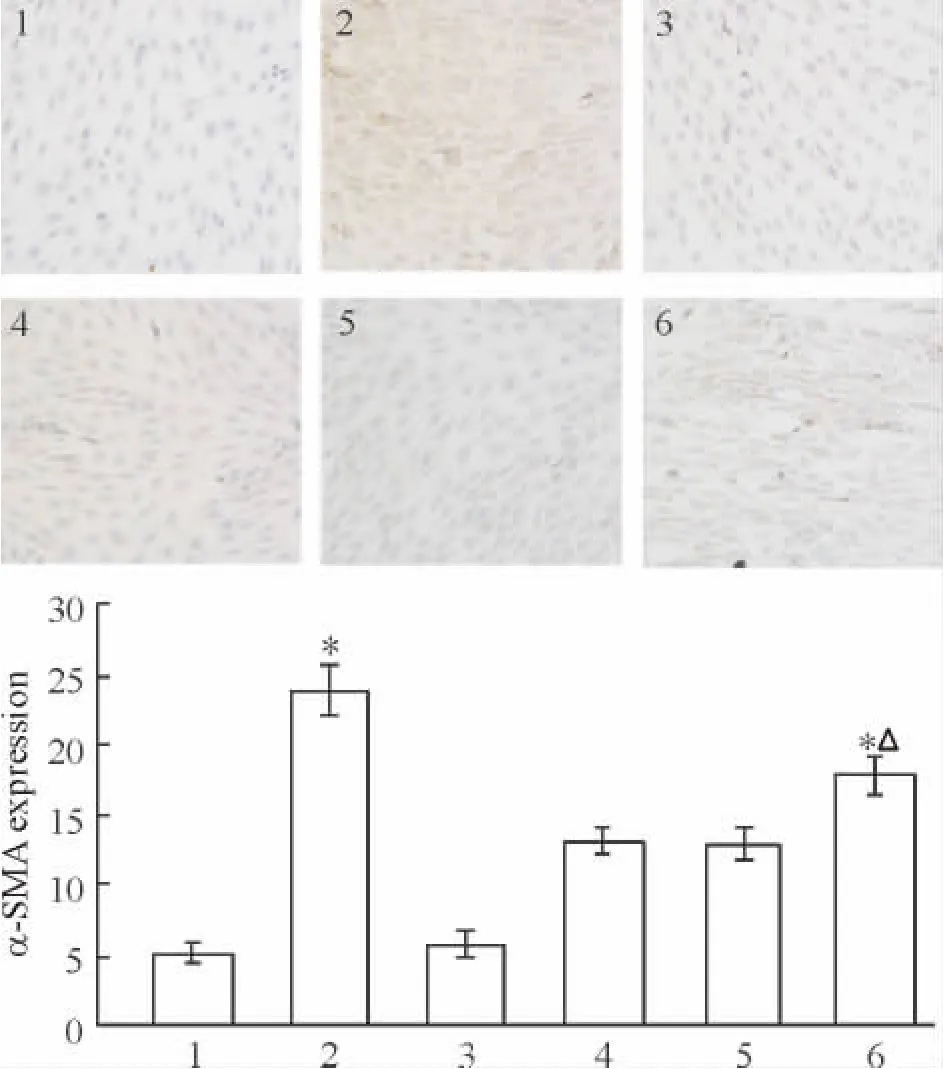
Figure 3.Expression ofα-SMA in NRK-49F cells measured by immunocytochemistry(×400).1:normal control;2:AngⅡ;3:Ang-(1-7);4:AngⅡ +Ang-(1-7);5:Ang II+Ang-(1-7)+negative siRNA;6:Ang II+Ang-(1-7)+Mas siRNA.Mean ± SD.n=3.*P <0.05 vs 1;△P <0.05 vs4 or 5.图3 免疫组化法测各组细胞α-SMA的表达
4 ELISA结果
干预72 h后,上清液中ColⅠ水平在AngⅡ组增加,而AngⅡ+Ang-(1-7)组与AngⅡ组比较ColⅠ水平下降(P<0.05),siRNA转染组ColⅠ含量较AngⅡ+Ang-(1-7)组和阴性siRNA对照组增加(P<0.05),见图4。
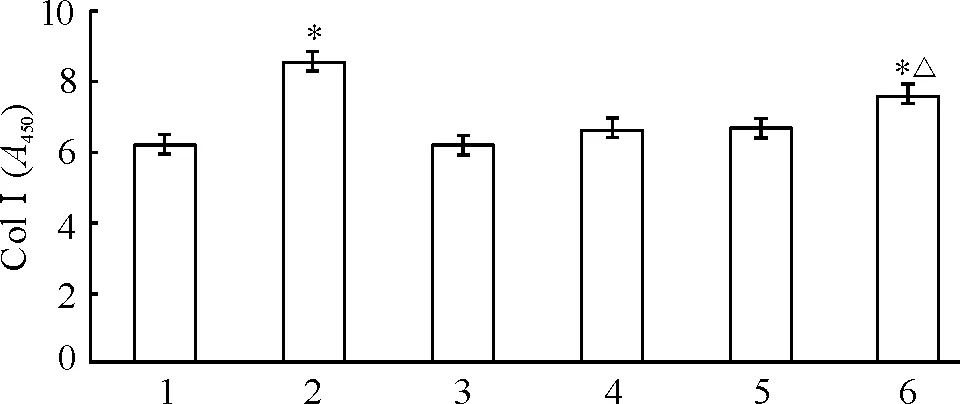
Figure 4.The content of ColⅠ in the culture supernatant.1:normal control;2:AngⅡ;3:Ang-(1-7);4:AngⅡ +Ang-(1-7);5:Ang II+Ang-(1-7)+negative siRNA;6:Ang II+Ang-(1-7)+Mas siRNA.Mean ±SD.n=6.*P <0.05 vs1;△P <0.05 vs 4 or 5.图4 细胞上清液中ColⅠ的含量
讨 论
肾脏纤维化是各种慢性肾脏疾病进展致肾衰竭的主要病理改变和共同通路,而肾间质成纤维细胞被激活转化成肌成纤维细胞,过多的分泌Ⅰ、Ⅲ型胶原及纤连蛋白,导致细胞外基质生成增多并沉积于肾间质是肾间质纤维化的主要特征之一[6-7]。
AngⅡ是一种主要作用于AT1受体的促生长及促纤维化因子。而Ang-(1-7)是RAS中能够拮抗AngⅡ作用的生物活性肽[8-10]。我们前期实验通过体外培养大鼠肾间质成纤维细胞,已经证实Ang-(1-7)可通过下调转化生长因子β1(transforming growth factor beta 1,TGF-β1)、胰岛素样生长因子 I(insulinlike growth factor I,IGF-I)的表达,抑制 AngⅡ引起的肾间质成纤维细胞活化,使α-SMA表达下降,细胞外基质成分ColⅠ的合成减少[3]。但是对于Ang-(1-7)是否通过与Mas受体结合发挥拮抗AngⅡ的上述作用尚待进一步研究。故本实验采用RNA干扰技术,靶向抑制Mas基因表达后,观察Ang-(1-7)拮抗AngⅡ作用的改变。
RNA干扰技术是利用长度约为21个碱基的双链RNA,根据碱基配对原则特异性地降解同源mRNA,抑制相应基因的表达,是一种沉默靶基因的新兴实验方法[11-12]。RNA干扰技术具有快速性,高效性,特异性等优点,目前主要应用于基因功能的研究、临床诊断及基因治疗[13]。因此,实验中我们针对Mas基因序列设计合成3对不同位点的siRNA,采用相对细胞毒性小且转染效率高的转染试剂HiPerFect Transfection Reagent进行细胞转染,发现Mas siRNA序列2对Mas的抑制率达52%。由此可见,该组序列的Mas siRNA能有效抑制Mas表达。
在肾素-血管紧张素系统中,Mas受体是由Mas原癌基因编码的,含有7个疏水跨膜结构域的G蛋白偶联的受体。已发现Mas受体在肾脏、心脏、下丘脑、胰腺和睾丸等器官中均有表达。目前,已有大量研究表明Ang-(1-7)通过与Mas受体结合产生作用,Botelho等[14]分别给Mas基因敲除的小鼠及正常小鼠输注Ang-(1-7)后,发现与正常小鼠相比,Mas基因缺失小鼠心搏量,肾、肺、脾脏血流量均明显减少,说明Ang-(1-7)可通过与Mas受体结合调节全身及局部的血流量。Sampaio等[15]也证实 Ang-(1-7)通过作用于Mas受体激活内皮型一氧化氮合酶,调节血管内皮功能。另外,在大鼠心脏实验中发现Ang-(1-7)通过激活Mas受体呈剂量依赖性地抑制AngⅡ介导的ERK1/2磷酸化,从而改善心功能[16]。同样,动物离体实验中亦发现,在Mas基因缺失的小鼠,Ang-(1-7)对其主动脉的血管舒张作用消失[17]。然而,有研究发现Ang-(1-7)亦可作用于AT1、AT2等非 Mas受体,De Souza等[18]证实 Ang-(1-7)呈剂量依赖性抑制大鼠近端小管Na+/K+-ATP酶活性,AT2受体拮抗剂可消除此作用,故认为Ang-(1-7)通过与AT2受体结合而发挥水钠调节的作用。我们采用siRNA靶向抑制Mas基因的表达,发现当Mas表达下降后,Ang-(1-7)对AngⅡ的拮抗作用明显下降,细胞α-SMA的表达和上清液中ColⅠ的分泌明显升高,与Su等[4]研究结果相似。因此,我们认为Ang-(1-7)主要通过与Mas受体结合,发挥其拮抗AngⅡ对肾间质成纤维细胞的激活作用。
综上所述,Mas受体在Ang-(1-7)拮抗AngⅡ、减缓肾间质纤维化中占有重要的地位,同时也为临床防治肾脏纤维化提供了一条新的途径。
