miRNA-122促进小鼠胚胎干细胞源性肝前体细胞的分化与成熟*
2013-12-01邓小耿邱荣林伍耀豪李治熹曾乐祥周嘉嘉邓洁敏
邓小耿, 邱荣林, 伍耀豪, 李治熹, 曾乐祥, 张 杰, 周嘉嘉, 唐 晶, 邓洁敏
(中山大学孙逸仙纪念医院小儿外科,广东广州510120)
由于具有自我更新、高度增殖和多向分化的能力,胚胎干细胞(embryonic stem cells,ESCs)为多种难治性肝病、代谢性肝病的细胞替代治疗提供了源源不断的种子细胞来源,但是其诱导分化的低效率及致瘤风险一直是难以解决的关键问题[1-2]。微小RNA(microRNA,miRNA)是广泛存在于真核细胞内的转录后基因调节机制,在调控干细胞自我更新与分化、肿瘤发生等方面起着重要作用。miR-122是第一个被鉴定的肝特异性miRNA分子,它在肝脏胚胎发育、肝性维持、肿瘤发生、胆固醇与脂肪酸等多种物质代谢过程中起着关键调节作用[3-4]。然而,如果将miR-122慢病毒载体直接转染未分化的人胚胎干细胞并不能如预期地引起ESCs向内胚层及肝细胞的定向分化[5]。本研究则力求证明miR-122能否促进ESCs来源的肝前体细胞(hepatic precursor cells,HPCs)的分化与成熟。
材料和方法
1 材料
129小鼠 ESCs及ICR小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)均购于 Cyagen。HEK293A细胞及大肠杆菌Stb13均由广州赛业公司提供。小鼠成纤维细胞完全培养基、129小鼠胚胎干细胞完全培养基及拟胚体形成培养基均购于Cyagen。胎牛血清购于 HyClone。白蛋白(albumin,ALB)及细胞角蛋白18(cytokeratin 18,CK18)抗体均购于Abcam。甲胎蛋白(alpha-fetoprotein,AFP)抗体购于Santa Cruz。成纤维细胞生长因子4(fibroblast growth factor 4,FGF-4)及丁酸钠(sodium butyrate)分别购于Chemicon及Sigma。吲哚氰绿(indocyanine green,ICG)亦为Sigma产品。抗小鼠ALB抗体及抗小鼠CK18抗体均购于Abcam;抗小鼠AFP抗体购于Santa Cruz;Cy3标记羊抗鼠 IgG及羊抗兔IgG购于Jackson。DAPI购于中国碧云天公司。
2 细胞培养及胚体的制备
小鼠ESCs复苏前1 d先复苏经γ射线灭活处理的ICR小鼠MEFs至6孔板中,接种密度为1.5×105/cm2。复苏后第2天按照1∶6比例进行传代。选择生长在MEF上状态较好的ESCs克隆消化,充分消化,离心后用拟胚体形成液进行重悬,重悬后首先将细胞接种在直径为10 cm的细胞培养皿中(预先包被0.1%明胶)贴壁培养以去除MEFs,40 min后取出培养皿,轻轻用吸管吸出未贴壁细胞,计数后调整细胞密度为5.5×107/L,然后接种于60 mm细菌培养皿中,每个皿接种5 mL细胞悬液,放置37℃、二氧化碳培养箱中培养,2 d后可见大小不均匀的球形悬浮状胚体,此时大部分胚体较小,胚体透亮,折光性良好,采用离心法(800 r/min离心1 min)或静置3~5 min去除上清换液,换液后接种于新的细菌培养皿中继续培养1~2 d。在接下来的3 d中胚体逐渐增大,个别胚体较大,显微镜下折光性低,低倍镜下胚体中心呈棕黑色,但高倍镜下大部分胚体仍比较透亮紧密。
3 贴壁培养及诱导
胚体悬浮培养3 d后,800 r/min离心1 min或静置3~5 min去除上清,用拟胚体形成液将拟胚体重悬,将其接种于24孔板(预先包被0.1%明胶),每孔拟胚体数量约10~20个(如6孔板则需约50个)。37℃、5%CO2培养箱中培养,每2 d换液,见图1。
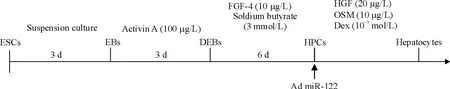
Figure 1.The procedure for differentiation of mouse embryonic stem cells(ESCs)into hepatocytes via embryoid bodies(EBs),defined embryoid bodies(DEBs)and hepatic precursor cells(HPCs)is presented schematically.FGF-4:fibroblast growth factor 4;HGF:hepatocyte growth factor;OSM:oncostatin M:Dex:dexamethasone.图1 细胞分化诱导条件
4 小鼠miR-122重组腺病毒表达载体的构建
根据我们的前期研究,根据目的基因设计出对应的引物序列,利用PCR扩增出基因序列 attB1-miR122与IRES/eGFP-attB2,之后采用重叠PCR技术扩增出基因序列attB1-miR122/IRES/eGFP-attB2。再将attB1-miR122/IRES/eGFP-attB2与入门载体pDonr221通过BP反应形成入门克隆并进行PCR筛选,接着再将包含有目的基因的入门克隆和目的载体pAV.Des1d通过LR反应构建出表达克隆并进行PCR筛选。最终对表达克隆进行测序、包装、扩增和浓缩。
5 腺病毒转染肝前体细胞
EB至肝前体细胞阶段进行到第3天,对诱导细胞进行Ad-GFP及Ad-mir122-GFP转染。吸去旧诱导液,加入新诱导液,以MOI=1∶100,按量加入腺病毒,其中24孔板转染体积为1 mL,6孔板转染体积为2 mL(24孔板细胞量约为105,腺病毒添加量约为10μL,6孔板细胞量约为106,腺病毒添加量约为100μL)。作用24 h后,吸去病毒液,换新诱导液,继续培养,按实验方案定期取样备检。
6 形态学观察
用倒置相差显微镜及电子显微镜动态观察多细胞因子联合诱导及转染miR-122后胚胎干细胞向肝细胞样细胞分化过程中各阶段的细胞形态变化。
7 Real-time RT-PCR
取小鼠成熟肝细胞、ESCs、肝前体细胞、对照组(转染空载体)转染后的第2、4、6天细胞和实验组(转染miR-122)转染后的第2、4、6天细胞分别用Trizol试剂提取总RNA。取2μg总RNA按照试剂盒说明书方法进行real-time RT-PCR。引物如下:GAPDH:5’-TCGTCCGGTAGACAAAATGG-3’,5’-GAGGTCAATGAAGGGGTCGT-3’;ALB:5’-CAGGATTGCAGACAGATAGTC-3’,5’-GCTACGGCACAGTGCTTG-3’;葡萄糖-6-磷酸酶(glucose-6-phosphatase,G-6-P):5’-CAGGACTGGTTCATCCTT-3’,5’-GTTGCTGTAGTAGTCGGT-3’;甲状腺素运载蛋白(transthyretin,TTR):5’-CTCACCACAGATGAGAAG-3’,5’-GGCTGAGTCTCTCAATTC-3’;α1 抗胰蛋白酶(α1-antitrypsin,AAT):5’-AATGGAAGAAGCCATTCGAT-3’,5’-AAGACTGTAGCTGCTGCAGC-3’;细胞角蛋白8(cytokeratin 8,CK8):5’-AGATGAACCGGAACATCAGC-3’,5’-CATCCTTAATGGCCAGCTCT-3’;胆固醇 7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1):5’-TCCAGCGACTTTCTGGAGTT-3’,5’-GATTGCCTTCCAAGCTGACT-3’;细胞色素 P450 3A4(cytochrome P450 3A4,CYP3A4):5’-GAGAAATCTGAG GCGGGAAG-3’,5’-CAAAGGGGTCTTGTGGATTG-3’;引物均由TaKaRa合成。在real-time定量PCR仪上进行PCR反应并实时收集荧光信号,PCR采用三步法热循环扩增,循环参数如下:95℃ 60 s,95℃15 s,60 ℃ 15 s,72 ℃ 30 s,40 个循环。
8 免疫荧光检测
诱导分化后,进行免疫荧光检测。Ⅰ抗抗体稀释度为1∶100(稀释液为0.5%Triton,放置于冰上进行),140μL/well,放置37℃摇床中孵育1 h。Ⅱ抗抗体稀释度为1∶200(稀释液为0.5%Triton,放置于冰上避光进行)。分别加到相应的孔中,140μL/well,操作均需避光进行。37℃、80 r/min摇床孵育1 h(放于保湿盒内)。最后加入Hoechst 33342染液(0.5 mg/L);140 μL/well,室温避光孵育 30 min。PBS洗涤后荧光观察各抗体表达情况。
9 肝细胞功能学检测
9.1 糖原染色 将拟胚体接种至24孔板中,分别对转染空载体及转染miR-122第6天的细胞进行过碘酸-雪夫(periodic acid-Schiff,PAS)染色。吸去诱导液,加入1 mL PBS洗1~2次,加入500μL 4%多聚甲醛室温固定30 min,水洗,晾干。每孔滴加约200μL 1%过碘酸水溶液,氧化10 min,PBS洗2次。每孔加入500μL Schiff糖原染色溶液,置37℃孵箱5 ~10 min,取出后流水冲洗10~20 min,普通显微镜下观察。胞浆内呈红色颗粒为阳性。
9.2 ICG摄取实验 将拟胚体接种至24孔板中,分别对转染空载体及转染miR-122第6天的细胞进行ICG摄取率观察。吸去诱导液,加入1 mL PBS洗1~2次,加入含100 mg/L ICG的肝成熟细胞培养液,继续培养24 h。PBS清洗细胞3次后,加入含10%FBS的DMEM培养液,相差显微镜下观察细胞摄取ICG情况,阳性细胞呈绿色。
9.3 尿素合成实验 按尿素氮检测试剂盒(Sigma)说明书进行比色法操作,步骤如下:设空白、对照、标准、样品管。每管加0.5 mL尿素酶溶液。空白管加10μL水;标准管加10μL尿素氮标准溶液;对照管加10μL。对照培养液;样品管加10μL样品。混匀。37℃水浴5~10 min。各管逐步加入1 mL酚硝酸盐溶液,1 mL碱性次氯酸盐,5 mL纯水,混匀。室温20~30 min成色反应。570 nm紫外分光光度计检测吸光度。尿素氮浓度=样品管吸光度/标准管吸光度×标准样品的浓度。
10 统计学处理
采用SPSS 16.0统计软件进行数据分析,数据用均数±标准差(mean±SD)表示。组间差异比较采用单因素方差分析(One-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 形态学观察
分别于诱导及转染的不同时段采用倒置相差显微镜及电镜进行形态学观察。“巢状”克隆性生长的小鼠ESCs(图2A)经体外悬浮培养2 d后可形成球状悬浮的拟胚体。拟胚体中细胞排列紧密,无法看清单个的细胞,并有一半透明的外膜(图2B)。随着诱导的进行,EB的细胞逐渐由中心向周边铺散开来,诱导3 d后出现小上皮样细胞,圆形为主,胚体中心仍呈片状(图3A);诱导6 d部分细胞呈三角形及不规则多边形(图3B);诱导9 d后,三角形及不规则多边形细胞逐渐增多,说明通过诱导,细胞形态逐渐成熟,ESCs分化为 HPCs(图3C)。转染miR-122后6 d(图4B),细胞形态以多角形或规则多边形为主,核大,胞浆丰富,核仁多见,形态趋于一致,且更接近成熟肝细胞(图4C);而转染空载体6 d后(图4A)细胞虽然也有部分细胞呈规则多边形,但其细胞形态均一性不佳,可见多数的片状或块状幼稚细胞。由此可知,转染miR-122可促进小鼠肝前体细胞的分化与成熟。
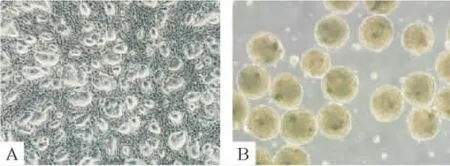
Figure 2.The morphology of mouse ESCs and EBs(×50).A:ESCs appeared“nested”clones after cultured in vitro for 2 d,and the edges appeared sharp and smooth.Cells packed tightly,and the boundary between cells was unclear.B:EBs were transparent with a good refractivity.Cells packed tightly,and there is a semitransparent membrane around EBs.图2 小鼠胚胎干细胞及拟胚体形态
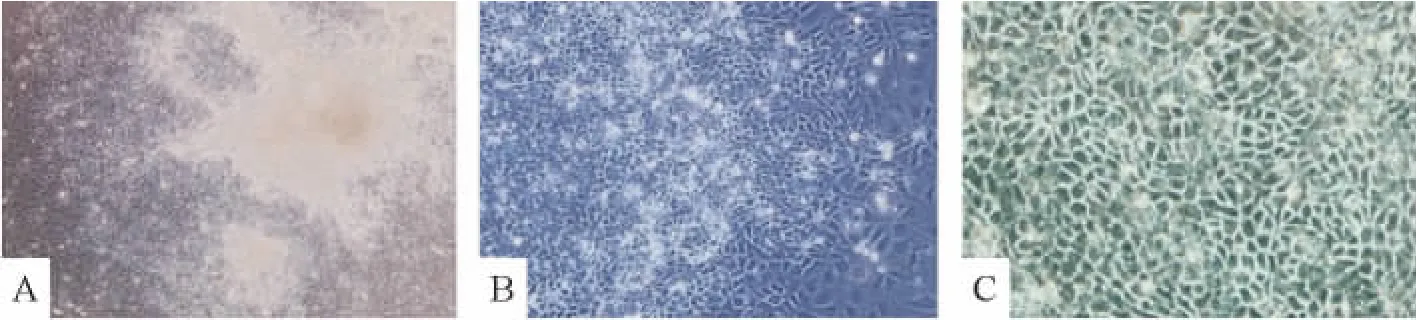
Figure 3.The mouse ESCs were induced into HPCs(×100).A:3 d after induction,cells spread gradually from the center to the periphery of EBs;B:6 d after induction,most cells were round,though a little cells appeared triangle and irregular polygonal;C:9 d after induction,cells mostly appeared triangle and irregular polygonal,similar to HPCs in shape.图3 小鼠胚胎干细胞被诱导为肝前体细胞
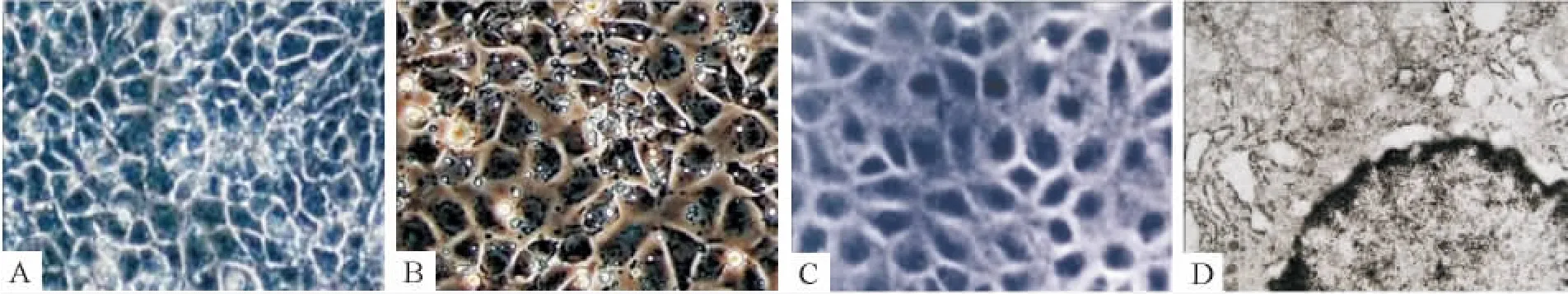
Figure 4.miR-122 induced mouse HPCs into hepatocytes.A:6 d after transfection with empty vector,some cells appeared triangle and regular polygonal while there were still many naive cells(×200);B:6 d after transfection with miR-122,most cells were regular polygonal,with big nuclei,abundant cytoplasm,more nucleoli and unanimous shape(× 200);C:normal mouse hepatocytes were polygonal,with large and round nuclei in the center,and packed closely(× 200);D:6 d after transfection with miR-122,ultrastructural analysis revealed a system of organelles such as mitochondria,lysosomes,Golgi apparatus,rough and smooth endoplasmic reticulum(×8 000).图4 miR-122诱导小鼠肝前体细胞向肝细胞分化
2 肝特异性基因的表达
转染 miR-122 后,细胞的 ALB、TTR、AAT、G-6-P、CK8、CYP7A1及CYP3A4 mRNA的表达水平均逐渐升高,转染后6 d可达成熟肝细胞80%以上。其中以ALB升高最为显著,转染后6 d,ALB mRNA的表达水平接近小鼠成熟肝细胞95%,见图5。以上结果说明,转染miR-122后,小鼠肝前体细胞可高表达肝特异性基因,并接近成熟肝细胞水平,这从mRNA水平上说明miR-122能够促进小鼠肝前体细胞的分化与成熟。
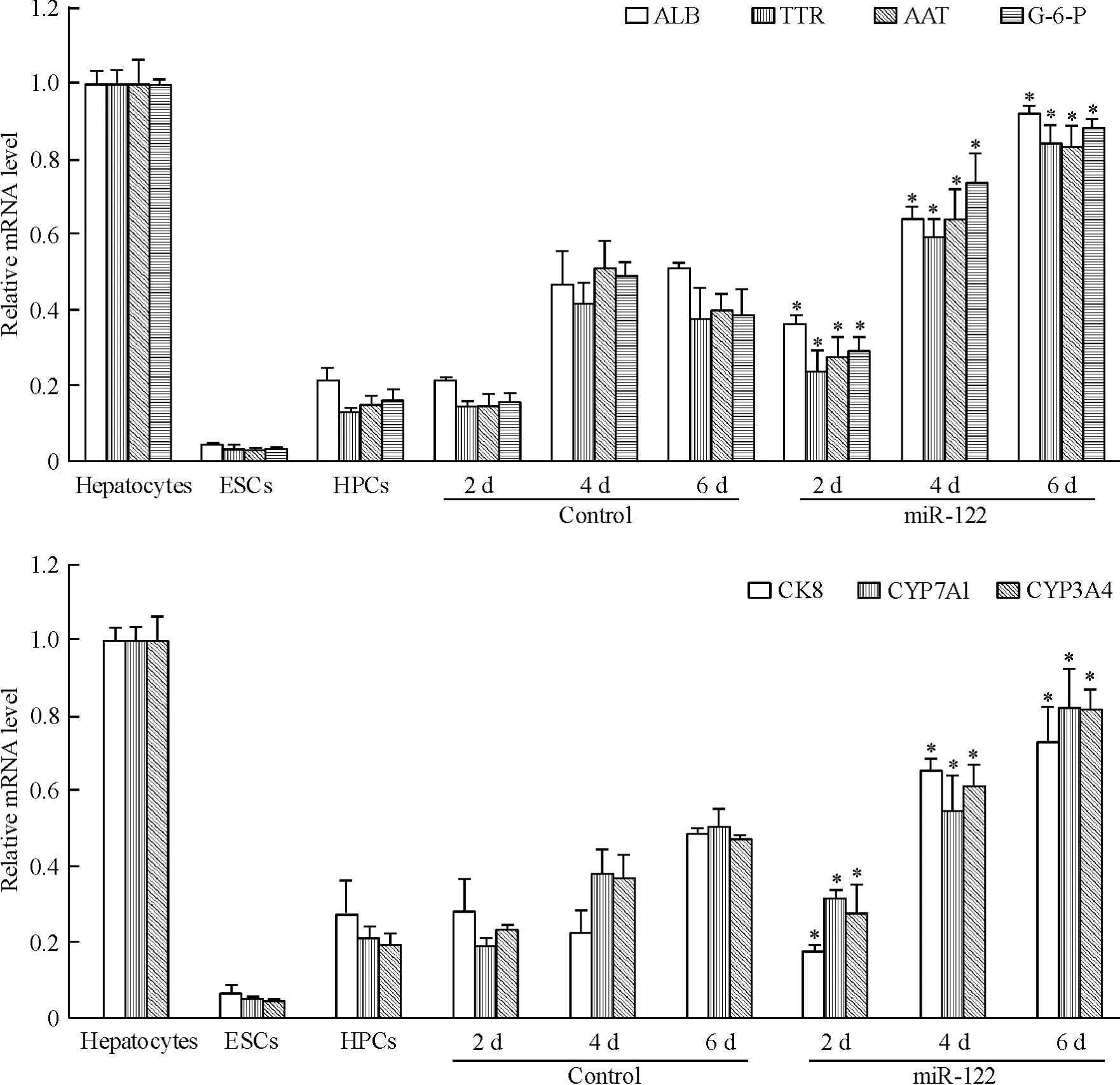
Figure 5.Detection of the mRNA expression levels of hepatocyte-specific genes by real-time RT-PCR.Mean±SD.n=3.*P<0.05 vs control group at the same time point.图5 Real-time RT-PCR检测肝特异性基因的mRNA表达
3 免疫荧光染色检测肝特异性蛋白的表达
采用FGF-4、丁酸钠及Dex联合诱导培养9 d后,细胞形态以圆形为主,不规则多边形细胞少,ALB及CK18含量不高,而AFP含量高(图6A)。对照组转染空载体,转染3 d后细胞呈克隆样增殖,形态同样分化为肝细胞样细胞,见胞浆内出现棕红色AFP、ALB与CK18蛋白,ALB及CK18表达量较单纯诱导组稍有增高,AFP改变不大(图6B)。实验组(miR-122转染3 d后)细胞形态呈现规则多边形,核大,胞浆丰富,形态更接近成熟肝细胞,ALB及CK18的含量相对单纯诱导组和对照组而言均明显升高,而AFP表达量却降低(图6C),接近小鼠成熟肝细胞水平(图6D)。以上结果说明miR-122在蛋白水平能促进肝前体细胞的分化与成熟。
4 肝细胞功能学检测
4.1 ICG摄取实验 对照组为转染空载体6 d的HPC,ICG摄取实验可见淡绿色的ICG阳性细胞(图7A、B),说明经 FGF-4、丁酸钠及 Dex联合诱导9 d的HPCs已经具备部分肝细胞功能。而同期实验组(转染miR-122 6 d的HPCs中ICG阳性细胞数量则更多(图7C、D),说明转染miR-122重组腺病毒表达载体后同时期的细胞具有相对更好的肝细胞功能。
4.2 糖原染色 转染miR-122后6 d,糖原染色可见细胞浆内出现红染的糖原颗粒,表明其糖原合成和储存功能明显增强,见图8。
4.3 尿素合成功能 ESCs基本没有尿素合成功能,随着诱导分化的进行,其尿素合成功能逐渐升高,转染miR-122后升高明显,于转染后6 d接近成熟肝细胞80%的水平,见图9。

Figure 6.Expression of hepatocyte-specific proteins in mouse ESCs after induction and transfection as well as normal mouse hepatocytes(immunofluorescence staining,×200).A:ESCs 9 d after induction(HPCs group);B:HPCs 6 d after transfection with empty vector(control group);C:HPCs 6 d after transfection with miR-122(miR-122 group);D:normal and mature hepatocytes.图6 小鼠ESCs经诱导分化及转染后其肝特异性蛋白的免疫荧光染色

Figure 7.ICG uptake test of transfected cells(×100).A,B:control group,few cells took up ICG and showed dark green;C,D:miR-122 group,most cells took up ICG from the medium and showed dark green.B and D are modified pictures of A and C,respectively,in which the background color was deleted.图7 转染后细胞吲哚氰绿摄取情况
讨 论
近年来,对于ESCs的诱导分化研究进展很快,已形成了多种方法和技术体系。从诱导因素的性质来看,主要有以下几类:(1)细胞因子与胞外基质协同诱导。(2)添加表观遗传修饰物质。如我们的前期研究结果表明丁酸钠可以高效诱导小鼠ESCs分化为肝细胞样细胞,并且分化细胞具有肝细胞功能[6]。(3)导入与肝脏发育相关的基因或启动子。Heo等[7]将白蛋白启动子导入小鼠 ESCs,使其表达绿色荧光蛋白,可有利于后续肝细胞样细胞的分选、纯化和移植。(4)共培养方式诱导。如Ishii等[8]利用 CD45-CD49f+/-Thy1+gp38+间充质细胞与小鼠胎肝细胞共同培养形成细胞间接触,从而使其诱导为肝前体细胞。然而,以上诱导方法均不同程度的存在操作复杂以及诱导效率不高的问题胚胎干细胞向肝细胞分化要经历从内胚层、胚肝到成熟肝脏等多个时期,其中涉及复杂的基因调控过程。表观遗传修饰 (epigenetic modification)是细胞内调控基因沉默与激活的一个重要机制,它通过引起染色质和核小体构型改变来调控基因转录,而不涉及基因本身序列的改变。干细胞的多能性与其胞内广泛的表观遗传特征密切相关,而运用表观遗传修饰策略诱导干细胞分化已成为该领域一个新的研究方向[9]。Zhou等[10]的研究表明组蛋白去乙酞化酶抑制剂丁酸钠可以在体外诱导小鼠ES细胞分化为肝细胞。肝细胞生长因子(hepatocyte growth factor,HGF)在肝细胞发育和成熟过程中具有重要的生理作用,在肝脏发育到中期以后,周围基质细胞分泌的HGF进一步促进其生长分化,因HGF受体(c-Met)与FK506融合蛋白质(FKBP-HGFR)可减少酪氨酸激酶和MAP激酶的活性,从而选择性控制肝细胞的分化[11],是肝细胞诱导分化研究中常使用的细胞因子。Dex不但可上调在内胚层发育成腹侧前肠过程中起重要作用的转录因子GATA4、HNF3p和Hex,更重要的是它还可促HNF4a的表达,从而促进肝细胞的成熟[12]。我们的前期研究还表明用含淤胆血清的病理微环境培养体系能够从经FGF-4和HGF初步诱导的胚胎干细胞中有效筛选出具有功能的肝细胞[13]。
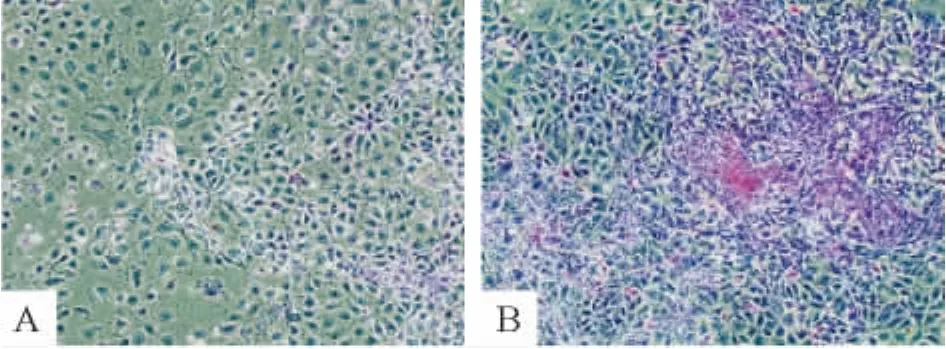
Figure 8.Glycogen storage assayed by PAS staining(×100).A:control group,little glycogen staining;B:miR-122 group,much more glycogen staining.图8 转染后细胞糖原染色结果
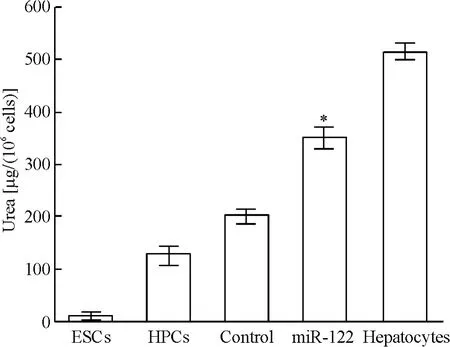
Figure 9.Urea synthesis function detected in the five groups.Mean±SD.n=5.*P <0.05 vs control group.图9 小鼠ESCs及其诱导分化各阶段尿素合成功能检测结果
所以本研究在诱导分化过程中使用了丁酸钠、HGF和Dex联合贯序诱导方法。通过对诱导分化中细胞形态的持续观察,发现伴随着细胞分化,胚胎干细胞逐渐获得了上皮细胞样的形态结构,于诱导分化第9天形成了以不规则多边形及三角形形态为主的小鼠肝前体细胞。
MicroRNA是一种转录后水平调控基因表达的小分子非编码RNA,广义上来讲也是一种重要的表观遗传机制,通过作用于特定的mRNA序列而发挥基因沉默的调控作用,目前的研究表明其在ESCs分化过程中起着重要的作用。miR-9可促进胚胎干细胞向神经细胞方向分化,miR-1和miR-133可促进胚胎干细胞向中胚层方向分化[14-15]。但是,目前还没有发现明确的能够促进ESCs向肝细胞分化miRNA。miR-122是第一个被鉴定的肝特异性miRNA,在小鼠胚胎植入12.5 d后的胎肝中即可被检测,出生之前达到表达平台期,在成熟肝细胞中每个细胞表达量达50 000拷贝以上[4]。我们的前期研究表明,在诱导ESCs向肝细胞分化的早期阶段miR-122的表达水平极低,在第9天时才明显上调,但与正常成熟肝细胞相比,其表达量也如肝癌细胞一样,仍处于一个较低水平。然而,如果将miR-122慢病毒载体直接转染未分化的人胚胎干细胞并不能如预期地引起ESCs向内胚层及肝细胞的定向分化,相反地,其总体分化反而延迟[5]。结合体内正常肝脏发育过程,我们首次提出了miR-122可能是在ESCs分化为肝细胞启动后即中晚期才发挥作用这一设想。为证实这一设想,我们选择在小鼠ESCs诱导分化的第9天,即肝前体细胞阶段才进行miR-122的转染,因为此时miR-122的靶基因可能才开始表达。
我们前期采用构建的慢病毒表达载体pCDHCMV-miR122-EF1-copGFP转染肝前体细胞,但其效果欠佳。其原因可能与质粒的纯度、细胞的适应性等有关。之后我们通过摸索发现采用腺病毒空载体转染同期细胞转染效率较前明显提高,故而我们重新构建出了携带miR-122的重组腺病毒表达载体,并将其转染诱导第9天的肝前体细胞。对照组转染不含miR-122的空载体。通过对比我们发现:(1)在形态学方面,转染miR-122后肝前体细胞呈现规则多边形,核大居中,部分细胞可见双核,胞浆丰富。另外,其核仁也较对照组明显增多。(2)在细胞表型方面,通过real-time RT-PCR检测,转染miR-122后细胞肝特异性基因 ALB、TTR、AAT、G-6-P、CK8、CYP7A1和CYP3A4的mRNA表达水平较对照组明显升高,并且达到了正常肝细胞约80%的水平,其中ALB的表达水平甚至达到正常小鼠肝细胞95%水平;其次,通过免疫荧光染色,我们发现处理组的肝特异性蛋白ALB及CK18水平均升高,而AFP则降低。(3)最后,通过ICG摄取实验、糖原染色及尿素合成实验,我们均得出了实验组肝细胞功能比对照组增强的结果,说明转染miR-122后细胞在功能学上更接近成熟肝细胞水平。
我们的研究结果充分证明miR-122能够有效地促进肝前体细胞向肝细胞的分化和成熟,同预期设想相一致。更重要的是,我们的诱导方法简单、易于操作,并且诱导效率高。但是本研究还存在不足:如肝细胞的其它标记物未能一一检测,未检测ALB的分泌量,没对细胞色素P450功能进行研究;另外,miR-122的具体的作用机制尚不明确,这些都是我们下一步将要进行的研究。
