MIF抵抗糖皮质激素的抗炎效应及其机制①
2013-11-27陈郑礼王俊杰郦佳慧夏照帆
陈郑礼 孙 瑜 王俊杰 郦佳慧 韩 姝 夏照帆
(第二军医大学附属长海医院烧伤科,上海200433)
炎症是机体对感染、体内抗原抗体结合以及机械损伤的一种自身反应。适度的炎症反应是有益的,而过度的或持续的炎症反应则会引起组织损伤和诱发疾病。糖皮质激素(Glucocorticoid,GC)可以纠正炎症反应的失调,在临床中常被用来治疗包括脓毒性休克、全身炎症反应综合征、急性呼吸窘迫综合征等急性炎症反应引起的疾病和哮喘、类风湿关节炎、系统性红斑狼疮、肾小球肾炎、多发性硬化、银屑病等慢性炎症反应异常引起的疾病[1]。巨噬细胞移动抑制因子(Macrophage migration inhibitory factor,MIF)是一种主要由巨噬细胞、激活的T细胞及垂体前叶促肾上腺皮质素细胞等合成和分泌的多功能细胞因子,参与细胞增殖、细胞迁移等多种病理生理反应[2]。迄今为止,MIF是唯一被认为能负向调节GC抗炎作用的细胞因子,它可能与局部或全身炎症、自身免疫性疾病等密切相关,亦可能是GC不能有效发挥抗炎作用的关键因子[2]。MIF是如何抵抗糖皮质激素的抗炎作用的,其机制至今仍未完全阐明。本研究的目的在于阐明MIF抵抗糖皮质激素的抗炎作用及其细胞内机制。
1 材料与方法
1.1 材料 小鼠腹腔巨噬细胞系RAW264.7由本实验室保存;糖皮质激素(Dex)由第二军医大学病理生理学教研室卢建教授惠赠;重组的小鼠MIF细胞因子购自R&D公司;兔抗小鼠Annexin 1的抗体购自Santa Cruz公司;HRP标记的小鼠β-actin单克隆抗体购自Sigma公司;羊抗小鼠的前列腺素E2(PGE2)和白三烯B4(LTB4)的ELISA试剂盒购自Adlitteram Diagnostic Laboratories公司。
1.2 方法
1.2.1 细胞培养 RAW264.7细胞常规培养于含10%小牛血清的RPMI1640培养基中,置于37℃、5%CO2培养箱中孵育,隔天传代。
1.2.2 去激素血清制备 参照文献用DCC(Dextran-coated charcoal)方法进行[3]。过程如下:分别称取活性炭2 g、Dextran T-70 200 mg,用去离子水定容至100 ml,用在磁力搅拌机上搅拌1小时后,以4 000 r/min的速度离心10分钟,去上清后在离心管内加入100 ml的小牛血清,并与沉淀混匀,在磁力搅拌机上搅拌30分钟后,在超速离心机中,20 000 r/min,离心15分钟,重复一次后将上清与无酚红的RPMI1640混合,过滤除菌后,置4℃保存备用。
1.2.3 ELISA方法检测上清中PGE2和LTB4的含量 不同浓度的LPS、MIF、Dex刺激RAW264.7后检测细胞培养上清中PGE2和LTB4含量的变化。或先加入Dex或Dex+MIF孵育1小时,在给予LPS刺激4小时后检测上清中PGE2和LTB4的变化。
1.2.4 Western blot方法测定蛋白水平 不同浓度的LPS、MIF、Dex刺激RAW264.7细胞后,收集全细胞蛋白标本,常规BCA方法进行蛋白定量。制备12%聚丙烯酰胺凝胶,进行SDS-PAGE电泳(2小时),转移到NC膜(50分钟),室温5%BSA封闭1小时,与目标蛋白抗体孵育4℃过夜,TBST洗膜3次,加HRP偶联的二抗(1∶5 000),孵育90分钟,TBST洗膜3次,ECL发光液显色曝光。
1.3 统计学处理 采用SPSS16.0进行统计学处理,计量资料以±s表示。组间比较采用ANOVA方差分析。方差齐性时使用SNK法,方差不齐时采用Dunnett’C方法作多重比较。P<0.05为统计学差异显著。
2 结果
2.1 MIF负向调节地塞米松(Dex)对RAW细胞产生前列腺素E2(PGE2)和白三烯B4(LTB4)的抑制作用 将长势良好的RAW264.7细胞以2×105/孔密度接种六孔板,在37℃、5%CO2的孵箱中培养24小时,镜下观察细胞融合率达到90%时,分别加入MIF(1、10、50、100 ng/ml)、LPS(0.1、1、10 μg/ml)、Dex(10、100、1 000 nmol/L)处理 4 小时,并设对照组(表示为 MIF 0 ng/ml),检测上清液中 PGE2和LTB4的含量。结果如图1所示,不同浓度的MIF和LPS都可以促进RAW细胞产生PGE2,且呈剂量依赖性。大于10 ng/ml的MIF和大于1.0 μg/ml的LPS处理细胞后产生的PGE2与对照组相比显著升高(P<0.01)。不同浓度的Dex处理后对细胞产生PGE2没有影响。
同样的结果如图2所示,不同浓度的MIF和LPS都可以促进RAW细胞产生LTB4,且呈剂量依赖性。大于50 ng/ml的MIF和大于0.1 μg/ml的LPS处理细胞后产生的LTB4与对照组相比显著升高(P<0.01)。不同浓度的Dex处理后对细胞产生LTB4仍没有影响。鉴于上述的结果,我们在下面的实验中,将MIF的处理浓度定为10 ng/ml,LPS为100 ng/ml。
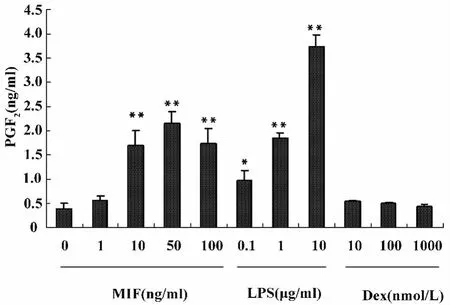
图1 不同浓度MIF、LPS和Dex对RAW264.7细胞上清液中PGE2含量的影响Fig.1 The effect of different concentration of MIF,LPS and Dex on PEG2 production in the supernatant of RAW cells

图2 不同浓度MIF、LPS和Dex对RAW264.7细胞上清液中LTB4含量的影响Fig.2 The effect of different concentration of MIF,LPS and Dex on LTB4 production in the supernatant of RAW cells
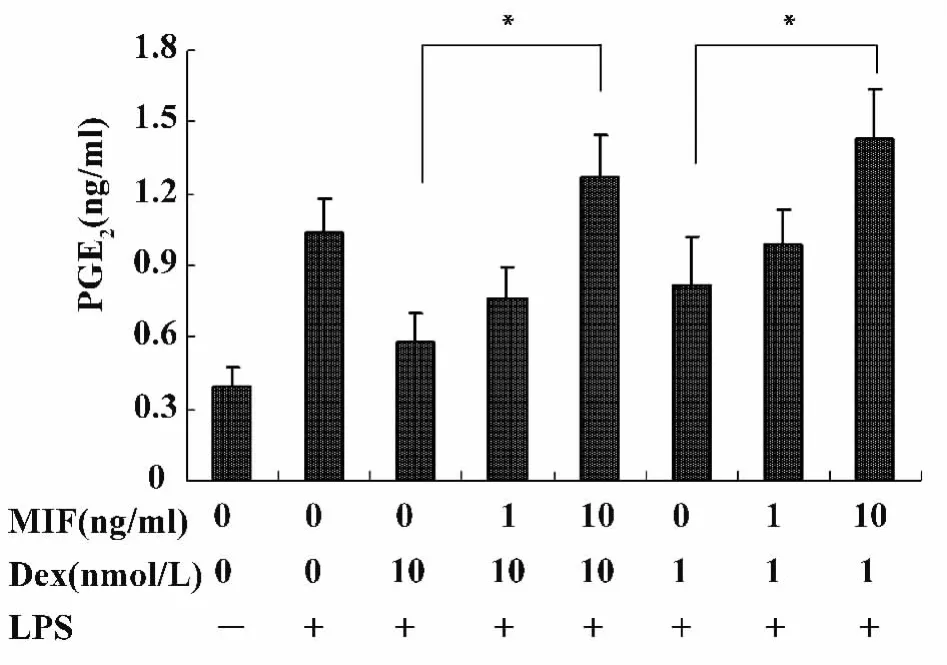
图3 MIF负向调节Dex对PGE2产生的抑制作用Fig.3 MIF counter-regulates Dex-induced inhibition of PGE2 production by RAW macrophages
在长势良好的细胞中预先加入 Dex(1、10 nmol/L)或 Dex(1、10 nmol/L)和 MIF(1、10 ng/ml)孵育1小时,再加入LPS(100 ng/ml)处理4小时后,检测上清液中PGE2和LTB4的含量。如图3和图4所示,MIF以剂量依赖的方式负向调节了Dex对PGE2和LTB4的抑制作用。10 ng/ml的MIF完全逆转了 Dex抑制 PGE2和 LTB4产生的效应(P<0.05)。
2.2 MIF负向调节Dex诱导RAW264.7细胞Annexin 1的表达 Dex能诱导膜联蛋白Annexin 1的表达来抑制脂质炎症介质的产生,从而发挥抗炎作用。前面的实验已经证实MIF能负向调节Dex对脂质炎症介质PGE2和LTB4的抑制作用,那么作为能抑制这两个脂质炎症介质产生的上游抗炎蛋白,Annexin 1是否也受到MIF的影响呢?我们在长势良好的细胞中预先加入Dex(100 nmol/L)或Dex(100 mol/L)和MIF(10 ng/ml)孵育1小时,再加入LPS(100 ng/ml)处理30分钟后,提取胞浆蛋白用Western blot的方法检测Annexin 1的表达。如图5所示,MIF和 LPS均下调了 Annexin 1的表达,而Dex明显诱导了Annexin 1的表达(P<0.01)。LPS和Dex合用能更加显著地促进Annexin 1的表达,而加入10 ng/ml的MIF就能明显逆转上述作用(P<0.01),初步显示出MIF负向调节Dex诱导Annexin 1表达的作用。
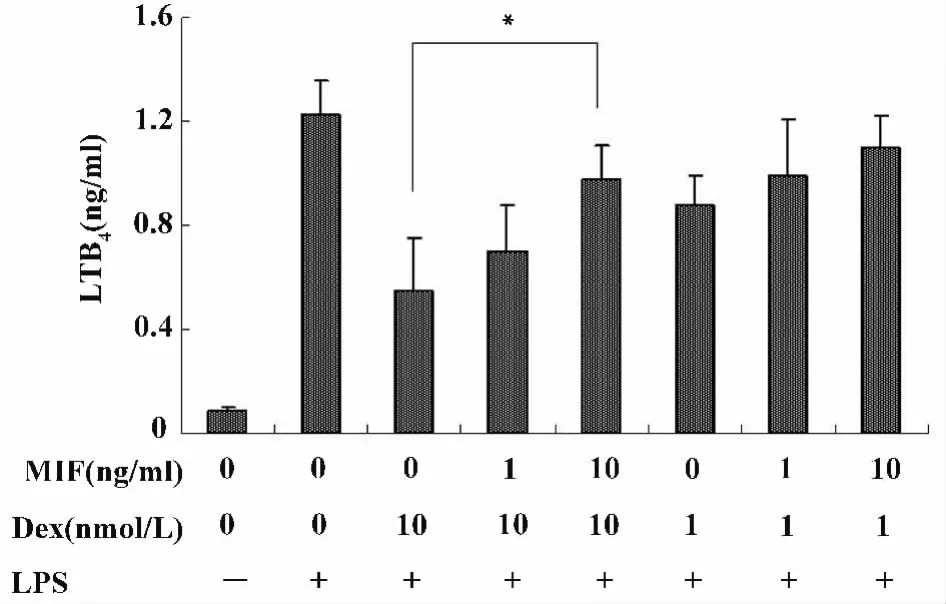
图4 MIF负向调节Dex对LTB4产生的抑制作用Fig.4 MIF counter-regulates Dex-induced inhibition of LTB4 production by RAW macrophages
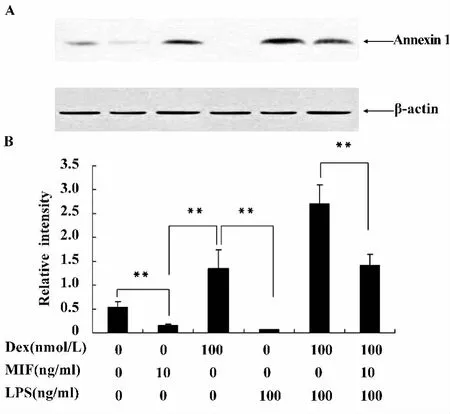
图5 MIF、LPS、Dex对RAW细胞表达Annexin 1的影响Fig.5 The effect of MIF,LPS and Dex on Annexin 1 expression in RAW macrophages
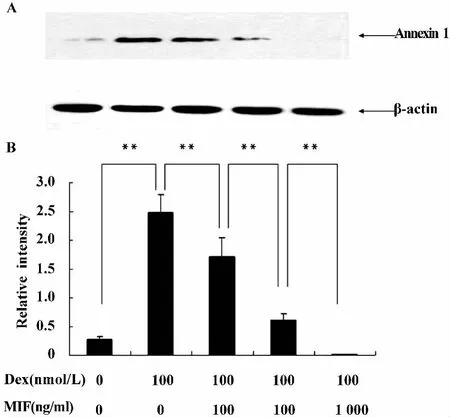
图6 MIF以剂量依赖方式负向调节Dex诱导Annexin 1的表达Fig.6 MIF counter-regulates Dex-induced Annexin 1 upregulation in macrophages
在上述实验的基础上,我们进一步证实MIF负向调节Dex诱导Annexin 1表达的作用。RAW细胞用 Dex(100 nmol/L)或 Dex(100 mol/L)和 MIF(10、100、1 000 ng/ml)处理1小时,检测Annexin 1的表达。如图6,MIF以剂量依赖方式明显抑制了Dex诱导Annexin 1的表达(P<0.01)。
3 讨论
MIF最早被认为是T细胞来源的淋巴因子,因能抑制巨噬细胞的迁移而得名。随后研究表明除了T细胞外,其它合成和释放MIF的细胞还有巨噬细胞、各种组织实质细胞和间质细胞。人类MIF基因位于22号染色体,由三个外显子和两个内含子组成。MIF是含115个氨基酸、分子量为12.5 kD的蛋白质,它与已知的蛋白质之间无明显的氨基酸同源性,不属于任何已知的细胞因子家族,并且具有多种生物学功能。MIF不仅作为重要的细胞因子参与机体的炎症及免疫反应,而且和细胞的生长及分化有着密切的联系[4]。越来越多的文献表明,MIF涉及机体各种炎症性、自身免疫性疾病及多种肿瘤的发病机制。
如前所述,MIF的另一个重要特点是具有拮抗GC抑制炎症的作用(Counter-regulate inhibitory effect of glucocorticoids)[2]。MIF 不但在全身多种炎症性疾病中高表达,而且还能拮抗GC的抗炎作用,然而目前大多数炎症性疾病临床上仍需依赖GC治疗,因而MIF的存在可能大大减弱了GC对于炎症性疾病的疗效。本文研究的重点即阐明MIF是如何拮抗GC的抗炎作用,明确其中的分子机制,旨在寻找关键性靶点,消除MIF对GC作用的影响,进一步提高GC对炎症性疾病的疗效。
以往的研究证实 MIF能负向调节 GC抑制TNF-α、IL-1等促炎细胞因子的产生和释放,对于脂质炎症介质的调节作用未见报道。我们的研究首先证实了MIF能够以剂量依赖方式负向调节GC抑制脂质炎症介质PGE2和LTB4的产生。这一发现又补充了MIF拮抗GC抗炎作用的内容。在介导脂质炎症介质产生的细胞内信号转导途径中,已知胞浆内的磷酸酯酶A2α(cPLA2α)是重要的酶,cPLA2α的磷酸化可以促使花生四烯酸的产生和向类花生酸类物质的转变(如前列腺素、血栓素、前列环素和白三烯)[5,6]。已知 GC 可以诱导抗炎蛋白 Annexin 1 的表达,从而抑制cPLA2α的活性,那么MIF负向调节GC的作用是发生在上述通路中的哪个环节呢?
已有报道部分揭示了MIF对抗GC作用的机制。GC可通过快速、持续的诱导丝裂原活化蛋白激酶磷酸酶1(MAP kinase phosphatase-1,MKP-1)的基因表达,进而反馈抑制p38活化,而在转录后水平抑制促炎症因子的基因表达。MKP-1属于MKP家族的一员,能够通过去磷酸化MAPKs的丝/苏氨酸或氨基酸残基而使MAKP失活。MKP-1在机体中组成型表达,但能被GC强诱导。GC通过诱导MKP-1基因表达及减少MKP-1蛋白降解使MKP-1合成增加。Aeberli等[7]发现在MIF基因敲除动物的腹腔巨噬细胞中,内源性或重组的MIF可对抗GC诱导的MKP-1表达,可造成p38 MAPK持续活化。而p38 MAPK的持续活化即可通过调节活化蛋白1的活性在转录水平调节细胞因子表达。Roger等[8]也发现在RAW264.7巨噬细胞系,重组MIF对GC诱导的MKP-1表达具有负调控作用。上述研究表明MKP-1成为MIF拮抗GC抗炎作用的关键蛋白之一。
此外,Daun等[9]研究发现,GC 通过与胞浆中的受体(GR)结合为复合物并转移到核中,促进IκB的转录,从而抑制炎症介质的释放。而IκB是一种阻碍蛋白,可阻碍免疫细胞胞浆中的转录因子NF-κB的释放,如果 IκB崩解则NF-κB可释放并活化,转移到胞核中激活炎症因子的转录。MIF正是通过抑制GC对胞浆中IκBα表达的上调,以对抗激素在NF-κB/IκB信号转导通路中的效应,进而阻断了其对炎症因子表达的限制作用[9]。这就表明IκBα也成为了MIF拮抗GC作用的关键性靶点。
MKP-1和IκBα作为GC诱导的抗炎蛋白,也是MIF对抗GC抗炎作用的靶蛋白,我们的研究结果首次显示Annexin 1可能也是MIF拮抗GC抗炎作用的关键蛋白。Annexin 1作为GC诱导的抗炎蛋白之一,其在胞浆内信号转导通路中的位置和MKP-1以及IκBα十分相似,都是信号通路中的上游蛋白。鉴于这三个细胞信号通路中的上游蛋白均在MIF负向调节GC抗炎作用的机制中扮演重要角色,因此通过增强其中一个蛋白的活性只能部分对抗MIF抵抗GC的作用,从而也说明了MIF在细胞内作用的广泛性和有效性。
本研究揭示了MIF负向调节GC抗炎作用的关键性分子是GC诱导的抗炎蛋白Annexin 1,即MIF通过干扰GC诱导Annexin 1的表达来对抗GC本身的抗炎作用。阐明这个分子机制,有助于更全面地了解GC不能有效发挥抗炎作用的原因,为临床解释某些炎症性疾病存在的GC疗效不满意现象提供实验室依据。
1 Rhen T,Cidlowski J A.Antiinflammatory action of glucocorticoids:a new mechanism for old drugs[J].N Engl J Med,2005;353(16):1711-1723.
2 Gilliver S C,Emmerson E,Bernhagen J et al.MIF:a key player in cutaneous biology and wound healing[J].Exp Dermatol,2011;20(1):1-6.
3 Han D,Denison M S,Tachibana H et al.Effects of estrogenic compounds on immunoglobulin production by mouse splenocytes[J].Biol Pharm Bull,2002;25(10):1263-1267.
4 Bozza M,Satoskar A R,Lin G et al.Targeted disruption of migration inhibitory factor gene reveals its critical role in sepsis[J].J Exp Med,1999;189(2):341-346.
5 Liu N K,Zhang Y P,Han S et al.Annexin A1 reduces inflammatory reaction and tissue damage through inhibition of phospholipase A2 activation in adult rats following spinal cord injury[J].J Neuropathol Exp Neurol,2007;66(10):932-943.
6 Lim L H K,Pervaiz S.Annexin 1:the new face of an old molecule[J].FASEB J,2007;21(4):968-975.
7 Aeberli D,Yang Y,Mansell A et al.Endogenous macrophage migration inhibitory factor modulates glucocorticoid sensitivity in macrophages via efects on MAP kinase phosphatase-1 and p38 MAP kinase[J].FEBS Lett,2006;580(3):974-981.
8 Roger T,Chanson A L,Knaup-Reymond M et al.Macrophage migration inhibitory factor promotes innate immune response by suppressing glucocorticoid-induced expression of mitogen-activated protein kinase phosphatase-1[J].Eur J Immnnol,2005;35(12):3405-3413.
9 Daun J M,Cannon J G.Macrophage migration inhibitory factor antagonizes hydrocortisone-induced increases in cytosolic IkappaBalpha[J].Am J Physiol Regul Integr Comp Physiol,2000;279(3):R1043-R1049.
