螺旋藻优良藻株的选育
2013-10-30吴晓娟钟华刘海燕顾继锐罗国强
吴晓娟,钟华,刘海燕,顾继锐,罗国强
(通威股份有限公司,四川 成都,610041)
螺旋藻是一种多细胞的丝状蓝藻,属蓝藻门、蓝藻纲、颤藻目、颤藻科、螺旋藻属[1]。螺旋藻的蛋白质含量高达60% ~70%,氨基酸种类齐全,其中8 种营养必需氨基酸组成平衡,除蛋氨酸含量略低外,其他氨基酸的含量均超过了FAO 推荐的标准[2]。此外,螺旋藻还含有丰富的维生素、生物色素、微量元素、不饱和脂肪酸等物质[2],具有极高的营养和保健价值。因此,螺旋藻在医药保健、食品、饲料添加、水产养殖、化妆品、精细化工、废水处理等方面得到广泛的应用。
目前螺旋藻已进入大规模养殖和开发利用阶段,养殖基地主要分布在中国、墨西哥、美国、泰国、日本、以色列等国家和地区。我国有螺旋藻养殖基地60 余家,养殖面积约7 500 000 m2,年产量约为9 600 t,年产值估计超过40 亿元[3]。
但螺旋藻生产中仍存在着藻种混杂退化、生长慢、单位面积产量低、质量不稳定、加工程度低和产后的废水难于处理等问题,严重阻碍螺旋藻产业的发展。在相同的培养条件下,不同的螺旋藻藻株的生长速度和营养物质的含量都会有差异[4-6]。目前国内外学者采用驯化、自然选择、物理或化学诱变、基因工程等方法已筛选出一些新品系。谭桂英等[4]通过逐级稀释法,获得了不同形态大小的钝顶螺旋藻藻丝体6 株,其中S6 具有个体大,易上浮,生长速度快(生长率0.2137),蛋白质含量高(69.1%),经海水驯化,能在海水中良好生长等特点。殷春涛等[5]等将5 个钝顶螺旋藻品系进行单种分离和扩大培养,筛选出1 株耐高温且温度适应范围广(9 ~45 ℃)、蛋白质(63.37%)和不饱和脂肪酸含量高的优良螺藻品系。宋玉凤等[6]通过富集和稀释平板分离出9 株螺旋藻,筛选出1 株生长较快、藻体粗壮的螺旋藻藻种(SP06),在最佳条件下培养8 d 每升养殖水可收获湿藻46 ~48 g。因此,在螺旋藻工业化生产中,筛选高产优质的螺旋藻藻种是当前提高螺旋藻产业发展的一个重大课题,也是提高产量和改善产品质量的基础。
本研究考察了不同来源的5 株螺旋藻藻株在生长速率、光能利用率、上浮性、色素、蛋白质以及藻蓝蛋白含量等的差异,以蛋白质含量和生长速率为评价指标,采用综合评分法,筛选较为理想的螺旋藻藻株,以期获得可供开发利用的螺旋藻株系,并提供筛选方法。
1 实验材料与方法
1.1 藻种
螺旋藻:所用螺旋藻藻株为S1、S2、S3、S4、S5。其中S1、S5 分离自山东威海的极大螺旋藻,S2 为汕头大学所赠的钝顶螺旋藻,S3 为引自中国科学院武汉水生生物研究所的极大螺旋藻,S4 为引自中国科学院武汉水生生物研究所的钝顶螺旋藻。
1.2 培养基
培养基为Zarrouk 配方[7]。
1.3 培养方法
将处于对数期的不同螺旋藻藻株接种到Zarrouk培养液中,以500 mL 的锥形瓶培养300 mL 螺旋藻液,在光照培养箱中静置培养,调整接种密度OD5600.1,温度30 ℃,光照强度7 000 Lx,光照周期L∶D=12 h∶12 h,每天摇动培养瓶4 次。
1.4 细胞浓度以及生物量的测定
取定量的藻液过滤到已知干重的滤膜上,用蒸馏水冲洗掉藻体上附着的盐分,放入烘箱中经80 ℃烘干24 h,放在干燥皿中冷却至少20 min 后,经电子天平称重并减掉滤纸重量后,即得到藻细胞的生物量[8]。以新鲜培养基为空白,将藻液混匀后测定其560 nm 波长下的吸光度OD560,即得到藻细胞的浓度。
1.5 光能利用率
根据能量守恒定律确定藻细胞的能量转换关系确定光能利用率Ψ 的计算[9]:
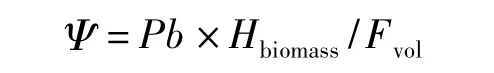
其中,Pb:单位体积增加干重;Hbiomass:藻细胞燃烧热值;Fvol:单位体积接收的光能(球状PAR 辐射测量仪测定光量子后计算)。
1.6 藻细胞蛋白质含量的测定
采用考马斯亮蓝法[10]。取一定量的藻液过滤,无菌水冲洗后进行冷冻干燥。精确称取一定量的螺旋藻冷冻干燥粉,加1 mL 水用研钵进行研磨,然后置-20 ℃冰箱中冷冻后30 ℃解冻,然后再研磨,如此3次(直至显微镜下观察全部细胞破碎为止),最后定容至20 mL,离心(5 500 r/min,10 min),取上清液。取样品提取液0.1 mL 放入具塞试管中,加入0.9 mL蒸馏水稀释10 倍,再加入5 mL 考马斯亮蓝G -250试剂,充分混合,放置5 min 后用1 cm 光径比色杯在595 nm 下比色,记录OD595,并通过标准曲线计算待测样品提取液中蛋白质的含量。
1.7 藻胆蛋白的测定
精确称取一定量的螺旋藻冷冻干燥粉,加入1 mL 磷酸缓冲液(含0.2 mol/L NaCl,pH 6.7),用研钵进行研磨,然后置-20 ℃冰箱中冷冻后30 ℃解冻,然后再研磨,如此3 次(直至显微镜下观察全部细胞破碎为止),最后定容至20 mL,离心(5 500 r/min,10 min),取上清夜测定其吸收光谱,根据公式计算藻蓝蛋白PC、别藻蓝蛋白APC 含量,螺旋藻藻胆蛋白PBP 含量为藻蓝蛋白PC、别藻蓝蛋白APC 之和,然后再换算成单位质量藻粉的含量。
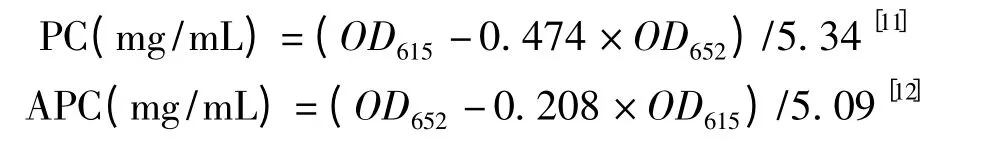
1.8 藻丝浮性
为了估算不同藻株藻丝的浮性,每个处理取8 ~10 mL 藻液倒进透明的试管中,混合均匀后在室内条件下静置1 h。然后测定上下半部的吸光度(以水柱中线为准,位于以上的为上部,否则认为位于下部),分别记为DU 和DL,而藻丝的浮性(flotation activity,FA)则根据下式计算[13]:
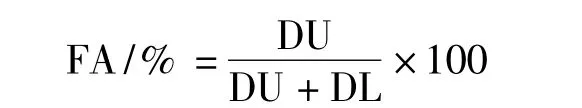
1.9 色素
取一定量的藻液过滤,加入纯甲醇溶液置于4℃的低温条件下过夜,离心(4 000 r/min,10 min),取上清液,用分光光度计测定特定波长的吸光度值,根据公式计算叶绿素a(chl a)含量、类胡萝卜素(Car)含量,然后再换算成单位质量藻粉的色素含量。
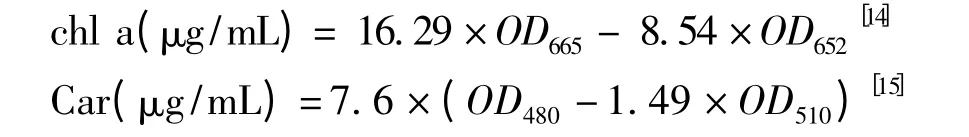
1.10 数据统计与分析
用单因素方差分析(one-way ANOVA)和多重比较中的T-test 对所得数据进行分析,以0.05 和0.01为差异显著水平。
2 结果与分析
2.1 5 株螺旋藻的生长特性
各藻株均经过3 d 的延滞期后进入对数生长期,在培养的9 d 内,各藻株一直在快速地生长;各螺旋藻藻株S1、S2、S3、S4、S5,其吸光度值OD560从开始的0.1 分别上升至1.52、1.20、1.68、1.54、1.52,其中以S3 的吸光度值最高(图1)。螺旋藻藻株S3 和S5 的生长速率最高,为0.11 g/(L·d),其次为S1,达到0.087 g/(L·d)(表1),其中S3、S5 的生长速率分别为S1、S2、S4 的1.22、1.57、1.38 倍,各组间差异极其显著(One - way ANOVA,P<0.01)。吸光度值OD560、生长速率的高低反应了藻的生长繁殖快慢。从生长特性看,螺旋藻藻株S3、S5 的生长最快,具有生长优势。

图1 5 株螺旋藻藻株的生长曲线Fig.1 The growth curve of 5 Spirulina strains
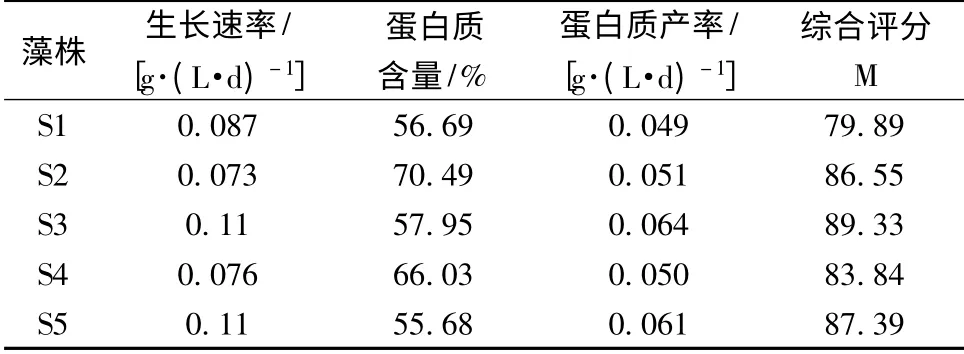
表1 5 株螺旋藻藻株的生长和蛋白质含量Table 1 The growth rate and protein content of 5 Spirulina strains
2.2 5 株螺旋藻的光能利用率
就光合自养生物而言,限制其生长量的最终的因素是光能利用率[16]。因此,光能利用率是衡量微藻生长能力的一个重要指标。本实验中,各螺旋藻藻株S1、S2、S3、S4、S5,9 d 平均的光能利用率分别为1.51%、1.26%、1.91%、1.32%、1.94% (图2)。其中S3、S5 光能利用率最高。这说明在这5 株螺旋藻中,螺旋藻S3、S5 可以更为有效的利用光能,降低工业化生产过程中的能耗成本。

图2 5 株螺旋藻藻株的光能利用率Fig.2 The light use efficiency of 5 Spirulina strains
2.3 5 株螺旋藻的蛋白质含量
螺旋藻在食品、饲料添加等方面已得到广泛的应用,主要是由于螺旋藻的蛋白质含量高达60% ~70%[2],而食用螺旋藻粉要求蛋白质含量高于55%[17],因此螺旋藻的蛋白质含量是评价其产品质量的最重要的参数之一。5 株螺旋藻的蛋白质含量比较见表1。由表1 可知,5 株螺旋藻的蛋白质含量均高于55%,其中螺旋藻藻株S2 在5 株螺旋藻藻种的含量最高,S4 次之,其他3 株无显著差异。
2.4 5 株螺旋藻藻胆蛋白含量的比较
藻胆蛋白(PBP)是强荧光的色素-蛋白络合物,是螺旋藻中重要的捕光色素蛋白,既可作为天然色素,也可以用作制造荧光探针的原料,还具有一些独特的药用价值。因此,螺旋藻中藻胆蛋白含量是衡量螺旋藻藻株性能的优良指标。螺旋藻藻胆蛋白主要为藻蓝蛋白和别藻蓝蛋白。各螺旋藻藻株S1、S2、S3、S4、S5 的藻蓝蛋白(PC)含量分别为3.13%、2.94%、2.81%、3.37%、2.99%,别藻蓝蛋白(APC)含量分别为3.08%、5.69%、5.28%、4.59%、4.77%(图3)。藻蓝蛋白、别藻蓝蛋白含量最高的分别为S4、S2。S3 的藻蓝蛋白含量最低,但其别藻蓝蛋白含量较高。而藻胆蛋白含量最高的是S2,其次为S3。
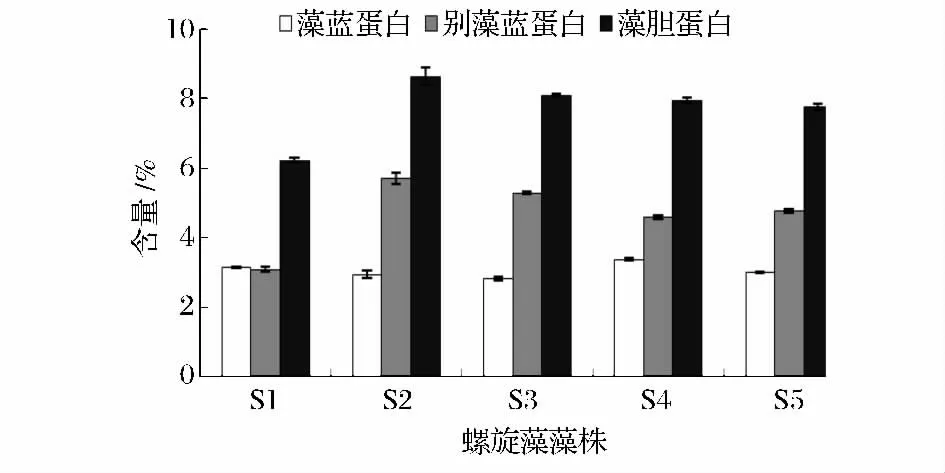
图3 5 株螺旋藻藻株的藻胆蛋白含量Fig.3 The phycobiliprotein content of 5 Spirulina strains
2.5 5 株螺旋藻藻丝浮性的比较
藻丝浮性对藻丝调节其在水体中的位置非常重要,并且在其养殖采收过程中也扮演着重要的角色[18]。静置前,各种螺旋藻的藻丝均匀分布于藻液中,而静置1h 后,可看到有较多的藻丝互相缠绕,呈絮状聚集于藻液的上层及液面。各螺旋藻藻株S1、S2、S3、S4、S5 的藻丝浮性分别为67.32%、70.69%、86.82%、64.17%、74.86%(图4)。S3 的藻丝浮性分别是的1.29、1.23、1.35、1.16 倍,具有极其显著的差异(T-test,P<0.01)。可见,在采收过程中S3 将更具有优势。
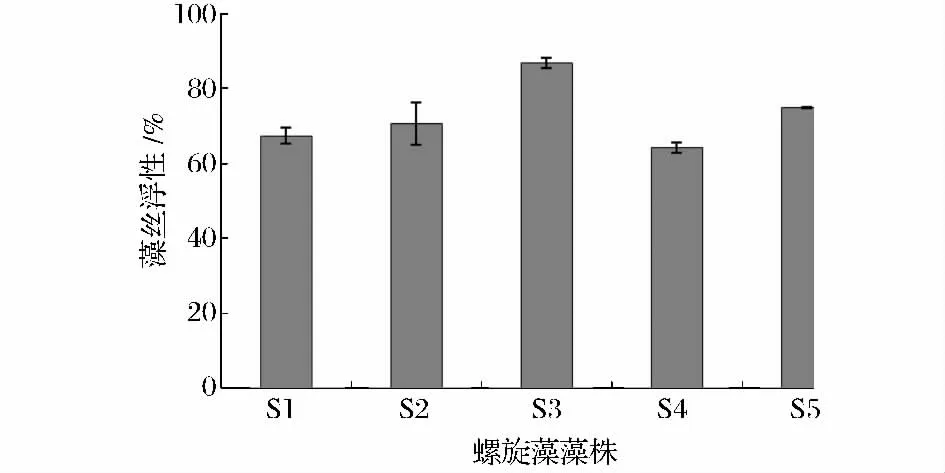
图4 5 株螺旋藻藻株的藻丝浮性Fig.4 The flotation activity of 5 Spirulina strains
2.6 5 株螺旋藻色素含量的比较
螺旋藻细胞中的色素能作为食品、饲料和化妆品等的色素添加剂,可以使观赏鱼的体色鲜艳。因此,螺旋藻细胞中的色素积累是衡量螺旋藻藻株品质优劣的重要指标,而且食用螺旋藻粉要求类胡萝卜素(Car)含量高于2 mg/g[17]。各螺旋藻藻株S1、S2、S3、S4、S5 的叶绿素a(chl a)含量分别为25.67、22.69、26.85、29.60、19.02 mg/g,类胡萝卜素(Car)含量高于3.67 mg/g,均超过食用螺旋藻粉的国家标准要求(图5)。其中叶绿素a(chl a)、类胡萝卜素(Car)含量最高的分别为S4、S2,而S3 的叶绿素a(chl a)、类胡萝卜素(Car)含量均较高。
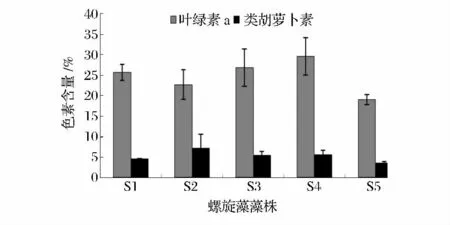
图5 5 株螺旋藻藻株的色素含量Fig.5 The pigments content of 5 Spirulina strains
2.7 综合评价
综合评分法是当评价指标无法用统一的量纲进行定量分析时使用的一种分析方法。评分时以各指标的最大值为参照将数据进行归一化,再给每个指标一个权重,权重的大小根据各指标在总体中的贡献比重给定。参照胡海燕等[19]的综合评价方法,以螺旋藻的蛋白质含量和生长速率为评价指标,权重系数分别设为0.6 和0.4,综合评分M=0.6 ×蛋白质含量×100/蛋白质含量最大值+0.4 ×生长速率×100/生长速率最大值。
由表1 的实验结果可以看出,螺旋藻S3 的生长速率、蛋白质产率和综合评分最高,分别为0.11 g/(L·d)、0.064 g/(L·d)、89.33。因此,螺旋藻S3可以作为工业化培养的藻株。
3 结论
本实验通过比较各螺旋藻株的主要生长性能和品质(生长、光能利用率、蛋白质、藻蓝蛋白、别藻蓝蛋白、藻丝浮性、色素),并采用综合评分法,从5 株螺旋藻中筛选出1 株优质藻株S3。此藻株主要具有以下特点:
(1)生长速度快。体现在其OD560吸光度值、生长速率、光能利用率均最高。
(2)蛋白质、藻胆蛋白含量较高。干重的增长速率和蛋白质含量的综合评分最高。
(3)上浮性好。由于藻丝螺旋形,互相缠绕,呈絮状漂浮在水面,较易采收。
(4)色素含量较高。
[1] 胡鸿钧,魏印心. 中国淡水藻类- 系统、分类及生态[M]. 北京:科学出版社,2006:142 -143.
[2] 陈峰,姜悦. 微藻生物技术[M]. 北京:中国轻工业出版社,1999:106 -111.
[3] 张学成,薛命雄. 我国螺旋藻产业的现状和发展潜力[J]. 生物产业技术,2012,2(3):47 -53.
[4] 谭桂英,周百成.钝顶螺旋藻优良品系S6 的生长特性及光合特性的研究[J].海洋学报(中文版),1993,15(3):89 -93.
[5] 殷春涛,龚小敏,胡鸿钧,等.适合于咸宁基地生产的螺旋藻品系的选育研究[J]. 应用生态学报,1998,9(2):222 -224.
[6] 宋玉凤,马光庭,韩宇. 螺旋藻的分离筛选及培养条件的选择[J]. 基因组学与应用生物学,2009,28(2):335-338.
[7] Zarrouk. Contribution a letude d’une cyanophycee,Influence de divers factours physiques. et chimiques sur la croissance et la phytosynthese doSpirulina maxima[M].Paris:University of Paris,1966.
[8] Gao Kun-sun,Ma Zeng-ling. Photosynthesis and growth ofArthrospira(Spirulina)platensis(Cyanophyta)in response to solar UV radiation,with special reference to its minor variant[J]. Environmental and Experimental Botany,2008,63(1 -3):123 -129.
[9] Hall D O,Cién Fernández F G,anizares Guerrero E,et al. Outdoor helical tubular photobioreactors for microalgal production:Modeling of fluid-dynamics and mass transfer and assessment of biomass productivity[J]. Biotechnology Bioengineering,2003,82(1):62 -73.
[10] 王孝平,邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工,2009,23(3):40 -41.
[11] Siegelman H W,Chapman D J,Cole W J. The bile pigments of plants[J]. Biochemical Society Symposium,1968,28:107 -120.
[12] Bennet A,Bogard L. Complementary chromatic adaptation in a filamentous blue-green alga[J]. Journal of Cell Biology,1973,58(2):419 -435.
[13] Ma Zeng-ling,Gao Kun -sun. Photosynthetically active and UV radiation act in an antagonistic way in regulating buoyancy ofArthrospira(Spirulina)platensis(cyanobacterium)[J]. Environmental and Experimental Botany,2009,66(2):265 -269.
[14] Porra R J. The chequered history of the development and use of simultaneous equations determination of chlorophylls a and b[J]. Photosynthesis Research,2002,73(1-3):149 -156.
[15] Parsons T R,Strickland J D H. Discussion of spectrophotometric determination of marine plant pigments,with revised equation for ascertaining chlorophylls and carotenoids[J]. Journal of Marine Research,1963,21(3):155-163.
[16] 李师翁,李虎乾,张建军. 小球藻大规模培养研究的进展[J]. 植物学通报,1998,15(4):45 -50.
[17] GB/T16919 -1997. 食用螺旋藻粉.
[18] Kim S G,Choi A,Ahn C Y,et al. Harvesting ofSpirulina platensisby cellular flotation and growth stage determination[J]. Letters in Applied Microbiology,2005,40(3):190 -194.
[19] 胡海燕,张静,徐晶,等. 螺旋藻培养液中碳、氮、磷的优化及其效应评价[J]. 食品科技,2012,37(1):29 -33.
