异基因脐血干细胞穴位移植对类风湿关节炎大鼠细胞因子白介素-1β、肿瘤坏死因子-α、白介素-4、白介素-10影响的实验研究
2013-10-17姜兆荣高明利丛珊珊
姜兆荣 高明利▲ 于 静 丛珊珊
1.辽宁中医药大学附属医院风湿病科,辽宁沈阳 110032;2.辽宁中医药大学,辽宁沈阳 110032
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜及周围结缔组织异常增生、关节进行性破坏为特征的慢性自身免疫性疾病[1]。传统的治疗药物,如免疫抑制剂、糖皮质激素、生物制剂等,虽能使部分患者的病情活动得以控制,但长期应用副作用较大[2]。间充质干细胞因具有免疫调节作用[3],为RA治疗带来新的希望。本研究尝试采用hUCBSCs穴位移植方法治疗类风湿关节炎大鼠模型(CIA),观察对白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-4(IL-4)、白介素-10(IL-10)的影响,探讨 hUCBSCs穴位移植治疗RA的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验材料
牛Ⅱ型胶原(C7809,5 mg,Sigma公司);弗氏完全佐剂(098K8729-CAS9007-81-2,10 mL,Sigma公司);流式细胞仪抗体PE-CD34。甲氨喋呤(MTX),上海医药集团有限公司信通制药厂,产品批号002091。
1.1.2 实验动物
近交系雌性Wistar大鼠120只,动物年龄45~50 d,体重(180±20)g,由辽宁中医药大学实验动物中心提供。
1.1.3 脐血
选择辽宁中医药大学附属医院(以下简称“我院”)妇产科排除了 HIV、HBV、HCV、CMV、EBV、梅毒等急、慢性感染,无血液系统疾患及其他系统疾病的非高危妊娠健康足月产妇,新生儿为经阴道顺产且生后皮肤红润,四肢活动良好,无感染征象的脐血。本研究经我院伦理委员会通过,所有产妇及家属知情同意,并签署知情同意书。
1.2 实验方法
1.2.1 脐血干细胞分离
将采集到的新鲜脐血用HES沉淀法分离脐血单个核细胞,制成MNC悬液,用台盼蓝拒染色试验测细胞存活率,若细胞存活率>95%,则进行下一步实验。用MiniMACS磁性吸附性分离装置,进行CD34+细胞的分离与纯化,用台盼蓝拒染色试验测细胞存活率,流式细胞仪测定CD34+细胞百分比[4]。将处理完毕的采集物低温冻存以备回输。
1.2.2 分组、造模与给药
1.2.2.1 实验分组 将近交系Wistar大鼠120只随机分为六组:正常对照组(A 组)、模型组(B组)、hUCBSCs腕关节注射治疗组(C组)、hUCBSCs尾静脉注射治疗组(D组)、hUCBSCs外关穴注射治疗组(E组)、MTX灌胃治疗组(F组),每组20只。
1.2.2.2 建立CIA动物模型 实验模型采用邓安梅法[5]。除A组外,寒冷刺激10 d后,将10 mg牛Ⅱ型胶原(BⅡC)与5 mL完全氟氏佐剂研磨后,以每只100 μL于大鼠背部、踝部、尾根部皮内注射免疫,免疫注射20 d后,于第21天按上述方法20 μL再次腹腔内注射,作为激发注射免疫。A组在寒冷刺激10 d后,按上述方法及相同部位注射等量的注射用水。
1.2.2.3 hUCBSCs输注途径及剂量 CIA大鼠免疫接种后第31天(除A组及B组用蒸馏水),开始hUCBSCs移植治疗。C、D、E组分别向腕关节腔、尾静脉、外关穴注射0.5 mL 0.9%氯化钠溶液和0.5 mL hUCBSCs悬液(含干细胞2×107/mL),F组MTX灌胃治疗(MTX研成细末,加生理盐水配成悬浊液灌胃0.0175 g/kg),每周1次。
1.2.2.4 指标检测 在hUCBSCs输注4周后ELISA法测定CIA 大鼠外周血细胞因子 IL-1β、TNF-α、IL-4、IL-10的含量。
1.3 统计学方法
采用SPSS 15.0统计软件进行分析,计量资料采用均数±标准差(±s)表示,采用t检验或方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 A、B两组大鼠血清中各指标比较
由于实验操作等原因,在实验过程中有3只死亡,其中B组死亡2只,F组死亡1只。B组大鼠血清细胞因子IL-1β、TNF-α明显高于A组,而IL-4、IL-10明显低于A组(P < 0.05)。 见表1。
表1 A、B 两组大鼠血清中各指标比较(μg/L,±s)

表1 A、B 两组大鼠血清中各指标比较(μg/L,±s)
注:与 A 组比较,△P < 0.05;IL-1β:白介素-1β;TNF-α:肿瘤坏死因子-α;IL-4:白介素-4;IL-10:白介素-10
组别 只数 IL-1βTNF-αIL-4 IL-10 A组B组20 18 0.362±0.027 0.658±0.034△1.864±0.132 2.953±0.186△7.862±0.531 5.876±0.512△50.342±6.100 42.415±3.014△
2.2 B组与各治疗组各项指标的比较
与B组比较,各个治疗组IL-1β、TNF-α明显降低,IL-4、IL-10明显升高(P< 0.05)。 与 F组比较,C、D组 IL-1β、TNF-α、IL-4、IL-10无明显变化(P > 0.05)。 与F 组比较,E组IL-1β、TNF-α 明显降低,IL-4、IL-10明显升高(P < 0.05)。见表2。
表2 B组与各治疗组各项指标的比较(μg/L,±s)
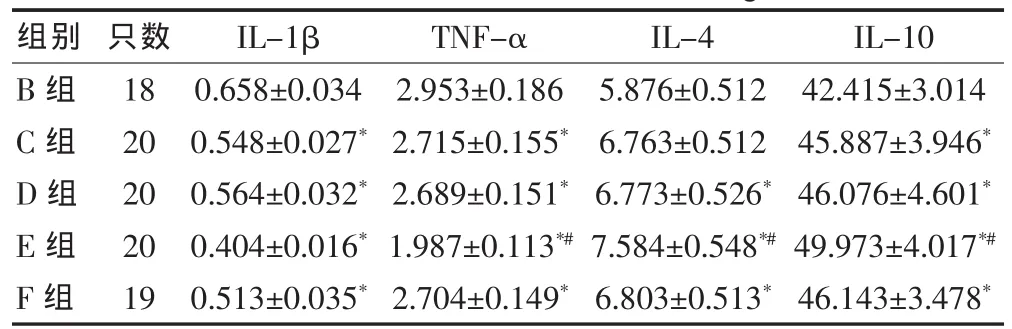
表2 B组与各治疗组各项指标的比较(μg/L,±s)
注:与 B 组比较,*P < 0.05;与 F组比较,#P < 0.05;IL-1β:白介素-1β;TNF-α:肿瘤坏死因子-α;IL-4:白介素-4;IL-10:白介素-10
组别 只数 IL-1βTNF-αIL-4 IL-10 B组C组D组E组F组18 20 20 20 19 0.658±0.034 0.548±0.027*0.564±0.032*0.404±0.016*0.513±0.035*2.953±0.186 2.715±0.155*2.689±0.151*1.987±0.113*#2.704±0.149*5.876±0.512 6.763±0.512 6.773±0.526*7.584±0.548*#6.803±0.513*42.415±3.014 45.887±3.946*46.076±4.601*49.973±4.017*#46.143±3.478*
3 讨论
造血干细胞移植是通过异体或自体的造血干细胞植入受者体内,使受者获得造血和免疫功能重建的方法[6]。大量实验及临床资料已经证明脐带血是极有潜力的造血干细胞来源[7-9]。脐带血干细胞具有多向分化能力、免疫调节性能以及组织修复能力和低风险特性,并且其疗效肯定,不需要组织配型,移植后没有排斥反应。王秦等[10]在临床上已经成功地应用异基因脐带干细胞静脉输注的移植方法治疗3例难治性RA,移植后能显著改善病情,减少免疫抑制剂的用量。
穴位注射是在中医理论的指导下,通过针刺与药物注射相结合的一种注射方法[11-12]。针刺腧穴达到疏通经气、调节脏腑气血功能,同时又与药物相结合发挥药物治疗作用,从而达到腧穴、针刺、药物三者相结合的治疗效果。药物注入穴位后激发了腧穴的良性调整作用,具有吸收快和放大药物治疗作用的效应。这样就可以减少药物的用量,提高疗效。外关穴为手少阳三焦经之络穴,是八脉交会穴,通阳维脉[13]。外关穴注射异基因hUCBSCs治疗RA,一方面具有针刺效应,调节阴阳,刺激神经-内分泌-免疫网络,调节紊乱的免疫功能,另一方面发挥异基因hUCBSCs的作用,调节RA患者机体免疫紊乱,阻止病情进展。
本实验研究hUCBSCs穴位移植治疗CIA大鼠,在实验中采用外关穴注射、腕关节腔注射及尾静脉注射三种方法,结果显示,三种治疗方法对RA大鼠均有明显的治疗作用,外关穴位移植对RA大鼠细胞因子的影响更大,作用明显优于MTX。这可能与穴位的作用不可分离[14-15]。异基因脐血干细胞外关穴位移植治疗的特点就是调整机体的免疫功能,表现在能恢复和促进IL-4、IL-10含量使Th2升高,降低TNF-α、IL-1β的量使Th1降低,使失衡的Th1/Th2趋向平衡,可能是通过抑制炎症细胞迁移、抑制内皮细胞黏附分子的表达、抑制滑膜细胞过度分泌细胞因子及炎症介质[16-17],从而减轻了临床症状,延缓了病理进展,防止了关节畸变和功能破坏。
综上所述,本项目是将传统医学的穴位疗法与现代医学的干细胞移植技术相结合,以期开辟一条新的移植途径,可以使干细胞更为简单、无创、准确地运送到目的地,探求对RA新的治疗方法,并通过此进一步分析RA的发病机制。
[1]Aggarwal S,Pittenger MF.Human mesenchymal stem cells mkdulate allogeneic immune cell responses[J].Blood,2005,105:1815-1822.
[2]王燕茹,张育.间充质干细胞与类风湿关节炎[J].实用医学杂志,2011,27(16):3068-3069.
[3]张颖,马丽辉,李小峰,等.异基因骨髓间充质干细胞对类风湿关节炎患者主要细胞因子表达的影响[J].中国药物与临床杂志,2010,10:36-39.
[4]顾云,谢金萍,杨云.雪莲注射液穴位注射治疗类风湿性关节炎60例[J].山西中医,2009,3(3):30.
[5]梁昊.穴位注射鹿瓜多肽注射液配合中药熏蒸治疗类风湿性关节炎42 例临床观察[J].中医中药,2009,6(10):104-105.
[6]Nauta AJ,Fibbe WE.Immunomodulatory propertics of mesenchymal stromal cells[J].Blood,2007,110:3499-3506.
[7]da-Silva Meirelles L,Chagastelles PC,Nardi NB.Mesenchymal stem cells reside in virtually all postnatal organs and tissues [J].J Cell Sci,2006,119:2204-2213.
[8]朱恒,江小霞,毛宁.破骨细胞参与调控骨髓造血微环境[J].中国实验血液学志,2007,15:1312-1316.
[9]Li JN,Guo WT,Lin H,et al.Protective effects of brain-derived neurotrophic factor gene-modified human umbilical cord blood stem cells on spinal cord injury following transplantation [J].Zhongguo Zuzhi Gongcheng Yanjiu yu Linchuang Kangfu,2007,11(20):3972-3975.
[10]王秦,李小峰,马丽辉,等.异基因脐带间充质干细胞移植治疗类风湿关节炎疗效及安全性[J].中华临床免疫和变态反应杂志,2011,5(3):202-206.
[11]吴东海,王国春.实用临床风湿病学[M].北京:中国医药科技出版社,2001:253-272.
[12]李小峰.重视类风湿关节炎发病机制及治疗的研究进展[J].中华风湿病学杂志,2008,12:1-3.
[13]戴冽,汤美安.转化生长因子β与类风湿关节炎[J].国外医学:内科学分册,1999,26:214-217.
[14]柏干苹,方勇飞.细胞因子与类风湿性关节炎[J].临床内科杂志,2001,18(4):257-258.
[15]金誉,单根法,钟竑.脐血干细胞的研究进展[J].上海第二医科大学学报,2004,(5):389-391.
[16]孟强,赵树铭.提高脐血造血干细胞移植归巢的研究进展[J].国际检验,2011,32(3):366-368.
