降钙素基因相关肽介导骨折愈合的实验研究
2013-10-17张捍军李华哲赵承斌
张捍军 张 睿 李华哲 赵承斌
哈尔滨医科大学附属第四医院骨科,黑龙江哈尔滨 150086
骨折是骨科临床中最为常见的疾病,特别是随着交通事故的频发,骨折患者的数量也呈逐年上升的趋势。目前,骨折的治疗方式主要包括切开复位和闭合复位,但无论哪种方式都存在延迟愈合甚至不愈合的可能,给患者的身心造成极大的痛苦。针对这一问题,国内外学者先后采用了机械固定、骨移植、电刺激、骨诱导等多种方法进行治疗[1-3],虽然取得了一定的进展,但均不能完全解决骨折不愈合的难题。本研究采用与骨代谢密切相关的降钙素基因相关肽(CGRP)转染入骨折断端,观察其对骨折动物模型的愈合作用,在基因水平为促进骨折的愈合提供实验依据。
1 材料与方法
1.1 实验材料
36只 SD大鼠,平均体重(200±10)g,由中国农科院哈尔滨兽医研究所提供,许可证号:SYXK (黑)2006-032;pcDNA3.1-CGRP 质粒(Invitrogen,美国),E.coli.DH5α(哈尔滨医科大学附属第四医院实验室提供),CGRP引物、dNTP(TAKARA,日本),Hind Ⅲ、BamHⅠ(博士德公司,中国武汉),兔抗大鼠CGRP单克隆抗体、生物素二抗、AP二抗(博士德公司,中国武汉)。
1.2 实验方法
1.2.1 pcDNA3.1-CGRP质粒的转化 应用CaCl2溶液将E.coli.DH5α制备成感受态E.coli.DH5α,加入到 50 mL离心管中,向离心管中加入 5 μL pcDNA3.1-CGRP质粒,冰浴 30 min,42℃热休克 90 s,再冰浴 2 min。向管中加入SOC培养基800 μL,37℃培养 45 min,使恢复大肠杆菌的正常生长状态并且表达抗生素的抗性基因。将菌液涂于含有50 μg/mL氨苄青霉素的SOB平板上进行抗性筛选。
1.2.2 CGRP的PCR及酶切鉴定 待菌落长出后,挑选饱满菌落对CGRP行PCR检测,向体系内加入5×PCR Buffer 4 μL,dNTP 1 μL,上下游引物各 1 μL(表1),Taq DNA 聚合酶 0.2 μL,加 ddH2O 定容至 20 μL。 95℃变性 60 s,60℃复性 60 s,72℃延伸 60 s,30 个循环后,72℃延伸 5 min,4℃保温。对产物进行1.5%琼脂糖凝胶电泳分析。对于PCR鉴定阳性菌落,扩增提取质粒后,加入 10×K Buffer 2 μL,Hind Ⅲ 1 μL,BamHⅠ1 μL, 质粒-PCR 混合物 15 μL,ddH2O定容至 20 μL,37℃反应 8 h后进行 1.5%琼脂糖凝胶电泳分析。
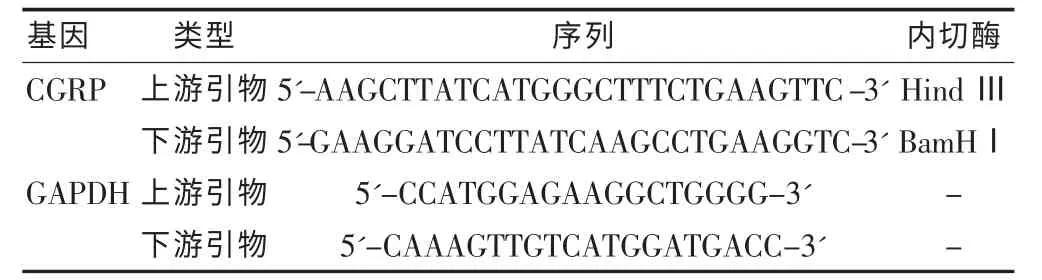
表1 聚合酶链反应引物列表
1.2.3 pcDNA3.1-CGRP质粒溶液的配制 选取pcDNA3.1-CGRP鉴定为阳性克隆菌株,扩增后应用QIAGEN Plasmid Midi Kit提取质粒,0.22 μm滤器除菌干燥后加入到含20%蔗糖的PBS溶液中,配制成浓度为1.0 g/L的pcDNA3.1-CGRP质粒溶液,同时配制1.0 g/L的单纯pcDNA3.1质粒溶液,-20℃保存待用。
1.2.4 动物的分组及模型制备 36只SD大鼠随机分为A、B、C 3 组,每组 12 只,3.5%水合氯醛(1 mL/100g)腹腔麻醉,右下肢常规备皮消毒后,切开皮肤及皮下组织,分离暴露股骨,于股骨中点处用摆锯将股骨横行锯断,克氏针固定后逐层缝合。术后24、48 h两个时间点,A组每只动物于骨折处经皮注入pcDNA3.1-CGRP质粒溶液1 mL,B组注入单纯pcDNA3.1质粒溶液1 mL,C组注入PBS溶液1 mL作为阴性对照。于术后2、4周检测骨折愈合情况。
1.2.5 骨折端的X线检查 于术后观察大鼠一般状态及切口情况,对每组动物均进行X线检查,记录骨折复位情况。分别在2、4周时每组分别选取6只大鼠,在X线下观察骨折断端骨痂的形成情况,并与术后进行比较。
1.2.6 CGRP的免疫组化检测 术后2、4周两个时间点每组各随机选取6只大鼠,乙醚麻醉后处死,取骨折端周围骨组织、骨膜组织和骨骼肌,4%多聚甲醛固定后,骨组织EDTA脱钙处理。切片脱蜡后,3%H2O2浸泡20 min,加入兔抗大鼠 CGRP单克隆抗体(1∶200),室温过夜;PBS冲洗,加入生物素二抗(1∶400),37 ℃孵育 30 min;PBS 冲洗后加入新配制DAB显色。以PBS代替一抗作为阴性对照,每个标本随机选取6张切片,每张切片随机选取6个高倍视野,应用Image-ProPlus图像分析系统测定平均光密度值,并进行统计学分析。
1.2.7 CGRP的 Western blot检测 术后 2、4周两个时间点,取处死动物的骨膜组织,加入1 mL细胞裂解液,冰上裂解5 min,经超声细胞粉碎仪粉碎后,4℃低温离心10 min(12 000 r/min),取上清加入 5×SDS-PAGE蛋白上样缓冲液电泳。转膜封闭后,加入兔抗大鼠CGRP单克隆抗体(1∶200),室温过夜;TBST 冲洗后加入 AP 标记的二抗(1∶400),孵育1 h,加AP显色液显色。应用Image-ProPlus图像分析系统测定平均光密度,并进行统计学分析。
1.3 统计学方法
应用SPSS 18.0采用统计学软件进行数据分析,PCR、免疫组化及Western blot的检测结果的相对值以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CGRP的PCR及酶切鉴定
质粒转化后,对饱满菌落PCR产物行1.5%琼脂糖凝胶电泳,有4个克隆菌落在成像仪下可见大小相同的特异性片段,与CGRP的cDNA相吻合。对这4个克隆菌落提取质粒酶切后进行电泳,在凝胶成像仪下可见两条特异性条带,其大小分别与pcDNA3.1和CGRP相一致。
2.2 骨折端的X线检查
实验动物术后一般状态良好,切口无感染,右下肢跛行。术后行X线检测,各组动物骨折端对位对线良好,横行骨折线清晰可见。术后2周时,A组动物可见明显的骨性骨痂形成,B、C组骨性骨痂不明显;术后4周时,A组动物骨折端均已骨性愈合,骨折线消失,2只动物出现骨髓腔再通,其余四肢尚未再通,B、C组动物可见骨性骨痂形成,骨折线模糊,其中B组1只动物未见骨痂形成。
2.3 CGRP的免疫组化检测
术后2周时,A、B、C三组切片均可见CGRP的阳性表达,骨、骨膜、骨骼肌的CGRP平均光密度值见表2。A组的CGRP表达水平均高于B、C组,差异有统计学意义(P<0.05),说明CGRP基因在A组不同组织均有转染;A组CGRP的表达水平在骨膜组织明显高于骨组织和骨骼肌组织,说明CGRP基因在骨膜组织的转染率较高。术后4周时,A组CGRP 表达较 2周时明显下降(P < 0.05,图1);B、C 组未见CGRP表达。
表2 术后2周时CGRP的免疫组化光密度值(±s)

表2 术后2周时CGRP的免疫组化光密度值(±s)
注:与A组比较,*P<0.05
组别 只数 骨 骨膜 骨骼肌A组60.301±0.0150.415±0.0330.283±0.029 B组60.143±0.009*0.162±0.017*0.105±0.013*C组60.126±0.007*0.148±0.032*0.098±0.003*

图1 术后2、4周时A组CGRP平均光密度值比较
2.4 CGRP的Western blot检测
Western blot检测采用管家基因GAPDH作为内参,电泳条带亮度一致,三组蛋白形成的CGRP条带密度不同。根据公式:CGRP相对量=CGRPF产物电泳条带密度/GAPDH×100%,计算各组蛋白量,结果见表3。A组动物CGRP的表达量在两个时间点较B、C组均明显升高,差异有统计学意义(P < 0.05),B、C 组比较差异均无统计学意义(P > 0.05)。
表3 三组 CGRP蛋白表达相对量比较(±s)
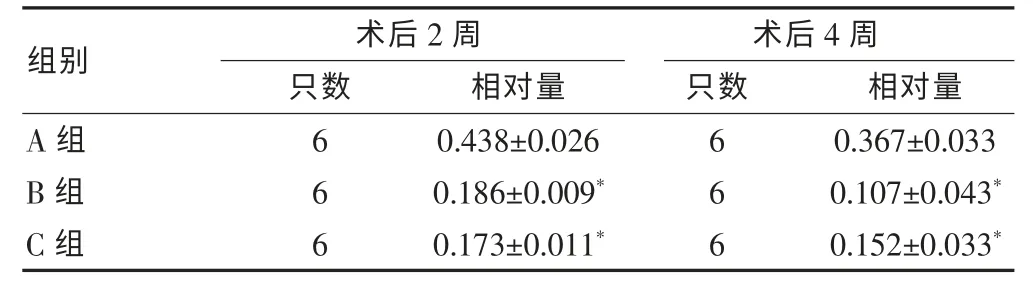
表3 三组 CGRP蛋白表达相对量比较(±s)
注:与A组比较,*P<0.05
术后2周 术后4周组别 只数 相对量 只数 相对量A组60.438±0.02660.367±0.033 B组60.186±0.009*60.107±0.043*C组60.173±0.011*60.152±0.033*
3 讨论
骨折是骨科最为常见的疾病之一[4],多数由意外所致,给患者身心造成极大痛苦,如何提高骨折愈合时间,恢复患者的正常生活是创伤骨科临床中面临的重要问题之一[5]。对于骨折延迟愈合甚至不愈合,许多学者采用不同方法均取得一定疗效[6-8],但并未能完全解决这一难题。骨折的愈合是较为复杂的病理生理过程,在细胞水平涉及成骨细胞、破骨细胞、巨噬细胞等多种细胞的参与[9];在分子水平又涉及多种细胞因子、炎症因子的相互作用[10]。其中,由于CGRP参与骨代谢的过程,在骨折的愈合过程中显得尤为重要。
CGRP最早发现于甲状腺髓样癌组织中,主要分布于感觉神经纤维,通过轴浆运输到达神经末梢[11]。骨折发生后,随着骨折的愈合,周围神经逐渐长入骨折断端,其中以CGRP阳性纤维居多[12]。本研究通过基因转染方式,将外源性基因片段导入骨折断端,使其在体内表达。质粒溶液导入体内后转染效率虽然没有病毒溶液高,但由于CGRP在10-8~10-9mol/L水平即能发挥作用,因此,本实验采用质粒溶液转染,是一种方便快捷的转染方式。A组CGRP在骨、骨膜、骨骼肌组织中的表达水平均明显高于B、C组,说明CGRP在体内转染成功并形成有效的表达。本研究A组CGRP在骨膜中的含量高于骨组织和骨骼肌组织,证明外源性CGRP在骨膜组织中的转染率高,这与内源性CGRP的分布水平相一致,是由于CGRP能够调节成骨细胞的活性,所以分布于骨膜等成骨活跃的区域[13]。术后2周时CGRP在骨膜内的含量明显高于4周时,说明CGRP主要在成骨的早期发挥作用,而在骨痂形成后的塑性期,其作用减弱。术后4周时,A组的CGRP表达仍较B、C组高,说明转染的外源性基因表达较持久。虽然B、C组没有外源性CGRP的转染,但在骨折愈合的早期和晚期仍有CGRP的表达,可见内源性CGRP在骨折周围组织中也有表达,而早期的表达水平高于晚期的动态变化,也说明了内源性CGRP在骨折愈合的过程中发挥一定的作用。CGRP发挥作用的通路可能与蛋白激酶 C(PKC)有关[14],也有研究表明其可能是通过抑制核因子κB活化因子配体(RANKL)对NF-κB的激活作用而起效[15]。本实验不足之处在于未能探究CGRP的具体作用通路及作用位点,尚需进一步研究。
综上所述,降钙素基因相关肽能够加速骨痂形成,提高骨折的愈合效率。
[1]魏均强,张伯勋,陈华,等.萎缩性骨折不愈合的研究新进展[J].中国骨伤,2012,25(12):1053-1056.
[2]Vulpiani MC,Vetrano M,Conforti F,et al.Effects of extracorporeal shock wave therapy on fracture nonunions[J].Am J Orthop,2012,41(9):122-127.
[3]左健,康建敏,潘乐,等.同种异体骨移植用于骨缺损修复的应用现状[J].中国组织工程研究,2012,16(18):3395-3398.
[4]崔巍,史勇,陶卫建,等.切开复位内固定治疗跟骨移位关节内骨折的效果观察[J].中国医药导报,2013,10(3):72-74.
[5]Sakoguchi K,Minami H,Suzuki S,et al.Evaluation of fracture resistance of indirect composite resin crowns by cyclic impact test:Influence of crown and abutment materials [J].Dent Mater J,2013,32(3):433-440.
[6]Yao JF,Shen JZ,Li DK,et al.Rap system of stress stimulation can promote bone union after lower tibial bone fracture:a clinical research[J].Int J Med Sci,2012,9(6):462-466.
[7]Oduwole KO,Cichy B,Dillon JP,et al.Acutrak versus Herbert screw fixation for scaphoid non-union and delayed union [J].J Orthop Surg,2012,20(1):61-65.
[8]Kaipel M,Schützenberger S,Schultz A,et al.BMP-2 but not VEGF or PDGF in fibrin matrix supports bone healing in a delayed-union rat model[J].J Orthop Res,2012,30(10):1563-1569.
[9]Loiselle AE,Paul EM,Lewis GS,et al.Osteoblast and osteocyte-specific loss of Connexin43 results in delayed bone formation and healing during murine fracture healing [J].J Orthop Res,2013,31(1):147-154.
[10]Bragdon B,Thinakaran S,Moseychuk O,et al.Casein kinase 2 regulates in vivo bone formation through its interaction with bone morphogenetic protein receptor type Ia[J].Bone,2011,49(5):944-954.
[11]卢政好,詹瑞森,孙双喜,等.早期SANFH大鼠骨组织中CGRP免疫阳性神经纤维的变化及意义[J].中国医师杂志,2010,12(7):872-875.
[12]王晓云,郭霞,钱忠明,等.骨组织中降钙素基因相关肽阳性神经的分布及生理作用[J].中华骨科杂志,2005,25(3):185-188.
[13]Park SH,Sim YB,Kim CH,et al.Role of α-CGRP in the regulation of neurotoxic responses induced by kainic acid in mice [J].Peptides,2013,44:158-162.
[14]Hong Y,Wang D,Chabot JG,et al.A role for protein kinase C-dependent upregulation of adrenomedullin in the development of morphine tolerance in male rats[J].J Neurosci,2010,30(37):12508-12516.
[15]Wang L,Shi X,Zhao R,et al.Calcitonin-gene-related peptide stimulates stromal cell osteogenic differentiation and inhibits RANKL induced NF-kappaB activation,osteoclastogenesis and bone resorption[J].Bone,2010,46(5):1369-1379.
