能源微藻采收技术研究进展
2013-10-11张海阳匡亚莉
张海阳,匡亚莉,林 喆
(中国矿业大学化工学院,江苏 徐州 221008)
随着化石能源的日益枯竭和环境污染等问题,寻找清洁、可再生的新能源是当今能源亟需解决的问题。微藻作为一种可再生的生物质能源,具有生长周期短、油脂含量高(15%~80%)等优点[1]。由于其生产成本过高,尤其是采收环节,占整个能源微藻加工过程的20%~30%[2-3],所以能源微藻作为生物质能源一直没有得到推广利用。微藻细胞个体小(2~40µm),浓度低(0.5~2 g/L)[4],细胞易损伤而破裂,且细胞稳定悬浮于培养液中[5],给采收带来很大的挑战[6]。因此,寻求低成本、高效率的微藻细胞采收途径是微藻产业化亟需解决的问题之一。目前,微藻采收的方法主要有离心、过滤、絮凝、气浮等[7-8]。同时,微藻采收受藻细胞自身特征(大小、密度等)的影响[7],因此根据不同的细胞特征选择适合的的采收方法也是降低采收成本的有效途径。本文结合近几年国内、外在微藻采收方面研究的相关报道,综述能源微藻传统采收方法和新兴采收技术;在此基础上,指出能源微藻采收过程中存在的问题,并对能源微藻采收未来的研究方向作出了展望,以期为能源微藻早日实现产业化尽一份绵薄之力。
1 传统采收方法
1.1 絮凝
微藻细胞由于表面带负电荷,细胞间相互排斥而稳定悬浮于培养液中,并且个体小、浓度低,直接采用离心、过滤等采收方法,效率低、能耗高。因此,在采用传统的采收过程中加入絮凝剂,使微藻细胞絮凝而形成小的聚集体,可提高沉降、离心、过滤、气浮等方法的采收效果。微藻细胞的絮凝根据不同的作用机理可以分为以下几种。
1.1.1 细胞自发絮凝
微藻自发絮凝是通过改变培养液的pH值,诱导细胞自发絮凝的一种现象[9]。Golueke[10]发现:当污水处理池中CO2消耗到一定时,pH值升高,池中藻类易发生自发絮凝现象。与此同时,随着pH值升高,微藻细胞表面的负电性增强,相互排斥作用越大,细胞反倒不易聚集。Shelef[11]和Nurdogan[12]等的研究解释了这两种截然相反的现象:当培养液pH值升高时,由于Ca2+或Mg2+离子形成沉淀而发挥网捕卷扫等作用,使微藻絮凝;而当培养液中缺乏Ca2+和Mg2+离子时,微藻细胞便不易自发絮凝。
Wu等[13]通过pH值诱导3种淡水微藻和2种海洋微藻絮凝采收时发现:随着pH值的增大,微藻的絮凝效果越好。当pH值达到一定时,絮凝效果趋于稳定。同时,通过絮凝前后培养液中Mg2+的变化发现,Mg2+在pH值诱导微藻絮凝过程中起着关键作用。并且采收完的水体还可以通过调节pH值,重新用于微藻的培养,而不影响微藻的生长。
通过pH值诱导微藻絮凝这一技术适合淡水和海水藻种,采收效率可高达90%,并且,对水质和微藻的下游处理过程影响较小,是一种较为理想的微藻采收方法。
1.1.2 化学絮凝
微藻细胞表面由于羧基或硫酸根等基团而带负电荷,可以加入阳离子电解质对微藻细胞表面电荷进行中和,从而减小细胞间的斥力。随着阳离子的进一步增加,细胞表面电荷继续减小,当细胞间相互引力(范德华力等)大于静电斥力时,细胞相互靠拢而聚集[14]。常用的化学絮凝剂主要分为两类[8]。
(1)无机絮凝剂 由于电中和等作用,大多数金属盐可以用于絮凝微藻,如Fe3+、Al3+、Mg2+、Zn2+等[15]。无机阳离子絮凝剂通过水解生成带正电荷的金属离子,进而与带负电的微藻细胞进行电中和作用,使微藻细胞表面的负电性减弱,从而使微藻絮凝。常用的无机絮凝剂有FeCl3、Fe2(SO4)3、Al2(SO4)3、明矾等[3]。陈春艳等[16]在研究 FeCl3对三角褐指藻(Phaeodactylum tricornutum)的絮凝效果时,发现当FeCl3用量为0.25mmol/L时,采收效率达到95%。Papazi等[15]通过考察Al、Fe、、Zn三种金属盐采收小球藻(Chlorella minutissima)的絮凝效果时发现:铝盐的絮凝效果最好,但是可能导致细胞溶解;铁盐的效果次之;锌盐对藻细胞的损害最小,但是藻细胞容易粘在烧杯等溶器的边缘。Andrea等[17]通过实验证明藻液浓度和药剂用量对无机絮凝剂(AlCl3)絮凝微绿球藻(Nannochloris oculata)的影响最为显著,而离子强度的影响不显著。
无机阳离子絮凝剂具有絮凝效果较高、pH值适用范围广,可用于大多数微藻细胞采收。但是由于金属阳离子的加入,可能对微藻产品的后续利用造成影响。
(2)高分子絮凝剂 高分子絮凝主要通过吸附架桥、吸附电中和、网捕卷扫等作用,使多个细胞或多个小的细胞聚集体相互桥接,形成较大的絮团,有利于后续的脱水处理[18]。Edzwald[19]使用高分子絮凝剂对藻细胞进行预处理,由于吸附架桥和电中和等作用使絮体大于100µm,更加有利于微藻的气浮或沉降采收。
高分子絮凝主要分为两类:无机金属盐类聚合物和有机聚合物。无机金属盐类主要有铝、铁盐的聚合物,如聚合氯化铝、聚合硫酸铝、聚合氯化铁、聚合硫酸铁等;有机聚合物主要有聚丙烯酰胺、壳聚糖、阳离子淀粉等。Wang等[20]通过比较Al2(SO4)3(AS)和聚合氯化铝(PAC)絮凝采收微囊藻(Microcysits aeruginosa)效果时,发现在相同的Al3+浓度下,PAC的用量要少于AS,并且利用PAC絮凝的絮体结构更加紧密,强度更大,更易与微气泡吸附。同样,金属盐的聚合物在处理微藻后会残留金属离子,或对藻类的生长和相关产品会产生影响。相关研究表明:利用天然的壳聚糖[21]或淀粉[22]等天然的高分子絮凝剂不仅絮凝效果好(高达99%),用量小(100 mg/L),而且对采收后的水体用于微藻的再次培养没有影响。
高分子聚合物絮凝效果主要受聚合物的分子量、电荷密度、用量、藻液的浓度、离子强度、pH值等因素的影响[3]。通常,聚合物的分子量越大,同一个分子与细胞的接解点更多,更加有利于吸附架桥作用;聚合物电荷密度越高,越有利于链状高分子的展开,有利于吸附架桥和吸附电中和作用;增加藻液浓度,单位体积的细胞数量增加,有利于细胞间、细胞和絮凝分子之间相互接触的机会,从而提高絮凝效果[1]。
除了以上常见的化学絮凝药剂外,一些新兴的絮凝剂也不断出现。Chen等[23]利用氨水絮凝微藻,絮凝效率可达99%,同时后续还可以利用氨作为再次培养微藻的N源。通过扫描电镜实验(SEM)发现,在加入氨水后,微藻细胞表面结构发生变化,可能氨与细胞表面的一些官能团发生反应,从而使细胞絮凝。
1.1.3 电解絮凝
电解絮凝是通过引入电极(Al和Fe等)电解微藻溶液,阳极电解产生金属阳离子(Al3+和Fe3+),由于吸附电中和等作用使微藻絮凝,同时在电解过程中产生H2和O2与絮凝体吸附,使絮体上浮,加快微藻采收效率。Gao等[24]利用电解絮凝气浮(ECF)去除水体中的藻类,在最优条件下,去除率可高达100%。作者认为,在pH=4~7时,主要是电中和作用使藻细胞絮凝;在pH=7~10时,主要是网捕卷扫作用。另有研究表明[25],电解絮凝气浮采收微藻,铝电极优于铁电极;可通过降低pH值、增加藻液浓度、提高电流密度、加入Cl−等方式,提高电解絮凝效率。
电解絮凝法不用另外加入絮凝药剂,采收后不会残留SO42−或Cl−等阴离子。具有絮凝效率高、适宜pH值范围广、适用大多数藻类、集絮凝气浮于一体等优点,但是由于能耗高,暂时未能用于微藻的大规模采收。
1.2 离心
离心分离是借助离心机旋转产生的离心力而进行物料分离的分离技术,是应用最为广泛的生物分离方法,也是目前微藻采收的常用方法之一[26-27]。
离心分离技术适用于大多数微藻采收。在用离心法采收微藻时,采收效率不仅受细胞自身性质和藻液浓度的影响,还受藻细胞在离心机中的停留时间、沉降深度和离心机功率的影响。Heasman等[28]在研究离心分离法采收微藻生物量时,通过对9种不同种类的微藻进行实验,结果表明:当离心力13000g时,采收效率能达到95%;但是当降低离心力,采收效率也随之下降。当离心力为6000g,采收效率为60%,当离心力为1300g时,采收效率只有40%。Dassey等[27]在对离心法采收能源微藻经济效应分析时发现,当回收率为95%时,能耗在20 kW·h/m3,同时,他提出:可以通过增大藻液的流量来降低能耗,但是会降低回收率。当藻液流量为23 L/min时,能耗虽能降低到0.8 kW·h/m3,而此时的回收率只有17%。
微藻的离心分离虽然效率高,但是出于对能耗和细胞损伤等方面的考虑,离心方法采收微藻目前还主要处于实验室研究阶段,或仅用于高附加值藻类的采收,而在能源微藻工业方面应用较少[3]。
1.3 过滤
过滤的基本原理是:在压强差或离心力的作用下,使悬浮液通过多孔的过滤介质,液相由孔隙流过介质,而固相被截流在介质上,形成滤饼,从而达到固液分离的过程[29],是常用的微藻采收方法之一。过滤主要用于形体较大或长链状微藻的采收,如长鼻空星藻(Coelastrum proboscideum)、钝顶螺旋藻(Spirulina platensis)等[3]。Mohn[30]利用厢式压滤机采收长鼻空星藻,浓缩系数可达245。
随着膜技术的发展,近几年膜过滤技术在微藻采收中的应用也日益广泛,尤其适宜采收形体较小的藻类[4,31-32]。但膜过滤法采收微藻存在处理能力小(当采收量小于2 m3/d时,用膜过滤所需能耗小于离心;当大于20 m3/d时,用离心方法采收微藻更加经济[33])以及膜过滤过程中微藻细胞受机械或流体剪切作用而破裂,或悬浮于藻液中的其它微小颗粒物,而导致的膜污染等问题,将给膜清洗和再次利用带来困难[4,34-35],所以目前膜过滤技术在能源微藻的大规模采收方面应用较少。
1.4 气浮
气浮又称为浮选,基本原理是:在固液悬浮液中通入微气泡,形成气、液、固三相混合流,固体颗粒与微气泡粘附形成共聚体,在浮力作用下,使共聚体上浮,从而达到固液分离[36]。气浮法作为一种高效的固液分离技术,在水处理以及选矿方面应用较多。近几年,随着能源微藻这一新型生物质能源的研究工作的深入,气浮法采收能源微藻的研究报道也随之增多[37]。
由于微藻细胞个体小,在利用气浮法采收时,一般需先加入絮凝药剂,使藻细胞絮凝,然后通入大量的微气泡,使气泡与微藻絮凝体通过碰撞粘附、絮体对气泡的网捕、卷扫和架桥、微气泡在絮凝体中成核等作用形成微藻絮体-气泡的共聚体,使其密度降低,从而实现微藻细胞采收[38]。
气浮法根据不同的气泡产生方式主要可分为以下4种[39-40]。
(1)分散空气气浮法 分散空气气浮法的主要种类有曝气气浮、水泵吸水管吸气气浮、射流制气气浮、叶轮搅拌产气气浮等。通过机械搅拌或空气喷射等作用将通入的空气剪切成微气泡(直径一般为700~1500µm[41])的分散空气气浮法虽然主要用于矿物浮选和油水分离的石化工业[42],但其在微藻细胞的采收方面也同样表现不俗。Cheng等[43]利用分散臭氧气浮法采收斜生栅藻(Scenedesmus obliquus),回收率可达95%;作者所在实验室通过射流微气泡发生器产生微气泡进行小球藻(Chlorella sp.)采收(图1),通过对操作条件的优化,回收率可达90%,且可实现连续采收[44]。
(2)压力溶气气浮 压力溶气气浮主要是通过空压机向水中通入空气,气体在压力的作用下溶解在水中,然后通过微气泡释放器进行减压消能释气,产生微气泡(直径一般为10~100µm[45])。藻液和混凝剂由给料泵引入气浮柱上部,与微气泡形成逆流共聚,从而达到采收目的(图2)。压力溶气气浮采收效率主要受溶气压力、回流比、含气水与絮体接触时间、颗粒浮升速率等因素的影响[45]。压力溶气气浮在水处理的方面研究较早,也较为深入。在最近十几年,溶气气浮用于水体中藻类去除和微藻采收的研究日益增多。Edzwald[46]在研究去除饮用水中的藻类时发现:溶气气浮法比沉降法处理效率更高。Sim等[26]比较离心、转鼓过滤和溶气气浮采收城市污水中的藻类时发现:溶气气浮方法相对其它两种方法更加经济。
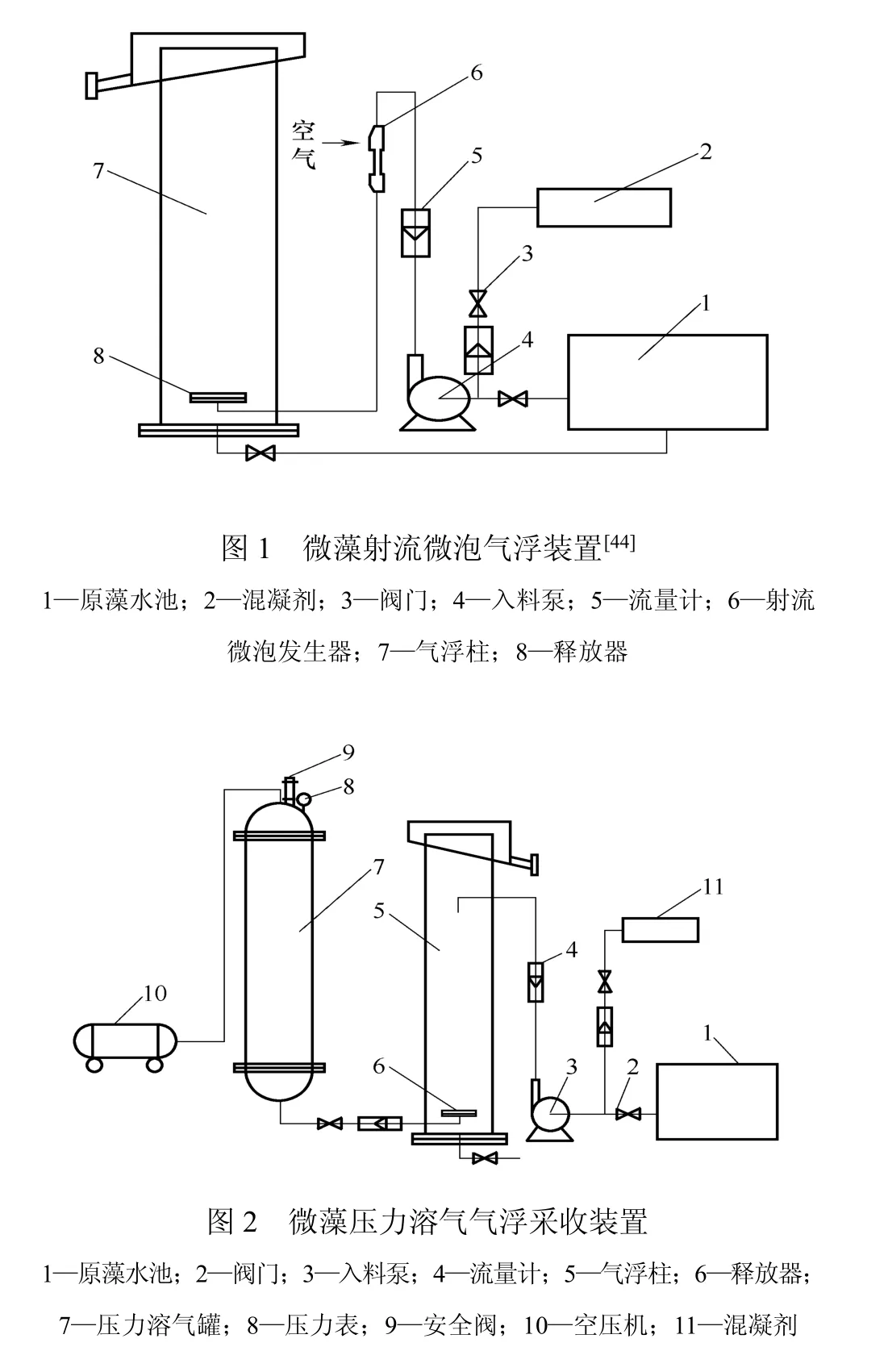
国内利用溶气气浮采收微藻的研究开始于20世纪90年代后,张爱群等[47]利用溶气气浮法采收盐藻,实验表明:在适宜的操作条件下,回收率可达到85%以上。曾文炉等[38,48-49]在研究溶气气浮采收微藻时发现:增加溶气压力、加大回流比、增加溶气时间、延长絮体与气泡接触时间,可提高气浮的采收效率。高莉丽等[50]通过溶气气浮采收不同生长期的小球藻细胞,发现处于对数期的微藻细胞回收效率高于稳定期,同时,对数期的浓缩倍数也较高。
(3)电解气浮 电解气浮法是指通过正、负电极电解水产生的微气泡实现微藻采收的目的。这种方法得到的气泡不但直径非常微细(一般5~10µm),而且均匀,对操作的微环境扰动小,不但适宜于那些絮体易受水流环境剪切而破碎的物质的分离,如乳化油滴、离子、染料、墨汁和纤维等,也非常适合微藻细胞的采收。Gao等[24]在研究电解絮凝气浮(electro-coagulation-flotation,ECF)法去除水体中藻类时表明:在最优条件下,去除率可达100%。Uduman等[51]通过电解絮凝采收绿球藻和扁藻两种能源微藻时,对采收条件进行优化,回收率可分别达到98%和99%。电解气浮集微气泡制造和絮凝于一体,在絮凝的同时,使微气泡被包裹在絮体中,不易受水流扰动而脱附,从而提高气浮效率。但是,由于电解过程能耗较高、电极易钝化等问题,电解气浮法用于能源微藻的采收目前还主要处于实验室研究阶段,尚未得以大规模应用。
(4)生物及化学气浮 生物气浮法主要是依靠微生物新陈代谢产生微气泡,后者再与絮体粘附而上浮,从而实现分离的目的;化学气浮是通过加入某种化学药剂,与溶液发生化学反应而产生的气体(O2、Cl2、CO2等)与絮体吸附而实现固液分离的技术[52]。生物化学气浮法易受温度、溶液性质、药剂等因素的影响,稳定性较差,在微藻采收方面应用较少。
总之,气浮分离法由于其流程和设备简单、条件温和、操作方便、采收效率高、可连续操作、对细胞损伤小等优点,用于能源微藻采收具有较大的发展潜力。但气浮法易受气泡尺寸、细胞表面性质、溶液化学条件、气浮环境等因素的影响,因此,可根据不同的能源微藻选择不同的气浮方法和采收条件。
2 微藻采收新技术
随着对能源微藻研究日益增多以及一些特定微藻采收的需要,除以上传统的采收方法外,一些创新性的采收技术也日益涌现。
2.1 磁选法
磁选法是通过向微藻悬浮液中加入预先处理好的纳米级磁粒(Fe3O4),由于静电吸附等作用,微藻细胞与磁粒相互粘附,在外加磁场的作用下,微藻细胞向磁极一端运动,从而实现分离。Xu等[53]通过磁选法采收布朗茫葡萄藻(Botryococcus braunii)和小球藻(Chlorella ellipsoidea),回收率最高可达98%。Prochazkova等[54]通过微波合成磁性微粒采收小球藻(Chlorella vulgaris),对采收条件进行优化后采收率可达95%,其中的磁性物质可通过酸处理快速脱去。磁选法是一种新兴的能源微藻采收技术,回收率和处理效率较高。但目前磁性物质尚不能循环利用,需进一步的开发一种可循环利用的磁性物质,降低采收成本。
2.2 正向渗透技术
正向渗透是利用正向渗透膜内外盐度差异而实现脱水的一种固液分离技术。Buckwalter等[55]通过人工配制不同盐度的海水,利用正向渗透膜方法采收海水环境下的微藻,平均脱水速率为2 L/(m2·h),可脱去65%~85%的水。利用正向渗透技术进行能源微藻脱水处理,无需在藻液中加入其它化学药剂,对藻细胞无污染,并且处理能耗低;但是在脱水过程中要防止杂质对膜的污染,影响膜的循环使用。
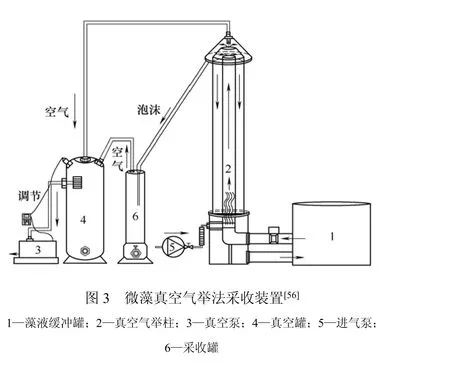
2.3 真空气举
气举法常用于原油的开采,通过向采油井中注入高压气体,与地下的原油混合,利用气体膨胀使气油混合液密度降低,将原油举升到地面的一种方式。Barrut等[56]利用真空气举法采收微藻,能耗小于0.2 kW·h/kg(湿重)。其工作原理(图3)是:通过空压机向气举柱内柱中注入空气,同时,由于真空泵的抽真空作用,加速微藻细胞与空气的混合流上升到柱顶,利用抽真空将微藻细胞收集到采收罐中,从而实现微藻采收。气举法应用于微藻采收目前尚属首次,其处理效率较高,能耗较低,适用于大多数藻类,是一种较为理想的能源微藻采收方法。
2.4 微生物共生法
通过培养特定的细菌或真菌等微生物,由于代谢生成的胞外物质、微生物细胞表面电荷和物理包裹等作用,使微藻絮凝,从而达到采收的目的[57]。这本质上属于生物絮凝法在微藻采收中应用。Zhang等[58]通过微藻细胞与一种丝状真菌共培养的方式,使藻细胞在丝状真菌形成的网状里共生,从而增大了采收目标物的体积,同时结合离心、过滤等方式,实现微藻细胞的采收。Andrew等[59]将球石藻(Pleurochrysis carterae)与一种微生物共生培养,后者在培养体系的营养组份消耗殆尽时将产生一种具有絮凝作用的胞外物质,从而使球石藻絮凝,回收率可达90%。微生物共生法与传统离心或过滤方法相结合,实现能源微藻低成本、高效率、无污染的采收;但是,在与其它微生物共培养时,要注意种群优势的影响,不能影响微藻细胞的生长。
3 结论与展望
随着工业化、城镇化进程的加快,能源问题日益突显,寻找清洁、可再生的新能源将是解决我国发展过程中面临的能源短缺与环境污染的重要手段之一。能源微藻作为生物质能源的一个分支,被认为是未来最有潜力替代化石能源的可再生能源。但是,由于目前能源微藻生产成本过高,特别是在采收环节的高能耗与低效率,将严重阻碍其产业化进程。寻找高效率、低能耗的能源微藻采收方法是其产业化进程中亟需解决的关键问题之一。通过对国内外能源微藻传统采收的作用机理和采收效率进行比较,以及能源微藻新的采收技术的阐述,有以下结论。
(1)由于微藻细胞小、浓度低,在采收时,须多种方法的相结合。即:先通过絮凝使藻细胞相互聚集,形成较大的絮凝体,再结合沉降、气浮等方法进行浓缩富集,最后可利用离心、过滤等方式进一步脱水。
(2)在絮凝、浓缩和脱水过程中,既要提高效率,降低能耗;又不能对藻细胞造成损伤和水质的循环利用造成影响。
(3)结合藻细胞的自身特征、水力环境、下游油脂转化工艺和水质条件的要求等因素,开发低能耗、低成本、高效率、无污染的新兴采收技术。
[1]Chisti Y.Biodiesel from microalgae[J].Biotechnology Advances,2007,25(3):294-306.
[2]Chen J J,Yeh H H,Tseng I C.Effect of ozone and permanganate on algae coagulation removal——pilotand bench scale tests[J].Chemosphere,2009,74(6):840-846.
[3]Molina Grima E,Belarbi E H,Acién Fernández F G,et al.Recovery of microalgal biomass and metabolites:Process options and economics[J].Biotechnology Advances,2003,20(7-8):491-515.
[4]Bilad M R,Vandamme D,Foubert I,et al.Harvesting microalgal biomass using submerged microfiltration membranes[J].Bioresource Technology,2012,111:343-352.
[5]Park J B K,Craggs R J,Shilton A N.Recycling algae to improve species control and harvest efficiency from a high rate algal pond[J].Water Research,2011,45(20):6637-6649.
[6]Kim D G,La H J,Ahn C Y,et al.Harvest ofScenedesmussp.with bioflocculantand reuse of culture medium for subsequent high-density cultures[J].Bioresource Technology,2011,102(3):3163-3168.
[7]Olaizola M.Commercial development of microalgal biotechnology:From the test tube to the marketplace[J].Biomolecular Engineering,2003,20(4-6):459-466.
[8]Chen C Y,Yeh K L,Aisyah R,et al.Cultivation,photobioreactor design and harvesting of microalgae for biodiesel production:A critical review[J].Bioresource Technology,2011,102(1):71-81.
[9]Sukenik A,Shelef G.Algal autoflocculation——Verification and proposed mechanism[J].Biotechnology and Bioengineering,1984,26(2):142-147.
[10]Golueke C W O.Surface properties and ion exchange in algae removal[J].Water Pollution Control Federation,1970,42(8):304-314.
[11]Shelef G S A,Green M.Microalgae harvesting and processing:A literature review[R].Solar Energy Research Institute,1984.
[12]Nurdogan Y,Oswald W J.Enhanced nutrient removal in high-rate ponds[J].Water Science and Technology,1995,31(12):33-43.
[13]Wu Z,Zhu Y,Huang W,et al.Evaluation of flocculation induced by pH increase for harvesting microalgae and reuse of flocculated medium[J].Bioresource Technology,2012,110:496-502.
[14]Knuckey R M,Brown M R,Robert R,et al.Production of microalgal concentrates by flocculation and their assessment as aquaculture feeds[J].Aquacultural Engineering,2006,35(3):300-313.
[15]Papazi A,Makridis P,Divanach P.Harvesting chlorella minutissima using cell coagulants[J].Journal of Applied Phycology,2010,22(3):349-355.
[16]陈春艳,胡晗华,王煜,等.氯化铁和聚丙烯酰胺絮凝剂wt652对三角褐指藻的絮凝作用[J].水生生物学报,2010(3):669-672.
[17]Garzon-Sanabria A J,Davis R T,Nikolov Z L.Harvesting nannochloris oculata by inorganic electrolyte flocculation:effect of initial cell density,ionic strength,coagulant dosage,and media Ph[J].Bioresource Technology,2012,118:418-424.
[18]Mark W Tenney,Wayne F Echelberger Jr,Ronald G Schuessler,et al.Algal flocculation with synthetic organic polyelectrolytes[J].Applied and Environmental Miscrobiology,1969,18(6):965-971.
[19]Edzwald J K.Algae,bubbles,coagulants,and dissolved air flotation[J].Water Science&Technology,1993,27(10):67-81.
[20]Wang Yuheng,Zhou Shengguang,Li Na,et al.Influences of various aluminum coagulants on algae floc structure,strength and flotation effect[J].Procedia Environmental Sciences,2011,8(0):75-80.
[21]Ahmad A L,Mat Yasin N H,Derek C J C,et al.Optimization of microalgae coagulation process using chitosan[J].Chemical Engineering Journal,2011,173(3):879-882.
[22]Vandamme D,Foubert I,Meesschaert B,et al.Flocculation of microalgae using cationic starch[J].Journal of Applied Phycology,2010,22(4):525-530.
[23]Chen F,Liu Z,Li D,et al.Using ammonia for algae harvesting and as nutrient in subsequent cultures[J].Bioresource Technology,2012,121:298-303.
[24]Gao S,Yang J,Tian J,et al.Electro-coagulation-flotation process for algae removal[J].Journal of Hazardous Materials,2010,177(1-3):336-343.
[25]Kim J,Ryu B G,Kim B K,et al.Continuous microalgae recovery using electrolysis with polarity exchange[J].Bioresource Technology,2012,111:268-275.
[26]Sim T S,Goh A,Becker E W.Comparison of centrifugation,dissolved air flotation and drum filtration techniques for harvesting sewage-grown algae[J].Biomass,1988,16(1):51-62.
[27]Dassey A J,Theegala C S.Harvesting economics and strategies using centrifugation for cost effective separation of microalgae cells for biodiesel applications[J].Bioresource Technology,2013,128:241-245.
[28]Heasman M J D,O’connor W,Sushames T,et al.Development of extended shelf-life microalgae concentrate diets harvested by centrifugation for bivalve molluscs:A summary[J].Aquaculture Research,2000,31(8):637-659.
[29]杨守志,孙德堃,何方箴.固液分离[M].北京:冶金工业出版社,2003:86-198.
[30]Mohn F H.Experiences and strategies in the recovery of biomass from mass cultures of microalgae[J].Algae Biomass,1980,23(2):71-547.
[31]Rossignol N,Vandanjon L,Jaouen P,et al.Membrane technology for the continuous separation microalgae/culture medium:Compared performances of cross-flow microfiltration and ultrafiltration[J].Aquacultural Engineering,1999,20(3):191-208.
[32]Zhang X,Hu Q,Sommerfeld M,et al.Harvesting algal biomass for biofuels using ultrafiltration membranes[J].Bioresource Technology,2010,101(14):5297-5304.
[33]Mackay D,Salusbury T.Choosing between centrifugation and crossflow microfiltration[J].Chemical Engineering and Processing:Process Intensification,1988,45(302):45-50.
[34]Babel S,Takizawa S.Microfiltration membrane fouling and cake behavior during algal filtration[J].Desalination,2010,261(1-2):46-51.
[35]Ladner D A,Vardon D R,Clark M M.Effects of shear on microfiltration and ultrafiltration fouling by marine bloom-forming algae[J].Journal of Membrane Science,2010,356(1-2):33-43.
[36]陈翼孙,胡斌.气浮净水技术的研究与应用[M].上海:上海科学技术出版社,1985:1-40.
[37]Maruyama H,Seki H,Suzuki A.Flotation of blue-green algae using methylated egg ovalbumin[J].Chemical Engineering Journal,2009,155(1-2):49-54.
[38]曾文炉,李浩然,丛威,等.微藻细胞的气浮法采收[J].海洋通报,2002,21(3):55-61.
[39]郑毅.微藻细胞培养与采收研究[D].北京:北京化工大学,2003.
[40]高莉丽.微藻的溶气气浮采收技术研究[D].青岛:中国海洋大学,2010.
[41]Rubio J,Souza M L,Smith R W.Overview of flotation as a wastewater treatment technique[J].Minerals Engineering,2002,15(3):139-155.
[42]Zheng YY,Zhao C C.A study of kinetics on induced-air flotation for oil-water separation[J].Separation Science and Technology,1993,28(5):1233-1240.
[43]Cheng Y L,Juang Y C,Liao G Y,et al.Harvesting of scenedesmus obliquusfsp-3 using dispersed ozone flotation[J].Bioresource Technology,2011,102(1):82-87.
[44]林喆,匡亚莉,张海阳.射流发泡与小球藻的批次气浮采收[J].中国矿业大学学报,2012,21(5):839-843.
[45]Nyomi Uduman,Ying Qi,Michael K.Danquah,et al.Dewatering of microalgal cultures:A major bottleneck to algae-based fuels[J].Journal of Renewable Sustainable Energy,2010(2):012707.
[46]Edzwald J K.Lgae,bubbles,coagulants,and dissolved air flotation[J].Water Science&Technology,1993,27(10):67-81.
[47]张爱群,刘长岩.利用气浮法采收盐藻的研究[J].海湖盐与化工,1997,26(3):7-9.
[48]曾文炉,李宝华,石红,等.低溶气压力下微藻细胞的气浮法采收[J].工业微生物,2002(1):13-18.
[49]曾文炉,李宝华,蔡昭铃,等.微藻细胞的连续气浮法采收[J].水生生物学报,2003,27(5):507-511.
[50]高莉丽,刘天中,张维,等.小球藻的絮凝沉降及溶气气浮采收研究[J].海洋科学,2010,34(12):46-51.
[51]Uduman N,Bourniquel V,Danquah M K,et al.A parametric study of electrocoagulation as a recovery process of marine microalgae for biodiesel production[J].Chemical Engineering Journal,2011,174(1):249-257.
[52]张仁瑞,杨伟华.气浮-生化-气浮法处理皮革废水[J].江苏环境科技,1998,2(1):11-13.
[53]Xu L,Guo C,Wang F,et al.A simple and rapid harvesting method for microalgae by in situ magnetic separation[J].Bioresource Technology,2011,102(21):10047-10051.
[54]Prochazkova G,Safarik I,Branyik T.Harvesting microalgae with microwave synthesized magnetic microparticles[J].Bioresource Technology,2013,130:472-477.
[55]Buckwalter P,Embaye T,Gormly S,et al.Dewatering microalgae by forward osmosis[J].Desalination,2013,312:19-22.
[56]Barrut B,Blancheton J-P,Muller-Feuga A,et al.Separation efficiency of a vacuum gas lift for microalgae harvesting[J].Bioresource Technology,2013,128:235-240.
[57]Vandamme D,Foubert I,Muylaert K.Flocculation as a low-cost method for harvesting microalgae for bulk biomass production[J].Trends in Biotechnology,2013,31(4):233-239.
[58]Zhang J,Hu B.A novel method to harvest microalgaevia co-culture of filamentous fungi to form cell pellets[J].Bioresource Technology,2012,114:529-535.
[59]Andrew K Lee,David M Lewis,Ashman P J.Microbial flocculation,a potentially low-cost harvesting technique for marine microalgae for the production of biodiesel[J].Journal of Applied Phycology,2009,21(5):559-567.
