户太8号葡萄组织培养快繁技术
2013-09-27张继东
张继东
(甘肃林业职业技术学院,甘肃 天水741020)
户太8号葡萄是陕西省户县葡萄研究所历时8年,以当地品种为砧木,以巨峰的奥林匹亚芽变为接穗,经系统选育而成的葡萄新品种。其主要特点是:极早熟,丰产,粒大,色艳,味佳,有香气,树势强旺,抗寒、抗旱、抗病虫害能力强,可二次结果,耐贮运。该品种自发芽到浆果完熟仅需95~105d,定植后2~3年,产量可达1.5万~3万kg/hm2,5年后产量可达4.5万kg/hm2以上。果穗平均重600~800g,果粒着生紧凑,果粒前半端为紫黑色,后半端到尾柄为紫红色。果粒大,平均重15g,最小12g,最大达18g。果肉致密,肉质脆,果肉与果皮、种子易分离,味酸甜适口,含糖量17.3%,含酸量0.5%。在-13℃条件下,无需任何防寒措施即可安全越冬,在最低气温达-17℃时,仍然丰产。对葡萄常见病害霜霉病、白腐病、黑痘病、灰霉病等抗性均强,不怕日灼,易管理[1]。
近几十年来,随着生物工程技术的不断进步和完善,在园艺产业方面的应用也越来越广泛,这不仅极大地促进了园艺产业的蓬勃发展,也给相关产业注入了生机和活力。特别是利用生物工程技术方法之一的植物组织培养及快速繁殖技术,进行苗木繁殖,更是对常规繁殖技术的一次重大革命,显示了强大的生命力和广阔的发展前景。许多植物品种,常常因常规繁殖方法和种源材料的限制,难以迅速大量繁殖,或者繁殖系数极低,不能及时满足生产和市场需求,在一定程度上制约了产业的迅速发展和产业水平的提升。
户太8号葡萄一般采用扦插繁殖或嫁接繁殖,扦插和嫁接繁殖受种源材料限制及繁殖系数低等因素的影响,均不能取得预期效果。采用组织培养快繁技术繁殖既可以得到整齐一致的无性系材料,又能提高繁殖系数,在短期内获得大量苗木。能克服常规繁殖的弊端,为户太8号葡萄的推广和产业化提供保障,具有较为广泛的社会效益、生态效益和经济效益。
1 材料与方法
1.1 试验材料
户太8号外植体材料采自甘肃省天水市麦积区中山流域葡萄园6年生葡萄园。培养基中添加的化学试剂产自天津化工试剂厂和西陇化工试剂厂,无机试剂均为分析纯,有机试剂和激素为化学纯和生物纯,母液配制和培养基用水均为蒸馏水。
1.2 试验方法
1.2.1 器皿洗涤。试验在甘肃林业职业技术学院植物组织培养实验室进行,于2011年4月开始试验。培养瓶去除内外壁残渣,用清水冲去残渣,冲净后将培养瓶浸泡在温水中,经一段时间后加入洗涤剂,用毛刷刷洗内壁,用洗洁球擦洗外壁,直到培养瓶内外壁达到“不挂水珠,水膜均匀,透明锃亮”的标准为止,然后用蒸馏水涮洗1次,自然晾干备用。容量瓶、移液管、量筒和贮液瓶等器皿可先用浓铬酸洗液洗涤,再用清洗培养瓶的方法洗涤。
1.2.2 配方选择。通过查阅资料和咨询相关研究院所,选取B5为基本培养基,添加的激素有6-BA和IAA两种,附加有蔗糖、活性炭和琼脂[2]。
1.2.3 母液及激素配制。为了减少工作量和减少误差,可以将工作液配成高浓度的母液。由于母液浓度高,培养基成分中的一些阴阳离子会发生化学反应,造成养分损失,根据化学试剂的性质,将基本培养基中成分分成6组,配成6液式,可以防止养分损失。激素也可以配制成高浓度溶液,便于制作培养基时添加。在配制之前,根据所需培养瓶苗的数量确定母液的扩大倍数,制订母液和激素配制表,配制时根据母液和激素配制表进行配制。配好定容后转液到贮液瓶中,贴上标签,标明名称,扩大倍数,定容体积,制作人和时间等,存放到2~4℃冰箱中即可,有效期180d。
1.2.4 培养基制备及灭菌。根据配方、母液、激素配制表和需要制作的培养基的升数,计算抽取所需母液和激素的体积数,蔗糖、活性炭和琼脂用量。以制作2L培养基为例,先在锅内加入1.5L蒸馏水,量取母液和激素,并加入锅内,补充水量到2L,再分别加入蔗糖和琼脂,称锅和液体的重量,然后煮制,烧开后,调整pH值到6.0(经高压灭菌后,pH值会下降0.2个单位),再称重并补充散失的水分。分装在培养瓶中,初代培养按25瓶/L分装,继代培养按20瓶/L分装,先将活性炭用小勺装入培养瓶中,再将培养基灌入培养瓶,用封口膜封口。置于高压蒸汽灭菌锅内进行灭菌处理,完全排尽空气后,在103.4kPa(1.05kg/cm2)蒸汽压下,温度达到121℃,维持20min,锅体温度降为100℃时,先打开排气阀,再揭开锅盖取出培养基,置于搁架上至完全冷却,冷却期间不能晃动,以免影响琼脂的凝固能力。在室温下预培养一周后,检查没有污染就可以进行接种。
1.2.5 母株选择及预处理。选择田间生长健壮,无病虫害,丰产性好,综合品质优良的植株,作生物学调查后,标记作为外植体采集母株。在采集外植体之前,可先对母株进行施肥、浇水、病虫害防治和遮荫等措施,提高初代培养成功率。
1.2.6 外植体的采集及处理。春季户太8号葡萄当年生嫩枝长到10~15cm左右时,在连续2~3个晴天后的上午10时左右,选取生长健壮,无病虫害的枝条进行采集,采集后及时剪掉叶片,要留有叶柄,并保湿,尽快带回实验室。在实验室用软毛刷或毛笔沾上洗衣粉或洗洁精对外植体表面进行刷洗,清洗掉大的污物,将洗涤剂冲洗干净后,再用锋利刀片把嫩枝切成单芽茎段,因为顶芽太嫩,表面灭菌时效果差,分切时全都抛弃处理。叶柄以上长0.3~0.5cm左右,叶柄以下长0.5~0.8cm左右,叶柄长0.5cm左右。切好的单芽茎段,放入250mL三角瓶中,每瓶45个,加入1000倍液的吐温-80溶液200mL,并剧烈摇动振荡10~15min,让外植体材料表面充分接触溶液;处理后再用流水冲洗2~3h,以软化“钙斑”。
1.2.7 外植体表面灭菌。将流水中冲洗的单芽茎段沥干后,置于提前30min运行的超净工作台上,用不同浓度和不同处理时间的氯化汞溶液(新配)进行表面灭菌处理;灭菌剂处理后,再用无菌水最少涮洗4次以上,每次不少于5min;并把茎段原来的切口用无菌刀片切掉,以免HgCl2溶液残留切口影响成活[3]。然后在无菌条件下接种于B5基本培养基上,每瓶接种1个外植体(初代培养成功率最高),根据培养14d以后的生长情况确定最佳的氯化汞浓度、处理时间,见表1。

表1 氯化汞溶液不同处理浓度和不同处理时间对外植体成活率的影响
2 初代培养
2.1 配方筛选
初代培养配方进行单因子试验筛选,选出最佳的初代培养基配方。基本培养基为B5+蔗糖20g/L+琼脂5g/L+活性炭,pH=5.8,激素为6-BA和IAA。在接种室中,把处理好的单芽茎段在无菌条件下接种在培养瓶中,每瓶接种1个芽体。接种后28d进行统计,见表2。
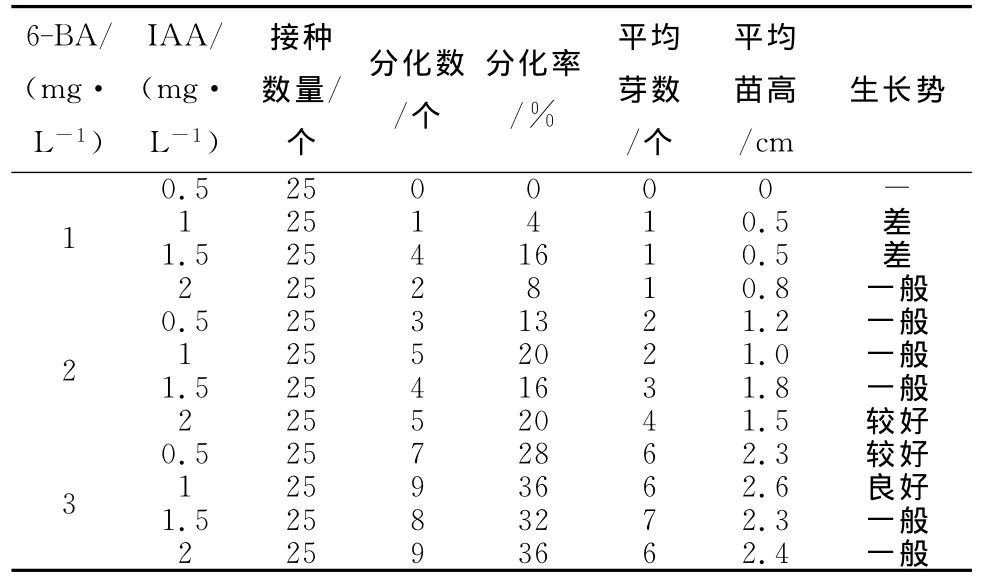
表2 户太8号葡萄初代培养基配方筛选试验统计
2.2 培养环境管理
2.2.1 光质。用日光灯提供光源,日光灯光质可以满足培养苗的生长需求。
2.2.2 光照强度。培养架层间距25~30cm,每层安装3支日光灯管,全开时培养物附近的光强为2500~3000lx,初代培养前期光照不宜太强,可以用减少开关日光灯数量的方法控制光照强度,通常采用关闭中间日光灯的方法。
2.2.3 光周期。初代培养第1周,光周期为8h照光,16h黑暗;第2周光周期为12h照光,12h黑暗;第3周光周期为16h照光,8h黑暗;第4周与第3周光周期相同。
2.2.4 温度管理。户太8号葡萄初代培养时,培养室环境温度维持在23~25℃范围之内,都适宜于培养苗的生长。
2.2.5 湿度管理。适宜的培养室空气相对湿度范围为60%~80%,空气相对湿度小于60%,培养基易失水浓缩,影响培养物的生长,用加湿器或地面洒水的方法来增湿;空气相对湿度大于80%,培养基极易受菌类污染,使污染率急剧增加,并且造成的污染将无法控制,使培养物受污染死亡,导致培养彻底失败,用抽湿机可以有效降低培养室的空气相对湿度。进过30d左右的培养,就可以完成初代培养过程。
3 继代培养
3.1 配方筛选
继代培养配方进行单因子试验筛选,选出最佳的继代培养基配方。基本培养基为B5+蔗糖20g/L+琼脂5g/L+活性炭,pH=5.8,激素为IAA。在无菌条件下,将初代培养的芽体用无菌的弯头剪刀在培养瓶内分切成长1cm左右的茎段,再用无菌的枪状镊子转接在继代培养基中,每瓶3个茎段[3]。接种后28d进行统计,见表3。

表3 户太8号葡萄继代培养基配方筛选试验统计
户太8号葡萄组织培养时的增殖方式是无菌短枝型(又称微型扦插法),在增殖时,根系同时长出,一次成苗,根系发达[2]。平均每株在一个培养周期(28d左右)生根3~4条,根长均在5cm以上,在茎生长的同时,根系从茎段基部剪口处形成的愈伤组织上长出,因此不需要生根培养过程。
3.2 培养环境管理
3.2.1 光质。同初代培养。
3.2.2 光照强度。培养架层间距25~30cm,每层安装3支日光灯管,继代培养光照要维持在3000lx左右,如有坏了的灯管,要及时进行更换,否则会影响组培苗的正常生长。
3.2.3 光周期。继代培养光周期为24h全关照,也可以16h照光,8h黑暗处理,两种光周期效果对组培苗生长影响差异不明显,但24h照光可以延长灯管使用寿命,比16h照光更节省成本。
3.2.4 温度管理。户太8号葡萄继代培养时,培养室环境温度要维持在25~27℃范围之内,均是组培苗生长适宜的温度范围。
3.2.5 湿度管理。同初代培养管理,进过28d左右的培养,就可以完成一次继代培养过程。
4 炼苗移栽
4.1 炼苗
4月初,将完成一个培养周期的瓶苗转入日光温室内,先不打开瓶塞,温度控制在15~25℃,用逐渐减少遮阴的方法,7d之内把光强逐渐升高20000 lx左右。在相对湿度不低于70%的条件下,打开瓶塞,继续锻炼3~5d,使瓶苗适应温室环境。
4.2 移栽
从瓶内用镊子夹取出试管苗,冲洗干净根系的培养基,用1000倍液的多菌灵溶液浸泡5min,然后栽植到营养钵中(基质采用蛭石或珍珠岩),用渗透的方法浇上水,放入日光温室内的小拱棚中。湿度保持在近饱和状态,温度控制在20~25℃,光强15000~20000lx。3d后湿度降到85%,光强逐渐增大到40000lx,当有明显生长时,将苗子移入基质为土∶沙∶腐熟有机肥(1∶1∶0.5)的营养钵中,逐渐改变小拱棚环境,使其与温室环境相同,最后揭掉棚膜,使苗木适应露地生长环境,当组培苗在营养钵中新长出的枝条长5cm左右时,便可移入大田,栽培管理措施与常规大田育苗相同[4]。
采用分步炼苗和移栽,虽然工序多,但整个过程中组培苗无停长,成活率可达80%以上,培育到秋季,苗木可达到出圃要求。
5 结论
以户太8号葡萄春季萌发的半木质化嫩枝作为外植体,从试验材料与方法、初代培养、继代培养、炼苗移栽等四方面,进行了两年的试验,成功获得了初代培养配方B5+6-BA3mg/L+IAA 1mg/L+蔗糖20g/L+琼脂5g/L+活性炭,pH=5.8;继代培养配方B5+IAA 1mg/L+蔗糖20g/L+琼脂5g/L+活性炭,pH=5.8;以及炼苗移栽技术,掌握了初代和继代培养适宜的培养环境,初代培养成功率最高达到36%,继代培养周期25~28d,繁殖系数6.2,移栽成活率90%以上。试验从生产实际出发,通过精心细致研究,继代扩繁优质户太8号瓶苗5.6×103余瓶,炼苗移栽可生产组培苗1.2×104万余株。总结出了户太8号葡萄组织培养快繁技术,为户太8号葡萄的产业化发展提供了技术支撑。
[1] 纪检.葡萄新品种——户太8号[J].陕西林业科技,1996(2):73.
[2] 曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,1996:121-124.
[3] 张继东,常德昌.莱阳矮樱桃组织培养及快繁研究[J].河西学院学报,2003(2):97-98.
[4] 张继东.棣棠组织培养及快速繁殖技术[J].中国林副特产,2009(6):54-55.
