家蝇幼虫抗菌肽对幽门螺杆菌抗菌作用分析
2013-09-26黄健,莫非
黄 健,莫 非
幽门螺杆菌(Helicobacter pylori,H.pylori,)是定植于胃黏膜表面的常见致病菌,与胃炎、消化性溃疡、胃癌、胃 MALT淋巴瘤的发生密切有关[1-3],有效根除H.pylori成为大家关注的焦点。然而H.pylori对抗生素日趋耐药[4],研发新型抗 H.pylori药物成为临床治疗的迫切需求。
昆虫特有的免疫系统能够对入侵体内的病原体及异物产生明显的免疫防御反应。不同的外源物质,都能在昆虫血淋巴中检测到相应的抗菌肽(antibacterial peptides)[5]。其具有不易产 生耐药,作为天然药物对人体的毒副作用较小等独特优势,因此以抗菌肽为基础的新型抗菌药物研制显现出广阔的应用前景。
家蝇(Musca domestica)生长在病菌丛生的环境中,具有繁殖能力强,容易养殖等特点,其免疫防御机制引起研究者的关注。但目前主要集中在抗大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌以及真菌的研究[6-9],未见其对 H.pylori抑菌作用相关报道。本课题组前期以H.pylori针刺诱导和分离纯化家蝇3龄幼虫的抗菌肽为研究对象,运用十二烷基硫酸钠 - 聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDSPAGE)技术与双向凝胶电泳技术(two-dimensional electrophoresis,2-DE)检测其对 H.pylori作用前后的蛋白质表达水平的影响,初步研究家蝇抗菌肽对H.pylori的抑菌机制。
1 材料和方法
1.1 材料
1.1.1 家蝇幼虫与菌株 家蝇由本实验室饲养传代,幼虫按照常规饲养至3龄(孵化后第5d)养蝇房恒温25℃,光周期12L∶12D,H.pylori国际标准测序株ATCC 700392,购自美国菌种保藏中心(ATCC),由本实验室保存。
1.1.2 主要试剂 哥伦比亚血琼脂粉购于Oxoid公司;万古霉素、两性霉素、多粘菌素B、TMP购于Sigma公司;IPG pH 3-10NL 干胶条、IPG buffer、DTT、尿 素、硫 脲、TCA、AP、SDS、IAA、Tris、CHAPS购于Amersham Biosciences公司;甘氨酸、丙烯酰胺、甲叉双丙烯酰胺购于Amresco公司;蛋白定量试剂盒购于Biomiga公司。
1.2 方法
1.2.1 家蝇的免疫诱导 H.pylori微需氧培养48h后测OD600=0.5时终止培养,采用生理盐水清洗菌体,3 000r/min,4 ℃离心10min后,弃上清,再次加入1/2菌沉淀体积的生理盐水悬浮沉淀,作为诱导源,用蘸取诱导源的昆虫针针刺家蝇2d龄幼虫,然后将其放入培养皿内,继续饲养48h。
1.2.2 家蝇幼虫抗菌肽的制备
1.2.2.1 家蝇幼虫提取物的制备 采用瞬时破壁法[8]制备家蝇3d龄幼虫提取物,即取30g新鲜家蝇3d龄幼虫洗净和体表消毒后匀浆后迅速在4℃、12 000r/min条件下离心30min,提取上清液沸水浴10min,再次4 ℃、12 000r/min离心10min取上清备用。
1.2.2.2 分离纯化家蝇幼虫抗菌肽 依次采用固相萃取、反相高效液相色谱(RP-HPLC)方法从家蝇幼虫血淋巴中分离纯化得到抗菌肽,具体操作按照文献制备[10]。
1.2.2.3 家蝇幼虫抗菌肽的蛋白浓度测定 采用BCA蛋白浓度测定法进行测定。取10μL家蝇幼虫抗菌肽和6种不同浓度的蛋白质标准溶液加入2 mL的BCA工作液,在480nm波长处测定其吸收值,计算出家蝇幼虫抗菌肽的蛋白浓度。
1.2.3 抗菌肽对细菌生长曲线影响 取对数生长期H.pylori加入到适量的液体培养基(脑心浸液肉汤,含10%小牛血清,1%混合抗生素)中配制成浓度为3.0×105CFU/mL的菌悬液,再加入抗菌肽液,使其终浓度达到40μg/mL,轻微塞上棉塞,设为实验组。37℃三气培养箱培养(5%O2、10%CO2、85%N2,相对湿度95%以上 )。每隔12h取样测OD600值,绘出抗菌肽作用后细菌的生长曲线,设正常H.pylori作为对照组。
1.2.4 SDS-PAGE观察抗菌肽对 H.pylori蛋白质影响 在抗菌肽终浓度为40μg/mL平板上培养至48h后的 H.pylori ATCC 700392设为实验组,同批未经抗菌肽处理的 H.pylori ATCC 700392为对照组。分别取实验组和对照组的H.pylori菌液,用 PBS(pH7.4)洗涤,6 000r/min,4℃离心5min,收集10μg沉淀,用50μL 1×SDS上样缓冲液重悬菌体,进行SDS-PAGE电泳。
1.2.5 双向电泳观察抗菌肽对H.pylori全菌蛋白的影响
1.2.5.1 H.pylori全菌蛋白的制备 在抗菌肽终浓度为40μg/mL平板上培养至48h后的H.pylori ATCC 700392设为实验组,同批未经抗菌肽处理的H.pylori ATCC 700392为对照组。分别取实验组和对照组的H.pylori菌液,用PBS(pH7.4)洗涤,6 000r/min,4℃离心5min,取沉淀后,分别加入5mL 0.2%二硫苏糖醇(DTT)、20%三氯乙酸(TCA)丙酮溶液,置-20 ℃冷冻过夜;6 000r/min、4℃离心,10min,去上清后加入5mL 0.2%DTT丙酮溶液,12 000r/min、4℃离心,10min,沉淀物重悬于5mL 0.2%DTT丙酮中,-20℃冷冻4h,12 000r/min、4℃离心,10min,将沉淀物-80℃ 预冻4h,真空冷冻干燥,超声波促溶。5 000r/min、4℃离心10min,取上清分装,置-80℃保存备用。
1.2.5.2 等电聚焦(IEF) ①加样:在加样器中分别加入800μg蛋白样品,IPG buffer 2.25μL,水化液补足至450μL,各加样器中分别加入1.6mL覆盖油。②IEF:把加样器平行放于等电聚焦电泳仪上,采用低电压溶胀,85 805v/h,共计25.5h。③ 平衡:IEF结束后,分别取10mL平衡储存液2份,各加入100mg DTT和480mg TCA,将干胶条浸入其中,依次振荡平衡15min。
1.2.5.3 SDS-PAGE电泳 将平衡后的干胶条转至12.5%聚丙烯酰胺凝胶上,加0.5%低熔点琼脂糖封好,电泳至溴酚蓝离下界面约5mm处时停止电泳。考马斯亮蓝染色用于制备型凝胶显色。
1.2.5.4 差异蛋白点质谱鉴定 用 Amersham Bioscience的扫描仪透射扫描,光学分辨率为500dpi,对比度与亮度采用软件默认值。考染凝胶扫描后用保鲜膜包裹,4℃保存以便取点时使用。数字化图像文件运用Image Master 2DElite软件分析。
1.2.5.5 质谱鉴定 按照ABI 4700型基质辅助激光解析串联飞行时间质谱操作指南进行。
1.2.5.6 蛋白质系列数据库检索 利用 Mascot搜索引擎等将 MALDI-TOF-TOF/MS所测各蛋白点质量指纹谱数据在Inter-net上搜索 NCBInr数据库,种属设定为“Bateria”和“Mamma-lian”。
2 结 果
2.1 抗菌肽对幽门螺杆菌生长曲线的影响 图1所示,对照组生长良好,在48h活菌浓度达到108以上,持续生长,完成了生长的对数期,稳定期,并逐步进入衰亡期。而实验组H.pylori不能达到正常的生长高峰进入对数生长期,在48h后直接进入衰亡期。2.2 SDS-PAGE结果 在实验组与对照组同时进行培养48h后,如图2所示,实验组较对照组共有3条蛋白条带发生显著的变化,在分子量约66.4kDa有两条蛋白条带较对照组颜色浅,而分子量约40 kDa的有一条蛋白条带较对照组颜色深,提示家蝇幼虫抗菌肽作用后H.pylori菌体蛋白表达量发生变化。
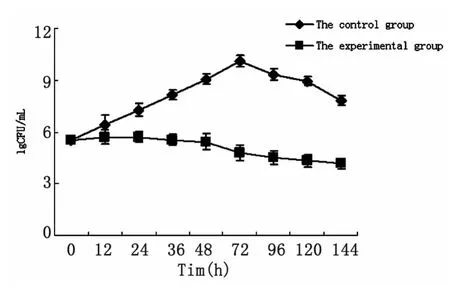
图1 正常幽门螺杆菌的生长曲线与抗菌肽作用后幽门螺杆菌的生长曲线的比较Fig.1 Comparison between normal H.pylori growth curve and H.pylori growth curve with the effect of antimicrobial peptides
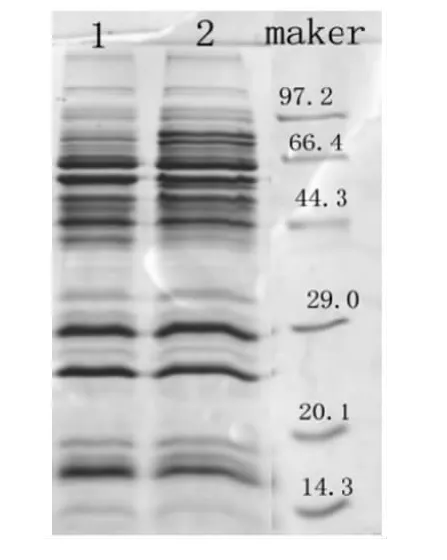
图2 H.pylori全菌蛋白SDS-PAGE图谱Fig.2 SDS-PAGE chart of H.pylori total bacterial protein 1:The H.pylori total bacterial protein of the experimental group;2:The H.pylori total bacterial protein of the control group;3:Protein marker.
2.3 2-DE的平行性分析 将同组在相同上样量、两次电泳的2-DE图像上的点进行检测和匹配,结果显示两次2-DE的平行性较好,其匹配率达95%以上。结果见表1。

表1 同组间的匹配率的比较Tab.1 Comparison of matching rate in the same group
2.4 对照组和实验组H.pylori菌株间差异蛋白的分析 实验组和对照组均分离到960多个蛋白点,其中5个点在存在明显的差异,详见图3,4。经上海博苑科技有限公司ABI 4700质谱仪分析,共鉴定出5个差异蛋白,分别为脯氨酸肽酶(Proline peptidase)(图4a-1,图4a-2);过氧化氢酶(catalase)(图4b-1,图4b-2);S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthetase)(图4c-1,图4c-2);尿素酶 B(ureB)(图4d-1,图4d-2);50S核糖体蛋白L1(50Sribosomal protein L1)(图e-1,图e-2)。
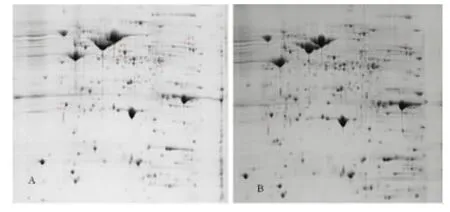
图3 实验组和对照组H.pylori菌株2-DE电泳图Fig.3 The 2-DE electrophoretogram of H.pylori bacterial strain in the experimental group and the control group A:Experimental group;B:Control group

图4 H.pylori蛋白差异点局部放大图谱Fig.4 Local enlarged chart of H.pylori protein spotsa1and a2:Proline peptidase of the control group and the experimental group respectively;b1and b2:Catalase of the control group and the experimental group respectively;c1and c2:S-adenosylmethionine synthetase of the control group and the experimental group respectively;d1and d2:The ure B of the control group and the experimental group respectively;e1and e2:The 50Sribosomal protein L1of the control group and the experimental group respectively.
3 讨 论
H.pylori呈螺旋形或是S形,是微需氧革兰阴性菌。目前普遍采用国际标准三联疗法对H.pylori感染进行治疗。该疗法的副作用大,同时容易产生H.pylori的耐药株,为进一步治疗增加难度。此外还有很多的不良反应。因此,从天然资源中寻找抗H.pylori的新型药物,有望为H.pylori的抗感染治疗开辟一条新的途径。
本研究结果表明,H.pylori在40μg/mL家蝇抗菌肽作用下不能进入生长对数期,很快进入了衰亡期,推测非致死量的家蝇幼虫抗菌肽作用后的H.pylori分裂虽然被抑制但生长并未终止,细菌进入非分裂状态,表明其已通过某种途径作用于细菌的某个或几个关键系统,改变了细菌的正常生理功能状态,从而抑制了细菌的生长。
我们在实验初期对现有的2-DE系统在分离H.pylori的全菌蛋白方面进行了评价,显示本实验的2-DE系统具有良好的重复性,实验所选的对照为自身对照,充分发挥了2-DE的优势,这为寻找家蝇幼虫抗菌肽作用H.pylori前后差异表达蛋白提供了基础。本研究选用亚抑菌浓度1/2MIC作为家蝇幼虫抗菌肽研究浓度,即在40μg/mL药物作用下的H.pylori为实验组,同批生长的未经抗菌肽作用的H.pylori为对照组,发现5个具有差异的蛋白点,这5个差异蛋白点以H.pylori能够在体内定植和体外存活密切相关[11-12]。分子量在40kDa左右的S-腺苷甲硫氨酸合成酶,50S核糖体蛋白表达量较对照组上调,在分子量60kDa左右的过氧化氢酶,脯氨酸肽酶、尿素酶B(ureB)蛋白表达量较对照组下调,这与SDS-PAGE结果一致。因此推测家蝇幼虫抗菌肽作用于H.pylori后,通过影响H.pylori的抗氧化系统、能量代谢系统以及参与应激反应相关蛋白使细菌的生长代谢受到显著的影响,同时干扰其在机体内的定植密度和降低减弱H.pylori在体外的生存能力,从而起到抗H.pylori的功效。
[1]Deng B,Li Y,Zhang Y,etal.Helicobacter pylori infection and lung cancer:a review of an emerging hypothesis[J].Carcinogenesis,2013,34(6):1189-1195.DOI:10.1093/carcin/bgt114
[2]Sutton P,Chionh YT.Why can't we make an effective vaccine againsthelicobacter pylori[J].Expert Rev Vaccines,2013,12(4):433-441.DOI:10.1586/erv.13.20
[3]Peek RM Jr,Blaser MJ.Helicobacter pylori and gastrointestinal tract adenocarcinomas[J].Nat Rev Cancer,2002,2(1):28-37.
[4]Zhang S,Mo F,Sun CQ,etal.Analysis on metronidazole-resistance in Helicobacter pylori[J].Chin J Zoonoses,2011,27(12):1115-1118.(in Chinese)张姝,莫非,孙朝琴,等.幽门螺杆菌对甲硝唑的耐药性分析[J].中国人兽共患病学报,2012,12(27):1115-1118.
[5]Christian WG,Markus M.Discovery of defense and neuropeptides in social ants by genome-mining[J].PLoS One,2012,7(3):32539-32566.DOI:10.1371/journal.pone.0032559
[6]Guo JY,Zgao XY,Feng XJ.Research progress of antimicrobial peptides and their recombinant expression systems[J].Biotechnology,2010,20(3):85-87.(in Chinese)郭佳音,赵晓宇,冯兴军.抗菌肽及其重组表达系统研究进展[J].生物技术,2010,20(3):85-87.
[7]Xu BH,Dong WH,Chen P,etal.Effect of high temperature on antibacterial activity of antibacterial substances induced in the house fly (Musca domestica)by pricking[J].Chin J Vect Biol Ctrl,2009,20(3):201-204.(in Chinese)许兵红,董卫华,陈萍,等.家蝇抗菌物质诱导及高温处理后的抑菌活性[J].中国媒介生物学及控制杂志,2009,20(3)201-204.
[8]Fu P,Wu JW,Guo G.The antifungal activity of extract from Musca domestica (Housefly)larvae[J].Lishizhen Med Materia Medica Reserc,2012,23(3):548-549.(in Chinese)付萍,吴建伟,国果.家蝇幼虫提取物的抗真菌作用研究[J].时珍国医国药,2012,23(3):548-549.
[9]Chen M,Hu QF,Wen YG,etal.Antibacterial effect of the antibacterial peptide from housefly larvae on wound in mice infected by Pseudomonas aeruginosa[J].Biotechnol Bull,2009,3(4):91-94.(in Chinese)陈曼,胡启飞,文阳安,等.家蝇幼虫抗菌肽对铜绿假单胞菌感染小鼠创面的抗菌活性[J].生物技术通报,2009,3(4):91-94.
[10]Guo G ,Wu JW,Fu P,etal.Isolation and purification of antibacterial peptides from the larvae secretion of housefly and the characteristics[J].Chin Parasitol Parasit Dis,2007,25(2):87-92.(in Chinese)国果,吴建伟,付萍,等.家蝇幼虫分泌物抗菌肽的纯化及生物学特性研究[J].中国寄生虫学与寄生虫病杂志,2007,25(2):87-92.
[11]Stent A,Every AL,Sutton P.Helicobacter pylori defense against oxidative attack[J].Am J Physiol Gastrointest Liver Physiol,2012,302(6):G579-587.DOI:10.1152/ajpgi.00495.2011
[12]Alispahic M,Hummel K,Jandreski-Cvetkovic D,etal.Species-specific identification and differentiation of Arcobacter,Helicobacter and Campylobacter by full-spectral matrix-associated laser desorption/ionization time of flight mass spectrometry analysis[J].J Med Microbiol,2010,59(3):295-301.DOI:10.1099/jmm.0.016576-0
