多发性骨髓瘤患者骨髓骨硬化蛋白表达及其临床意义分析*
2013-09-21王晓桃唐爱林聂宇薇
王晓桃,唐爱林,聂宇薇,刘 健,刘 玲
(桂林医学院附属医院血液科,广西桂林541001)
多发性骨髓瘤(multiple myeloma,MM)是一种常见的恶性肿瘤,居血液系统恶性肿瘤第2位,其突出的临床特点之一是骨髓瘤骨病(myeloma bone dsease,MBD)。MBD的临床表现包括弥漫性骨质疏松、高钙血症、溶骨性改变、病理性骨折、骨痛或上述几种病变同时存在[1]。MBD发生机制的关键在于骨髓瘤细胞激活破骨细胞(osteoclasts,OC)的同时抑制成骨细胞(osteoblast,OB)活性。近年来,Wnt信号转导途径对OB分化及活性的调节是 MBD机制研究的热点[2]。一旦瘤负荷增长到一定的水平,瘤细胞或骨髓基质细胞会产生一些Wnt信号拮抗物(如分泌型Fz相关蛋白等),抑制β-链蛋白(β-cate-nin)及下游的信号通路[3]。分泌型Fz相关蛋白主要有骨硬化蛋白(sclerostin)和 Dickkopfs(Dkks),有文献报道 MBD患者存在DKK-1基因过度激活[4-5]。本研究通过检测 MM患者骨髓中sclerostin水平,探讨其临床意义。
1 资料与方法
1.1 一般资料 2007年1月1日至2012年3月31日在本院住院治疗的 MM患者及缺铁性贫血(iron deficient anemia,IDA)患者。MM患者纳入标准:符合张之南主编的《血液病的诊断和疗效标准》关于 MM的诊断标准。排除标准:(1)血清胆红素升高,丙氨酸氨基转移酶、天门冬氨酸氨基转移酶高于正常上限2倍,心功能2级以上,距离较大的手术28d以内;(2)女性患者处于妊娠或哺乳期;(3)合并其他恶性肿瘤(非恶性黑色素瘤除外);(4)合并严重感染或代谢性疾病。IDA患者纳入标准:符合张之南主编的《血液病的诊断和疗效标准》关于IDA的诊断标准,剔除经过治疗的患者,入选前均征得患者及家属的同意。纳入研究的MM患者中男29例,女24例;年龄48~74岁,中位年龄65岁;其中33例为初诊患者,20例为复发患者;免疫分型中IgG型18例,IgA型12例,IgD型4例,轻链型19例。临床ISS分期Ⅱ期19例,Ⅲ期34例。采用门诊、电话及通信方法对患者进行随访,随访时间为6~65个月,平均随访时间为(34.1±18.6)个月。以同期住院的30例IDA患者为对照组,其中男14例,女16例;年龄15~58岁,中位年龄46岁。上述两组患者年龄及性别基线资料有可比性。所有MM患者均进行X线检查:包括颅骨、颈椎、胸椎、腰椎、肋骨、肱骨、股骨及骨盆,以确定有无溶骨病变或骨质疏松;对X线检查阴性者,还将进行MRI或CT检查。血清校正钙浓度=(40-清蛋白)×0.02+血清钙。以X线检查为标准,参考文献[6]将BMD分为1级(普遍的骨质疏松)4例(7.55%),2级(骨质破坏在2处以下)21例(39.62%),3级(骨质破坏大于或等于2处、压缩性骨折或病理性骨折)28例(52.83%)。
1.2 仪器与试剂 sclerostin酶联免疫吸附试验(ELISA)试剂盒(美国R&D公司),Trizol试剂(Invitroge公司),sclerostin逆转录-聚合酶链反应(RT-PCR)试剂盒(上海微晶生物制品有限公司)。sclerostin上游引物5′-TCC CCA CCA CCC CTT TG-3′,下游引物5′-GGT CA CGT AGC GGG TGA A-3′,片段长度76bp,内参照为3-磷酸甘油醛脱氢酶(GAPDH),上游引物5′-ACC ACA GTC CAT GCC ATC AC-3′,下 游 引 物 5′-TCC ACC ACC CTG TTG CTG-3′,片段长度486bp。自动酶标读数仪(国产DG-3022);Fluor ChemTM8900凝胶成像系统(美国Alpha Innotech公司)。
1.3 标本采集 取骨髓5mL,经肝素抗凝处理后,缓慢加入已装有5mL淋巴细胞分离液的离心管中,2 000r/min离心30min,留取上清液以备用;同时提取中间单核细胞(BMMNC)置于另一干燥离心管中以备用。
1.4 方法
1.4.1 ELISA 定量检测标本sclerostin含量,实验步骤严格按照试剂盒说明书进行,实验重复3次,取均值。
1.4.2 RT-PCR 检测骨髓BMMNC sclerostin的表达:(1)提取骨髓液BMMNC;(2)Trizol一步法提取细胞总RNA;(3)反转录合成cDNA;(4)进行PCR扩增。PCR反应总体积为25 μL,94℃变性2min并激活Taq酶,其后94℃变性40s,退火1min(GAPDH 56 ℃,sclerostin 60 ℃),72 ℃ 延 伸1min,GAPDH、sclerostin分别为35、40个循环,最后72℃补齐5 min。取5μL的PCR扩增产物在2%琼脂糖凝胶上电泳鉴定,0.5μg/mL EB染色10min,然后在紫外检测仪上观察,用Fluor ChemTM8900凝胶成像系统进行分析。
1.5 统计学处理 采用SPSS18.0统计软件处理数据,计量资料以±s表示,等级资料用中位数(最小值,最大值)表示,两参数比较采用t检验,两因素相关采用简单相关及等级相关(Spearman)分析,生存分析采用 Kaplan-Meier法并用log-rank检验,检验水准α=0.05。
2 结 果
2.1 MM组与对照组骨髓上清液中sclerostin水平 sclerostin水平高于对照组x±2s为显著增高,MM组中有27例(51.9%)增高,其骨髓上清液中sclerostin的水平(0.54±0.21)pg/mL明显高于对照组(0.31±0.06)pg/mL(t=5.67,P=0.00)。在MM组中,复发难治的MM患者骨髓sclerostin水平(0.65±0.17)pg/mL明显高于对照组及初诊的 MM患者(0.47±0.21)pg/mL(t=8.44、3.27,P<0.01)。本研究用RT-PCR进一步验证大部分 MM患者骨髓BMMNC分泌sclerostin,且有骨质破坏的患者明显高于无骨质破坏的患者(图1)。
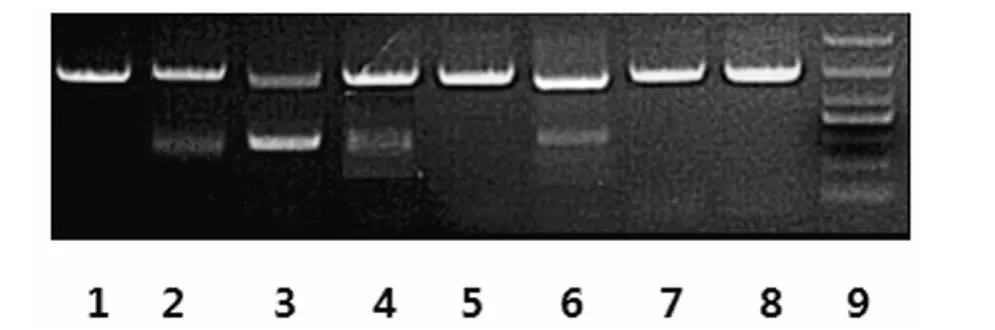
图1 对照组及部分MM患者BMMNC中sclerostin的表达
2.2 sclerostin的水平与临床参数的相关性分析 根据Greipp提供的MM预后相关参数,用Pearson相关分析方法分析β2-微球蛋白(β2-microglobulin,β2-MG)、肌酐(serum creatinine,Scr)、年龄(age)、血小板(platelet,PLT)、乳酸脱氢酶(lactic dehydrogenase,LDH)、血红蛋白(haemoglobin,Hb)、血清清蛋白(seralbumin,Alb)、碱性磷酸酶(alkaline phosphatase,ALP)、M蛋白的比例(轻链型、IgD和IgE型除外)、校正血钙与sclerostin的相关性;用Spearman相关方法分析sclerostin与骨病分级及临床ISS分期的相关性。结果显示β2-MG、校正血钙、ALP、M蛋白的比例、骨质损害评分和ISS分期与sclerostin均显著相关(P≤0.05),见表1。
表1 sclerostin与MM患者主要临床指标的相关性(±s)
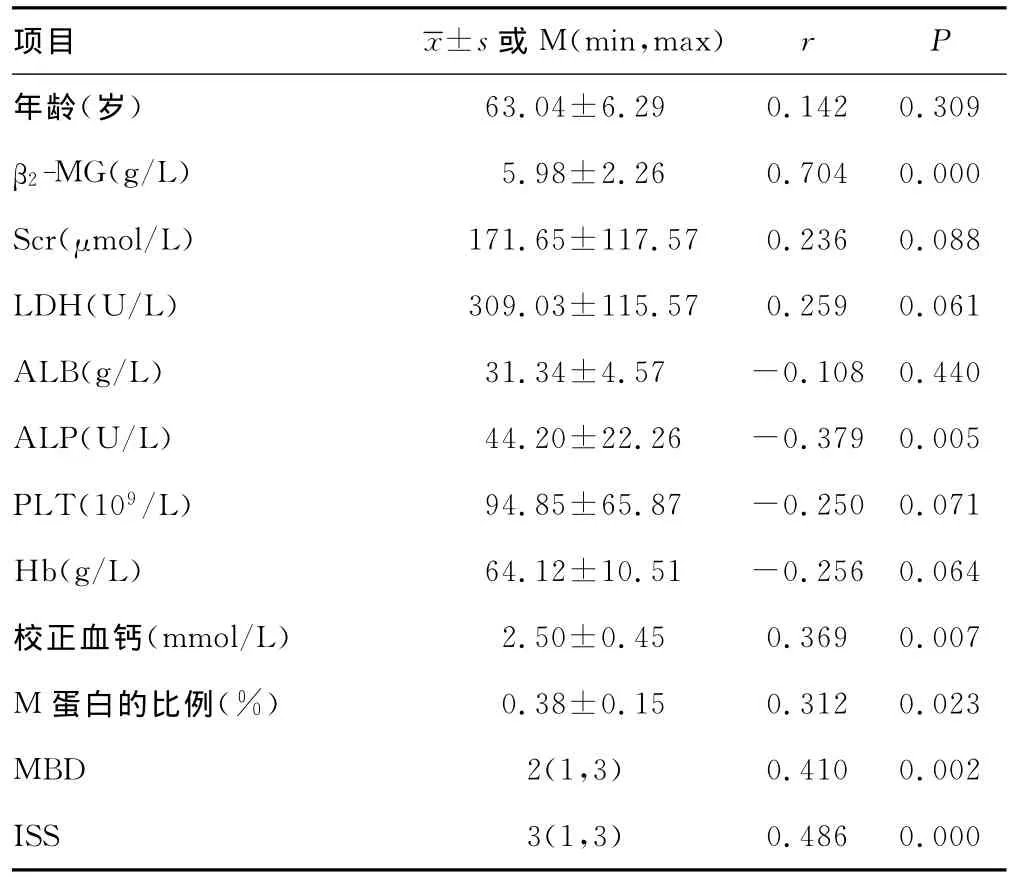
表1 sclerostin与MM患者主要临床指标的相关性(±s)
63.04±6.29 0.142 0.309 β2-MG(g/L) 5.98±2.26 0.704 0.000 Scr(μmol/L) 171.65±117.57 0.236 0.088 LDH(U/L) 309.03±115.57 0.259 0.061 ALB(g/L) 31.34±4.57 -0.108 0.440 ALP(U/L) 44.20±22.26 -0.379 0.005 PLT(109/L) 94.85±65.87 -0.250 0.071 Hb(g/L) 64.12±10.51 -0.256 0.064校正血钙(mmol/L) 2.50±0.45 0.369 0.007 M蛋白的比例(%) 0.38±0.15 0.312 0.023 MBD 2(1,3) 0.410 0.002 ISS 3(1,3)r P年龄(岁)项目±s或 M(min,max)0.486 0.000
2.3 sclerostin对患者中位生存期的影响 本研究中位随访时间29(6~65)个月,其中总体生存期大于或等于5年者3例(5.56%),大于或等于3年者21例(39.62%),大于或等于1年者48例(90.57%)。死亡15例(28.30%),1~3年内死亡10例,3~5年内死亡2例,5年以上死亡3例。4例死于复发或骨髓瘤未缓解;1例转为浆细胞白血病;2例死于心脑血管疾病;2例死于肾衰竭;6例死于化疗后骨髓抑制的严重并发症如重症感染、出血。根据对照组的sclerostin水平,将sclerostin≤0.43pg/mL定为低sclerostin组,高于0.43pg/mL定为高sclerostin组。在低sclerostin组中,19例患者在随访期间共14例生存,中位生存期为48(6~65)个月,95%CI 33.24~62.76;高sclerostin组中,34例患者在随访期间共24例生存,中位生存期为24(6~52)个月,95%CI15.43~32.57。经Kaplan-Meier生存曲线分析两组中位生存期,差异有统计学意义(χ2=12.74,P<0.01)。
3 讨 论
sclerostin是SOST基因的表达产物,是一种含胱氨酸结构的分泌型糖蛋白,是骨细胞分泌的成骨细胞的负调控因子,参与调节骨形成,决定骨重建过程中的骨量和结构[7]。目前国内关于sclerostin的研究主要集中在骨质疏松领域中,在骨髓瘤或其他恶性肿瘤导致的骨质破坏中少见报道,国外学者发现MM患者外周血sclerostin水平较健康人高,其骨质破坏严重的患者显著高于骨质破坏不明显、意义未明的单克隆球蛋白增多症的患者[8]。这暗示sclerostin在 MBD的发生、发展中可能起重要作用。本研究以骨髓为样本,研究sclerostin在MM患者骨髓中的表达及临床意义。
本研究发现,MM患者骨髓上清液中的sclerostin水平高于对照组,且复发难治的MM患者明显高于初诊患者及对照组。这说明MM患者骨髓细胞可能表达sclerostin,本研究还从分子水平进一步证实大部分MM患者表达sclerostin,有骨质破坏的患者表达阳性强于无骨质破坏的患者,且骨质破坏越明显,其sclerostin的表达阳性越明显。但表达sclerostin的BMMNC是骨髓瘤细胞还是骨髓基质细胞则有待进一步研究。复发难治的MM患者对化疗药物不敏感,瘤负荷高,瘤细胞与骨髓基质细胞黏附后分泌多种炎症因子导致瘤细胞或骨髓基质细胞持续表达更多的sclerostin。
本研究发现sclerostin与β2-MG、Ca2+、ALP、M 蛋白的比例、骨质损害评分和ISS分期均相关。ALP主要是由成骨细胞产生,ALP与sclerostin呈负相关,这与Brunetti等[8]的研究一致,说明sclerostin可能会抑制成骨细胞的活性,其机制可能是sclerostin阻止Wnt蛋白结合于卷曲蛋白1~10和低密度脂蛋白受体相关蛋白5/6,抑制β-链蛋白进入细胞质。从而阻抑Wnt经典信号通路,抑制了前体成骨细胞的生长和早期阶段的分化,导致OB数量下降,ALP的活性下降[9-10]。
校正血钙、骨质损害评分主要是反映骨质破坏情况,他们与sclerostin有明显的正相关。这说明sclerostin能反映骨质破坏情况,在MM中可能导致MBD,其具体机制目前不明,可能与巨噬细胞炎症蛋白1-α相关[11]。也可能通过抑制Wnt经典及非经典信号途径,导致细胞外基质成熟障碍、细胞外基质矿化降低及骨量减少[12-13],从而导致 MBD的发生。Brunetti等[8]发现MM患者外周血sclerostin与β2-MG呈正相关,本研究不仅验证这一点,还发现sclerostin与M蛋白的比例和ISS分期呈正相关。β2-MG、M蛋白、ISS临床分期能较好地反映体内瘤负荷水平,这说明sclerostin也能较好地反映瘤负荷及预后,是疾病预后不良的一项指标。其机制可能是sclerostin在抑制骨髓基质细胞向OB分化成熟的同时,导致白细胞介素-6及其他促进MM细胞生长的因子生成增多[14],瘤负荷增高;也可能是sclerostin通过抑制骨髄修复而促进肿瘤细胞的生长[15]。
本研究还发现,低sclerostin组患者中位生存期均高于高sclerostin组患者。本研究因样本数较少,采用为对照组x±2s为分界点,发现sclerostin大于0.43pg/mL是MM患者预后不良的一个指标。这说明sclerostin能较好地预测MM患者的生存期。其原因可能是该类患者存在较严重的骨质破坏如压缩性骨折或病理性骨质,需较长时间的卧床,机体的免疫功能差,容易并发肺部等脏器感染,并发症多;也可能是高水平sclerostin在抑制Wnt经典信号通路的过程中,白细胞介素-6等促进瘤细胞增殖的因子增多[15],瘤负荷高,耐药性增强,对药物敏感性差,缓解率及中位生存期低。
综上所述,sclerostin在MM患者骨髓上清液中的水平增高,其水平能反映MM患者骨质破坏、成骨受抑的程度及机体瘤负荷的水平,并能在一定程度反映患者的中位生存期,其增高机制还有待研究,为进一步治疗MM提供了新的治疗靶点。
[1] Kristinsson SY,Minter AR,Korde N,et al.Bone disease in multiple myeloma and precursor disease:novel diagnostic approaches and implications on clinical management[J].Expert Rev Mol Diagn,2011,11(6):593-603.
[2] Ortiz A,Lin SH.Osteolytic and osteoblastic bone metastases:two extremes of the same spectrum[J].Recent Results Cancer Res,2012,192(2):225-233.
[3] Qiang YW,Chen Y,Brown N,et al.Characterization of Wnt/beta-catenin signalling in osteoclasts in multiple myeloma[J].Br J Haematol,2010,148(5):726-738.
[4] Gavriatopoulou M,Dimopoulos MA,Christoulas D,et al.Dickkopf-1:a suitable target for the management of myeloma bone disease[J].Expert Opin Ther Targets,2009,13(7):839-848.
[5] 袁忠涛,李惠民.Dickkopf-1与骨髓瘤骨病的关系及其靶向治疗的研究进展[J].重庆医学,2012,41(16):1637-1640.
[6] Longo V,Brunetti O,D′Oronzo S,et al.Therapeutic approaches to myeloma bone disease:an evolving story[J].Cancer Treat Rev,2012,38(6):787-797.
[7] Papapoulos SE.Targeting sclerostin as potential treatment of osteoporosis[J].Ann Rheum Dis,2011,70(Suppl):119-122.
[8] Brunetti G,Oranger A,Mori G,et al.sclerostin is overexpressed by plasma cells from multiple myeloma patients[J].Ann N Y Acad Sci,2011,12(37):19-23.
[9] Colucci S,Brunetti G,Oranger A,et al.Myeloma cells suppress osteoblasts through sclerostin secretion[J].Blood Cancer J,2011,1(6):27-35.
[10]Engelhardt M,Kleber M,Udi J,et al.Current approaches in multiple myeloma and other cancer-related bone diseases[J].Dtsch Med Wochenschr,2012,137(20):1057-1061.
[11]Vallet S,Pozzi S,Patel K,et al.A novel role for CCL3(MIP-1a)in myeloma-induced bone disease via osteocalcin downregulation and inhibition of osteoblast function[J].Leukemia,2011,25(7),1174-1181.
[12]Gkotzamanidou M,Dimopoulos MA,Kastritis E,et al.Sclerostin:apossible target for the management of cancer-induced bone disease[J].Expert Opin Ther Targets,2012,16(8):761-769.
[13]Voskaridou E,Christoulas D,Plata E,et al.High circulat-ing sclerostin is present in patients with thalassemia-associated osteoporosis and correlates with bone mineral density[J].Horm Metab Res,2012,44(12):909-913.
[14]Terpos E,Fragiadaki K,Konsta M,et al.Early effects of IL-6receptor inhibition on bone homeostasis:apilot study in women with rheumatoid arthritis[J].Clin Exp Rheumatol,2011,29(6):921-925.
[15]Terpos E,Christoulas D,Katodritou E,et al.Elevated circulating sclerostin correlates with advanced disease features and abnormal bone remodeling in symptomatic myeloma:reduction post-bortezomib monotherapy[J].Int J Cancer,2012,131(6):1466-1471.
