精氨酸加压素对星形胶质细胞凋亡的影响
2013-09-17周敬华熊从珍庄伟华曹学兵
周敬华 熊从珍 庄伟华 曹学兵
精氨酸加压素(arginine vasopressin,AVP)在机体水的重吸收、血管收缩、促肾上腺皮质激素(ACTH)的分泌、记忆等中具有重要生理作用,其受体分为V1aR、V1bR和V2R,中枢神经系统中以V1R为主。在脑外伤、脑出血、脑梗死等病理过程中,中枢系统和外周AVP常异常升高,AVP水平升高是引起和加重脑水肿、导致病情恶化的重要因素。研究结果显示,脑梗死患者血浆AVP水平常明显升高,其升高程度与梗死容积和神经功能缺损评分呈正相关[1];颅脑损伤越重,血浆AVP水平越高,继发脑水肿越严重,持续时间越长[2]。V1aR拮抗剂可抑制脑损伤引起的脑水肿,保护神经细胞,但其通过何途径发挥神经保护作用尚未完全清楚。目前有关AVP水平异常升高是否能导致星形胶质细胞凋亡而影响神经功能尚未见相关报道。本实验探讨了不同浓度AVP对星形胶质细胞凋亡的影响及其相关细胞内信号途径,并探讨V1aR拮抗剂在此过程中的干预作用。
1 材料和方法
1.1 实验动物 新生1~3d的SD大鼠,雌雄不限,由华中科技大学同济医学院实验动物中心提供。
1.2 主要药品与试剂 包括[Arg8]-vasopressin(Sigma 公 司 )、 [β-Mercapto-β,β-cyclopentamethylenepropionyl1,O-Me-Tyr2,Arg8]-vasopressin(V1aR拮抗剂,Sigma公司)、SB 203580(p38 MAPK 抑制剂,Calbiochem 公 司)、In Situ Cell Death Detection试剂盒(Roche公司)、胎牛血清(杭州四季青生物工程材料有限公司)、DMEM/F12(Gibco)、超净台、培养瓶、相差显微镜等。
1.3 方法
1.3.1 星形胶质细胞分离培养与鉴定[3]:取SD大鼠,经75%(体积分数)的乙醇消毒后断头取脑,用预冷的D-hanks液冲洗3次后,在解剖显微镜下剥离软脑膜及血管组织,分离大脑皮质,将皮质剪成1mm3左右的小碎片。加入0.05%(质量浓度)胰蛋白酶后,37℃消化30min。然后加入含血清培养液终止消化,轻轻吹打使细胞分散后,以1000 r/min离心5min(离心半径=13cm)。吸上清,加入新鲜培养液,用吸管轻轻吹打至组织块消散;行贴壁处理以除去纤维细胞。用200目金属网过滤,将滤液离心(1000r/min,5min,离心半径=13 cm)。吸去上清液,将细胞以0.5×106个/mL的密度接种于50cm2培养瓶中。DMEM/F12培养基中添加10%(体积分数)胎牛血清。在5%(体积分数)CO2、37℃的培养箱内培养7~9d后置250 r/min的恒温摇床振荡15h,以分离少突胶质细胞。吸去悬液,剩余的贴壁细胞即为星形胶质细胞,再将其传代培养2次后,可得纯化的星形胶质细胞。采用免疫组织化学的方法鉴定胶质原纤维酸性蛋白(GFAP)阳性细胞。
1.3.2 星形胶质细胞存活率的测定:将第三代细胞随机分为4组:(1)对照组:用正常培养液进行培养;(2)500nmol/L AVP 组:用 含 500nmol/L AVP的培养液进行培养;(3)V1aR拮抗剂组:用同时含有500nmol/L AVP和500nmol/L V1aR拮抗剂的培养液进行培养;(4)SB 203580组:用同时含有10μmol/L SB 203580和500nmol/L AVP的培养液进行培养。各组均分别培养1、6、12、24 h。
实验步骤:将培养细胞按1×104个/mL密度接种到96孔板中,每孔接种200μL;培养2d后,吸出培养液,加入等量含上述试剂的培养液分别处理1、6、12、24h;再加入20μL 5g/L MTT,继续培养4h后,吸去培养液,加入150μL DMSO;然后振荡10min,采用酶联免疫检测仪测定490nm波长处吸光度(A)值。细胞存活率=实验组A值/对照组A值×100%。
1.3.3 细胞凋亡检测(TUNEL法):将细胞随机分为6组:对照组采用正常培养液培养;50、100、500nmol/L AVP组分别用含50、100、500nmol/L AVP的培养液处理;V1aR拮抗剂组用含500 nmol/L AVP和500nmol/L V1aR 拮抗剂的培养液处理;SB 203580组用含10μmol/L SB 203580和500nmol/L AVP的培养液处理。各组分别于处理1、6、12、24h后行凋亡检测。检测步骤:各时间点细胞玻片经丙酮固定,PBS洗;3%(体积分数)H2O2-甲醇液,室温10min;1%(体积分数)Triton X-100处理2min;PBS洗后,滴加 TUNEL反应混合液,凋亡细胞核呈棕色。随机选取5个视野(400倍光镜下),观察凋亡细胞个数,每张片子取其平均数。
1.4 统计学处理 利用SPSS12.0软件包进行分析,数据以均数±标准差表示,多组间均数比较采用单因素方差分析(One-Way ANOVA),两两比较采用Bonferroni方法。以P<0.05为差异有统计学意义。
2 结果
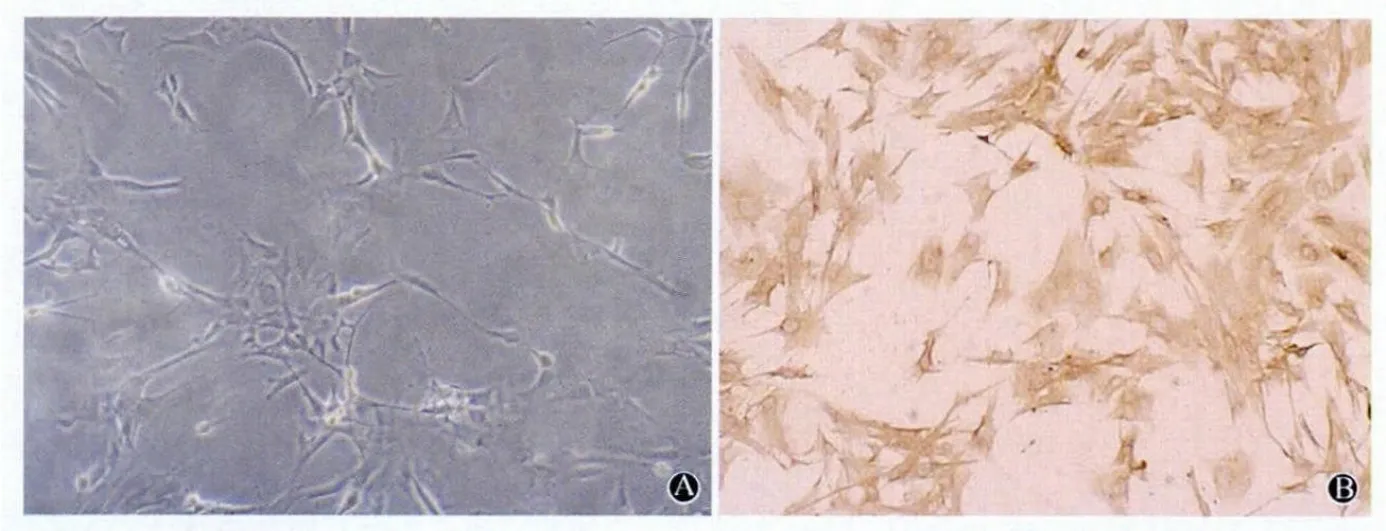
图1 星形胶质细胞培养与鉴定
2.1 星形胶质细胞的分离与鉴定 相差显微镜下观察,正常原代培养星形胶质细胞生长旺盛,轮廓清晰,突起丰富,呈放射状,突起间连接紧密(图1A)。用GFAP免疫组化染色鉴定,细胞纯度>98%(图1B)。
2.2 星形胶质细胞存活率的比较 与对照组比较,500nmol/L AVP组处理1h时星形胶质细胞存活率无明显变化,处理6、12、24h时其存活率下降(P<0.01),且24h时其存活率低于1、6、12h时间点(P<0.01)。V1aR拮抗剂组及SB 203580组各时间点存活率与对照组比较差异均无统计学意义(P>0.05)(表1)。
2.3 星形胶质细胞凋亡比较 对照组各时间点仅见极少数凋亡细胞,可能为细胞正常凋亡。500 nmol/L AVP处理6h后发现有较多凋亡细胞(P<0.01),随时间延长凋亡细胞数增多,24h达高峰(P<0.01)。V1aR拮抗剂组、SB 203580组各时间点凋亡细胞数差异无统计学意义(P>0.05),与对照组相应时间点比较凋亡细胞数差异也无统计学意义(表2、图2)。
表1 各组星形胶质细胞存活率比较 (±s,n=6,%)
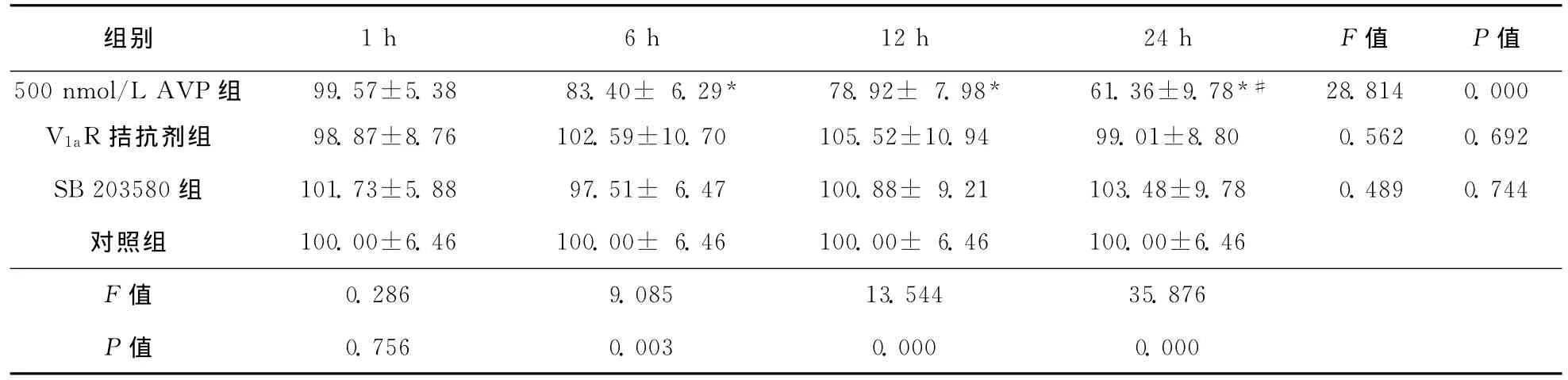
表1 各组星形胶质细胞存活率比较 (±s,n=6,%)
注:与对照组比较,*P<0.01;与同组1、6、12h时间点比较,#P<0.01
组别 1h 6h 12h 24h F值 P值500nmol/L AVP组 99.57±5.38 83.40± 6.29* 78.92± 7.98* 61.36±9.78*#28.814 0.000 V1aR拮抗剂组 98.87±8.76 102.59±10.70 105.52±10.94 99.01±8.80 0.562 0.692 SB 203580组 101.73±5.88 97.51± 6.47 100.88± 9.21 103.48±9.78 0.489 0.744对照组 100.00±6.46 100.00± 6.46 100.00± 6.46 100.00±6.46 F值0.756 0.003 0.000 0.000 0.286 9.085 13.544 35.876 P值
表2 各组星形胶质细胞凋亡比较 (±s,n=5,个)
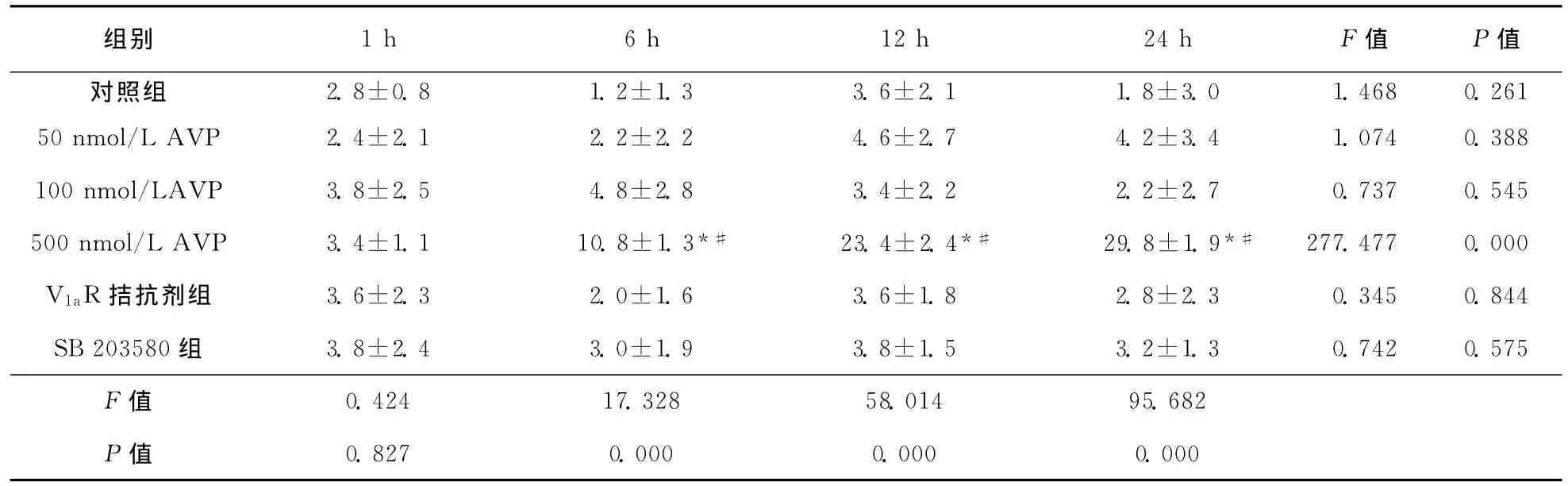
表2 各组星形胶质细胞凋亡比较 (±s,n=5,个)
注:与对照组比较,*P<0.01;与同组前一时间点比较,#P<0.01
组别 1h 6h 12h 24h F值 P值2.8±0.8 1.2±1.3 3.6±2.1 1.8±3.0 1.468 0.261 50nmol/L AVP 2.4±2.1 2.2±2.2 4.6±2.7 4.2±3.4 1.074 0.388 100nmol/LAVP 3.8±2.5 4.8±2.8 3.4±2.2 2.2±2.7 0.737 0.545 500nmol/L AVP 3.4±1.1 10.8±1.3*# 23.4±2.4*# 29.8±1.9*# 277.477 0.000 V1aR拮抗剂组 3.6±2.3 2.0±1.6 3.6±1.8 2.8±2.3 0.345 0.844 SB 203580组 3.8±2.4 3.0±1.9 3.8±1.5 3.2±1.3 0.742 0.575 F值对照组0.827 0.000 0.000 0.000 0.424 17.328 58.014 95.682 P值
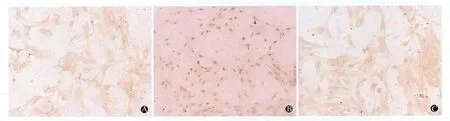
图2 各组星形胶质细胞凋亡情况(TUNEL×200)
3 讨论
星形胶质细胞对维持脑组织结构和功能具有重要作用,为神经元提供营养、保护和支持,还参与兴奋性氨基酸的代谢、信号传递、免疫调节和神经组织的修复。星形胶质细胞在神经系统损伤中所发挥的作用日益得到重视。
中枢释放的AVP对中枢神经系统内环境的稳定、细胞体积有调节作用。颅脑损伤后AVP常分泌异常增多,其机制涉及创伤后应激反应;下丘脑垂体轴激素变化;儿茶酚胺、肾上腺激素分泌增多刺激AVP[4];脑损伤后神经细胞受损,AVP可直接分泌入血或脑脊液;下丘脑功能障碍导致渗透压感受器阈值下降,失去正常生理情况下对渗透压变化的敏感性,削弱了渗透压对AVP分泌的调控,导致AVP长时间高水平分泌。脑组织异常升高的AVP水平会给脑组织损伤带来一定损伤。AVP可通过改变星形胶质细胞膜的通透性调节细胞体积,高水平AVP与V1aR结合后使细胞发生Ca2+超载,抑制神经细胞膜 Na+-K+-ATP酶的活性,并可激活星形胶质细胞膜上的Na+/K+/Cl-同向转运体,引起细胞内渗透压增高,从而导致细胞内钠水潴留[5],并可通过激活p38MAPK通路上调水通道蛋白-4的表达[6-7],导致血-脑脊液屏障受损,继发血管源性脑水肿的发生,对脑水肿形成有重要的影响。对低钠血症诱发的大鼠脑水肿进行弥散加权成像分析发现,侧脑室注射AVP后可明显降低其表观弥散系数[8]。AVP缺陷的Brattleboro大鼠大脑中动脉闭塞4h后,其脑组织水盐积聚分别较对照组Long-Evans种系大鼠减少了36%和20%[9]。高水平AVP除对星形胶质细胞体积有调节作用外,是否对星形胶质细胞存活与凋亡具有相应的影响,尚缺乏直接研究证实。
研究结果显示禁水可导致脑组织AVP、p53和Bcl-2凋亡蛋白合成同时增加[10]。由此可推测AVP表达和星形胶质细胞凋亡具有一定关联。这种关联很能存在于p38MAPK信号途径上。p38 MAPK可参与细胞凋亡,锰可强烈诱导PC12细胞内p38MAPK磷酸化进而使细胞凋亡,抑制p38MAPK通路可显著减少大鼠脑缺血后海马CA1区的凋亡神经元[11-12]。p38MAPK 通路与凋亡蛋白酶即半胱天冬蛋白酶-3(Caspase-3)有交互作用,p38MAPK也和即刻早期基因,如c-fos基因和c-jun基因的调控有关,它们是程序性细胞死亡的重要调节基因。
该研究通过采用不同浓度AVP干预星形胶质细胞,研究其凋亡情况及存活状况,以期揭示脑损伤后AVP引起脑继发性损伤的发生机制。研究结果显示,50nmol/L AVP、100nmol/L AVP对星形胶质细胞凋亡无显著影响;而500nmol/L AVP能诱导星形胶质细胞凋亡,细胞存活率下降;在阻断V1aR后发现星形胶质细胞凋亡数明显减少,存活率明显增加;使用p38MAPK抑制剂SB 203580处理后,对500nmol/L AVP诱导的星形胶质细胞存活率下降具有显著抑制作用,凋亡细胞数量同样明显减少,表明AVP诱导星形胶质细胞凋亡具有剂量依赖关系,推测高水平AVP通过V1aR持续过度激活p38MAPK信号途径,启动下游 Caspase-3、c-fos、c-jun等引起星形胶质细胞凋亡。另外,该研究结果表明V1aR拮抗剂和p38 MAPK抑制剂对AVP诱导的星形胶质细胞凋亡具有一定的遏制作用。
AVP涉及脑细胞水、电解质平衡的调节,长时间过度刺激可以导致星形胶质细胞肿胀,激活p38 MAPK途径导致星形胶质细胞凋亡。此种改变在脑损伤后的脑水肿和继发性脑损伤中有着重要作用。脑损伤后,抑制AVP与受体结合,或者阻断p38MAPK途径,可能有利于保护星形胶质细胞,维持血-脑脊液屏障完整性,减轻脑水肿。
[1]Barreca T,Gandolfo C,Corsini G,et al.Evaluation of the secretory pattern of plasma arginine vasopressin in stroke patients[J].Cerebrovasc Dis,2001,11:113-118.
[2]黄卫东,苏伟,徐妙,等.急性颅脑损伤后精氨酸加压素动态变化的临床研究[J].中华创伤杂志,2006,22:190-193.
[3]章静波.组织和细胞培养技术[M].北京:人民卫生出版社,2002.104-105.
[4]Grundy PL,Harbuz MS,Jessop DS,et al.The hypothalamopituitary-adrenal axis response to experimental traumatic brain injury[J].J Neurotrauma,2001,18:1373-1381.
[5]Hertz L,Chen Y,Spatz M.Involvement of non-neuronal brain cells in AVP-mediated regulation of water space at the cellular,organ,and whole-body level[J].J Neurosci Res,2000,62:480-490.
[6]师忠芳,赵焕英,袁芳,等.MAPKs信号通路干预对体外培养大鼠星形胶质细胞划痕损伤后水通道蛋白4表达的影响[J].首都医科大学学报,2010,31:228-231.
[7]周敬华,曹学兵,孙圣刚.精氨酸加压素对星形胶质细胞水孔蛋白-4表达的调节及脑水肿形成影响的研究[J].中风与神经疾病杂志,2008,25:567-569.
[8]Vajda Z,Pedersen M,Doczi T,et al.Effects of centrally administered arginine vasopressin and atrial natriuretic peptide on the development of brain edema in hyponatremic rats[J].Neurosurgery,2001,49:697-705.
[9]Dickinson LD,Betz AL.Attenuated development of ischemic brain edema in vasopressin-deficient rats[J].J Cereb Blood Flow Metab,1992,12:681-690.
[10]Chernigovskaya EV,Taranukhin AG,Glazova MV,et al.Apoptotic signaling proteins:possible participation in the regulation of vasopressin and catecholamines biosynthesis in the hypothalamus[J].Histochem Cell Biol,2005,124:523-533.
[11]HirataY.Manganese-induced apoptosis in PC12cells[J].Neurotoxicol Teratol,2002,24:639-653.
[12]Dohi K,Mizushima H,Nakajo S,et al.Pituitary adenylate cyclase-activating polypeptide(PACAP)prevents hippocampal neurons from apoptosis by inhibiting JNK/SAPK and P38signal transduction pathways[J].Regul Pept,2002,109:83-88.
