大鼠脑梗死后脑组织TNF-α、GFAP、NSE、BDNF、Nestin的表达和神经功能变化
2013-09-17张昆南曹金娟刘世民胡国柱李沁妤杨海玉吴梨华吴晓牧
张昆南 曹金娟刘世民 胡国柱 李沁妤 杨海玉 吴梨华 吴晓牧
脑梗死已成为我国第二大死亡病因,且是导致后天性残疾的重要原因[1]。脑梗死可引起梗死区及周围组织严重缺血缺氧,从而导致细胞水肿,组织兴奋性中毒,致使神经功能受到损害。脑缺血后反应性星形胶质细胞增生并产生胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP),急性期反应性胶质细胞增生具有神经保护作用,而后期可形成疤痕组织影响神经元的修复[2]。肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)由激活的巨噬细胞/单核细胞分泌,是种多效性的促炎细胞,脑梗死后能快速分泌并达高峰。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)在中枢神经系统发育中起重要作用,同时维持成熟神经的正常功能。巢蛋白(Nestin)在神经胚胎形成阶段一过性、特异性地表达于神经内皮干细胞,并在神经前体细胞进行神经元终末分化后表达下调,因而,Nestin可作为神经前体细胞的标志。神经元特异性烯醇化酶(neuron-specific enolase,NSE)是神经元的特异性标记物[3]。脑梗死区周围神经及胶质细胞的炎症坏死及营养和增殖是影响其神经功能的重要因素。本研究观察大脑中动脉缺血再灌注(middle cerebral artery occlusion,MCAO)大鼠急性期及亚急性期脑组织TNF-α、GFAP、NSE、BDNF、Nestin的表达,旨在探讨脑梗死不同时期的脑组织炎症及其神经和胶质细胞变化特征,以期为脑梗死的治疗提供实验依据。
1 材料和方法
1.1 实验材料 Sprague-Dawley雄性大鼠30只(湖南斯莱克景达实验动物有限公司,合格证号:HNASLKJ20123909,SPF级),体质量250~300 g,20~25℃室温,昼夜比1∶1,自然进水和食物饲养;栓线(北京东沙生物技术有限公司,AAAA级);免疫组化试剂盒(北京中杉金桥生物技术有限公司);GFAP(Abcam 公司);NSE(Abcam 公司);BDNF(Abcam公司);Nestin(Abcam 公司);TNF-α(Abcam公司);光学显微镜(Leica,DM3000)。
1.2 方法
1.2.1 MCAO模型制作与分组:参照Longa等[4]线栓法制作大鼠MCAO模型。所有的动物术前禁食不禁水12h,以10%(体积分数)水合氯醛(0.3mL/100mg)腹腔注射麻醉,维持肛温37℃,背位固定,取颈部正中切口,分离右侧颈总动脉、颈内动脉和颈外动脉,结扎、剪断颈外动脉。从颈外动脉残端插入直径为0.26mm栓线至大脑前动脉,深度约为18~22mm,以阻断大脑中动脉血液供应,缝合皮肤组织,2h后将栓线拔至颈外动脉残端以实现再灌注。采用随机数字法将大鼠随机分为 MCAO术后1d组(n=5),3d组(n=6),7d组(n=6),14d组(n=6),21d组(n=7)。
1.2.2 改良神经功能缺损严重程度量表评分(mNSS):MCAO术后1、3、7、14、21d对大鼠进行mNSS评分[5]。mNSS评分包括运动、感觉、反射和平衡木4项测试,满分为18分,不能执行任务或反射缺乏加1分,13~18分为重度损伤,7~12分为中度损伤,1~6分为轻度损伤。术后第1天mNSS评分为7~12分者纳入实验。
1.2.3 免疫组化染色:分别于 MCAO术后1、3、7、14、21d经水合氯醛腹腔麻醉大鼠,开胸、开腹,夹闭腹主动脉,将连有输液器的针头插入左心室并剪开右心耳,先灌注150mL生理盐水,随后再用4%(质量浓度)多聚甲醛进行灌注。待灌注完成后取出大脑,将脑组织放入装有4%(质量浓度)多聚甲醛的容器中固定4~6h,取脑梗死中心区脑组织(约为冠状位前囟-1.0~+1.0mm)石蜡包埋,石蜡切片,片厚4μm,用于免疫组化染色。采用微波修复,切片置于浓度为0.01mol/L、pH6.0的枸橼酸缓冲液中,置微波炉中100℃沸腾3次,再微波炉调至30℃,15min,取出自然放凉至室温。二步法免疫组化反应:以3%(质量浓度)H2O2去离子水孵育5~10min,PBS冲洗2min×3次;滴加一抗,分别为 GFAP(1∶2500)、NSE(1∶750)、BDNF(1∶100)、Nestin(1∶170)、TNF-α(1∶1000),放入湿盒4℃孵育过夜,PBS冲洗2min×3次;滴加山羊抗兔HRP标记IgG抗体,室温30 min,PBS冲洗2min×3次;DAB显色,蒸馏水充分冲洗;复染-脱水-透明-中性树胶封片。阴性对照用磷酸盐缓冲液取代一抗,其余步骤同前。
1.2.4 图像采集与分析:光学显微镜采集图像,每只大鼠每个指标取2张玻片,并按图1示意采集图片。采用Image pro-Plus 5.1 软 件计数 GFAP、NSE、Nestin、TNF-α,计算BDNF、NSE的累积吸光度(IOD)值。
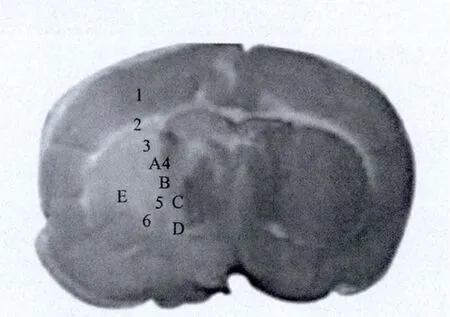
图1 免疫组化检测各指标采集大鼠脑脑梗死区域示意图
1.3 统计学处理 运用SPSS 20.0统计软件进行分析,数据以均数±标准差表示,采用单因素方差分析,若方差齐性,两两比较采用LSD法进行多个样本均数的多重比较;若方差不齐则采用Dunnett T3法进行样本均数的多重比较。以P<0.05表示有统计学差异。
2 结果
2.1 神经功能评分 MCAO大鼠神经功能评分随时间推移逐渐下降,除14d组与21d组之间比较其mNNS评分无统计学差异之外,余各时间点比较均有统计学差异(P<0.05)(表1)。
2.2 各组大鼠脑组织GFAP的表达 GFAP+细胞主要聚集在梗死区周围,随时间的推移其阳性细胞数逐渐增多,胞体增大,突起多且粗大,7d达高峰(P<0.05);而后细胞数量减少,胞体较小且细胞突起变少而纤长(表1,图2)。
2.3 MCAO大鼠脑组织NSE的表达 NSE+细胞数随时间的延长逐渐增多,且细胞着色更均匀(图2),其中1d组显著小于3、7、14、21d组,21d显著大于3、7d组(P<0.05),余各组两两比较无统计学差异(表1)。
2.4 各组大鼠脑组织BDNF的表达 BDNF+细胞着色主要位于胞浆和细胞膜表面胞浆,而核周围染色较浅(图2)。BDNF的IOD值在14d下降至最低值,而后上升,其中1d组和21d组大于14d组(P<0.05),余各组两两比较无统计学差异(表1)。
2.5 各组大鼠脑组织Nestin的表达 Nestin+细胞在再灌注后7d达高峰,胞体变大,染色增强(图2),7d组明显高于1d、3d组(P<0.05),余各组两两比较无统计学差异(表1)。
2.6 MCAO大鼠脑组织TNF-α的表达 各组大鼠脑组织TNF-α表达无统计学差异,但1d组至7 d组TNF-α+细胞有增加趋势,其后则有逐渐下降趋势(表1,图2)。
表1 大鼠脑缺血再灌注后不同时间点mNSS评分及脑组织各指标表达比较 (±s)
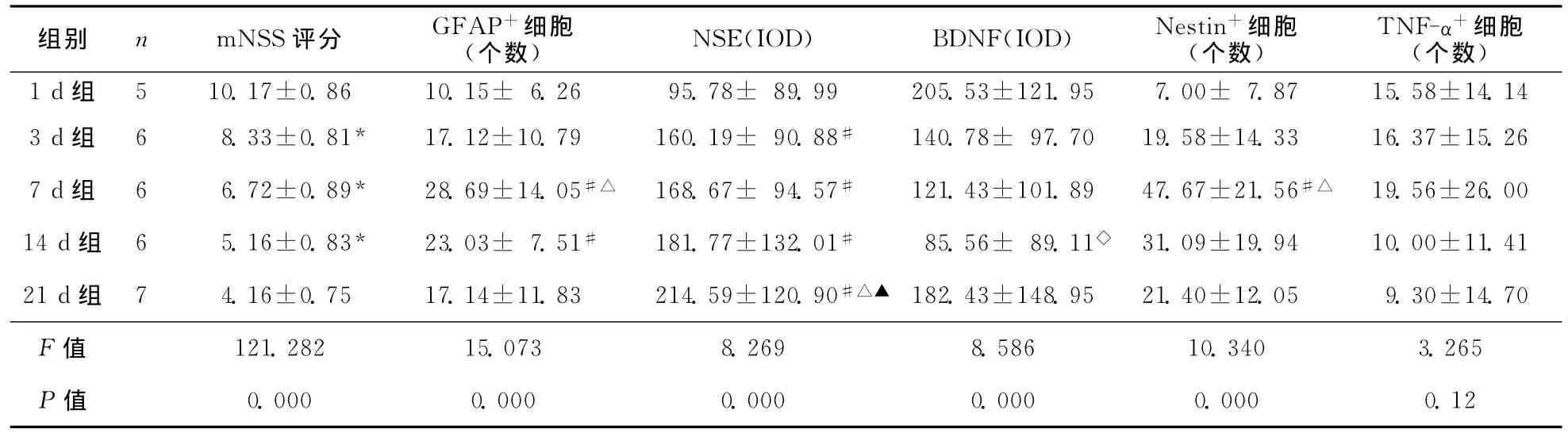
表1 大鼠脑缺血再灌注后不同时间点mNSS评分及脑组织各指标表达比较 (±s)
注:与前一时间点比较,*P<0.05;与1d组比较,#P<0.05;与3d组比较,△P<0.05;与7d组比较,▲P<0.05;与1d组和21d组比较,◇P<0.05
组别 n mNSS评分 GFAP+细胞(个数)NSE(IOD)BDNF(IOD)Nestin+细胞(个数)TNF-α+细胞(个数)121.95 7.00± 7.87 15.58±14.14 3d组 6 8.33±0.81* 17.12±10.79 160.19± 90.88# 140.78± 97.70 19.58±14.33 16.37±15.26 7d组 6 6.72±0.89* 28.69±14.05#△ 168.67± 94.57# 121.43±101.89 47.67±21.56#△ 19.56±26.00 14d组 6 5.16±0.83* 23.03± 7.51# 181.77±132.01# 85.56± 89.11◇ 31.09±19.94 10.00±11.41 21d组 7 4.16±0.75 17.14±11.83 214.59±120.90#△▲ 182.43±148.95 21.40±12.05 9.30±14.70 F值1d组 5 10.17±0.86 10.15± 6.26 95.78± 89.99 205.53±0.000 0.000 0.000 0.000 0.000 0.12 121.282 15.073 8.269 8.586 10.340 3.265 P值
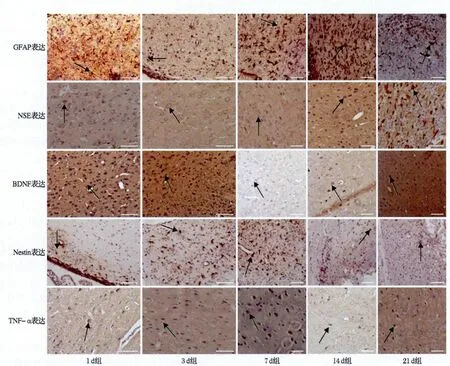
图2 大鼠脑缺血再灌注后梗死灶周围脑组织GFAP、NSE、BDNF、Nestin及TNF-α表达(箭头所示,免疫组化,DAB显色,比例尺=50.0μm)
3 讨论
脑梗死病理过程复杂,多种细胞及细胞因子直接或间接参与脑组织缺血性炎症及脑组织修复过程,然而目前对脑梗死在急性期和亚急性期中一些与脑组织炎症、神经及胶质细胞修复等相关蛋白及细胞因子的变化规律却缺乏系统性研究,因此对于临床早期干预治疗缺乏足够的研究结果支持,影响患者的康复。
TNF-α由激活的巨噬细胞/单核细胞分泌,在炎症反应、细胞免疫等病理生理中发挥着重要作用。大量研究证实脑缺血伴随着炎症的产生,而缺血再灌注后剧烈的炎症反应能加重神经元的损伤[6-8]。促炎因子 TNF-α是导致大脑缺血再灌注损伤的重要介质之一[9]。Sunwoo等[10]报道减少炎症细胞的产生对MCAO大鼠神经元具有保护作用。但同时也有报道指出,TNF-α能刺激星形胶质细胞和小胶质细胞的增生和活化[11-12],从而产生抗炎等作用。TNF基因敲除实验研究也证实TNF具有神经保护作用[13]。本研究结果显示,脑缺血再灌注急性期时随时间推移TNF-α表达逐渐上调,在7d达高峰,后则逐渐下降,炎症开始减轻,神经功能则逐渐好转,提示缺血再灌注后伴随产生的TNF-α在早期诱导释放强效的血管活性物质,导致脑血管收缩,降低局部血流量,促使脑组织缺血。高浓度TNF-α促使星形胶质细胞活化而维持细胞内外离子平衡,减少谷氨酸盐等,从而启动脑组织损伤的修复,促进神经功能恢复[14]。本研究结果显示TNF-α在各组间表达水平无统计学差异,这可能与样本量不足有关。
脑缺血损伤导致星形胶质细胞增生、活化并高表达GFAP。星形胶质细胞增生加速摄取兴奋性毒素谷氨酸盐[15],促进血管再生,稳定细胞外流体及离子平衡,减少血管性水肿[16],参与脑组织重建[17]。Schmidt-Kastner 等[18]报 道 脑 缺 血 后GFAP阳性细胞数在2d开始升高,8d达高峰。本研究发现GFAP阳性细胞数在1~7d逐渐增加并达高峰,神经功能也有所改善,这与文献报道相一致。TNF-α能刺激星形胶质细胞和小胶质细胞增生和活化[11-12],从而促进神经功能恢复。本研究亦发现在脑缺血再灌注急性期TNF+细胞有升高趋势,至第7天达高峰,随后有下降趋势,但各时间点间比较无统计学差异,同时GFAP+细胞表达亦达高峰,表明急性期炎症的结束。在急性期,反应性星形胶质细胞增生维持缺血半暗带离子浓度,形成阻止谷氨酸释放的屏障,保护缺血半暗带,为神经元提供能量[19],亚急性期星形胶质细胞下降以减轻胶质瘢痕对新生神经元和突触的不利作用,从而利于神经功能的恢复。
BDNF能促进神经和血管的生成[20],改善运动功能[21],并促进感觉器官的恢复[22]。BDNF基因敲除小鼠表现出大脑发育、感觉神经系统缺陷,常在出生后即死亡[23]。BDNF增加自由基清道夫的活性,减少氧自由基诱导的神经元凋亡;调节细胞外钙流入或释放细胞内储存钙维持细胞内钙浓度,从而抑制氨基酸兴奋性中毒[24];促进神经干细胞的分化和神经细胞生长,故BDNF对神经具有保护作用。本研究结果显示,BDNF出现双峰反应,缺血再灌注后第1天神经细胞应激性分泌增加,随后下降,而第21天上升,这可能是缺血损伤后神经细胞第7天后缓慢增殖和成熟产生BDNF,事实上大鼠神经功能也在逐渐恢复。提示BDNF促进了神经和血管生成,减少氧自由基,抑制氨基酸兴奋性中毒,促进神经功能的好转。
Nestin属于Ⅵ类中间纤维丝蛋白,特异性地表达在神经上皮干细胞和反应性胶质细胞上,对神经元的分化起作用。Nestin在大脑损伤、缺血、炎症等病理情况下可重新表达[25],现已证明脑损伤后反应性星形胶质细胞重表达Nestin蛋白对细胞具有保护作用,从而使其免受损伤后低氧等带来的一系列损害[26]。Yu等[27]研究发现,增加大鼠海马区Nestin阳性细胞能促使缺血再灌注后功能的恢复。本研究结果显示,再灌注后第7天Nestin增加达高峰,其表达水平与GFAP相随。推测Nestin阳性神经干细胞或GFAP阳性的反应性胶质细胞产生的Nestin促进神经干细胞分化,导致NSE阳性的神经细胞分化成熟,神经功能逐渐修复。因而,延长Nestin的持续时间及增强其作用可以作为未来临床治疗中枢神经系统损伤的手段之一。
NSE是一种酸性可溶性蛋白质,存在于神经细胞。烯醇酶参与催化a磷酸甘油酸生成磷酸烯醇式丙酮酸,这对维持神经系统正常生理功能极为重要。本研究结果显示,随时间推移NSE值逐渐上升,并与神经功能评分变化趋势相反,其原因可能与缺血缺氧状态下神经元的存活需要NSE提供大量ATP以满足核酸合成的需求有关[28]。NSE的逐渐增加也证明Nestin在早期的升高和后期的维持促进了神经干细胞向成熟的神经元分化,其有助于神经功能的恢复。
综述所述,随时间迁移,MCAO大鼠神经功能呈现出自我修复的过程。急性期,GFAP、Nestin表达的增加提示其能保护缺血半暗带,为神经元提供能量,促进神经干细胞分化。TNF-α表达提示在缺血再灌注后早期其可诱导释放强效的血管活性物质,导致脑血管收缩,降低局部血流量,促使脑组织缺血和炎症的发展。急性期后,BDNF、NSE表达上调可为受损脑细胞、神经元提供营养物质,利于神经功能的恢复。因此,MCAO在急性期(7 d前)受损脑组织产生炎症及抗炎反应明显,急性期后(7d后)以神经生长因子产生并促进神经再生为主,对今后脑梗死的基础研究及治疗提供新的策略。
[1]Zhou XQ,Zeng XN,Kong H,et al.Neuroprotective effects of berberine on stroke models in vitro and in vivo[J].Neuroscience Letters,2008,447:31-36.
[2]Davies SJ,Goucher DR,Doller C,et al.Robust regeneration of adult sensory axons in degenerating white matter of the adult rat spinal cord[J].J Neurosci,1999,19:5810-5822.
[3]Vinores SA,Herman MM,Rubinstein LJ,et a1.Electron microscopic 1ocalization of neuron-specific enolase in rat and mouse brain[J].J Histochem Cytochem,1984,32:1295-1302.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[5]Shen LH,Li Y,Chen J,et al.Intracarotid transplantation of bone marrow stromal cells increases axon-myelin remodeling after stroke[J].Neuroscience,2006,137:393-399.
[6]del Zoppo G,Ginis I,Hallenbeck JM,et al.Inflammation and stroke:putative role for cytokines,adhesion molecules and iNOS in brain response to ischemia[J].Brain Pathology,2000,10:95-112.
[7]Iadecola C,Alexander M.Cerebral ischemia and inflammation[J].Curr Opin Neurol,2001,14:89-94.
[8]Barone FC,Arvin B,White BS,et al.Tumor necrosis factoralpha.A mediator of focal ischemic brain injury[J].Stroke,1997,28:1233-1244.
[9]Zheng Z,Yenari MA.Post-ischemic inflammation:molecular mechanisms and therapeutic implications [J].Neurol Res,2004,26:884-892.
[10]Sunwoo YY,Park SI,Chung YA,et al.A pilot study for the neuroprotective effect of Gong jin-dan on transient middle cerebral artery occlusion-induced ischemic rat brain[J].Evid Based Complement Alternat Med,2012,2012:682720.
[11]Dopp JM,Mackenzie-Graham A,Otero GC,et al.Differential expression,cytokine modulation,and specific functions of type-1and type-2tumor necrosis factor receptors in rat glia[J].J Neuroimmunol,1997,75:104-112.
[12]Selmaj K,Farooq M,Norton WT,et al.Proliferation of astrocytes in vitro in response to cytokines.A primary role for tumor necrosis factor[J].J Immunol,1990,144:129-135.
[13]Bruce AJ,Boling W,Kindy MS,et al.Altered neuronal and microglial responses to excitotoxic and ischemic brain injury in mice lacking TNF receptors[J].Nat Med,1996,2:788-794.
[14]Sofoniew MV.Molecular dissection of reactive astrogliosis and glial scar formation[J].Trends Neurosci,2009,32:638-647.
[15]Silver J,Miller JH.Regeneration beyond the glial scar[J].Nat Neurosci,2004,5:146-156.
[16]Zador Z,Stiver S,Wang V,et al.Role of aquaporin-4in cerebral edema and stroke[J].Handb Exp Pharmacol,2009,190(Ⅱ):159-170.
[17]Cinthia F,Francesca A,Edgar M.Astrocytes are active players in cerebral innate immunity[J].Trends Immunol,2007,28:138-145.
[18]Schmidt-Kastner R,Wietasch K,Weigel H,et al.Immunohisto-chemical staining for glial fibrillary acidic protein(GFAP)after deafferention or ischemic infarction in rat visual system:features of reactive and damaged astrocytes[J].Int J Dev Neurosci,1993,11:157-174.
[19]张昆南,刘世民,胡国柱,等.脑缺血再灌注恢复期大鼠梗死周围组织GFAP、NSE、SYN、Nogo-A表达与神经功能转归的相关性[J].国际脑血管病杂志,2011,19:220-225.
[20]Schabitz WR,Steigleder T,Cooper-Kuhn CM,et al.Intravenous brain-derived neurotrophic factor enhances poststroke sensorimotor recovery and stimulates neurogenesis [J].Stork,2007,38:2165-2172.
[21]Murphy TH,Corbett D.Plasticity during stroke recovery:from synapse to behaviour[J].Nat Rev Neurosci,2009,10:861-872.
[22]Muller HD,Hanumanthiah KM,Diederich K,et al.Brainderived neurotrophic factor but not forced arm use improves long-term outcome after photothrombotic stroke and transiently upregulates binding densities of excitatory glutamate receptors in the rat brain[J].Stroke,2008,39:1012-1021.
[23]Ernfors P,Kucera J,Lee KF,et al.Studies on the physiological role of brain-derived neurotrophic factor and neurotrophin-3in knockout mice[J].Int J Dev Biol,1995,39:799-807.
[24]Wang Y,Cao M,Liu AQ,et al.Changes of inflammatory cytokines and neurotrophins emphasized their roles in hypoxic-ischemic brain damage[J].Int J Neurosci,2012,7:1-5.
[25]Tamagno I,Schiffer D.Nestin expression in reactive astrocytes of human pathology[J].J Neurooncol,2006,80:227-233.
[26]Gu H,Wang S,Messam CA,et al.Distribution of nestin immunoreactivity in the normal adult human forebrain[J].Brain Res,2002,943:174-180.
[27]Yu DQ,Pei HT,Zhang PH,et al.Effects of electroacupuncture on the expression of nestin in endogenous neural stem cell in hippocampus in rats with focal cerebral ischemia-reperfusion[J].Zhongguo Zhen Jiu,2010,30:929-932.
[28]Barone FC,Clark RK,Price WJ,et al.Neuron-specific enolase increases in cerebral and systemic circulation following focal ischemia[J].Brain Res,1993,623:77-82.
