大肠埃希菌DH5α感受态细胞转化率变化的研究
2013-09-12桓明辉关艳丽
桓明辉,关艳丽,陈 飞
(辽宁省微生物科学研究院,辽宁朝阳 122000)
DH5α是一种常用于质粒克隆的菌株。E.coli DH5α在使用pUC系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补,可用于蓝白斑筛选鉴别重组菌株。感受态细胞的制备和转化是分子生物学实验室频繁使用的一项重要的常规操作。对细菌而言,为达到高效转化,活细胞数务必少于108细胞/mL。对于大多数E.coli来说,相当于 OD600为 0.4 左右,但由于转化是一个很复杂的过程,具体的作用机理仍在探究中。有文献指出[1],细菌的最佳感受态细胞制备期对于不同菌株是不同的,并不一定都是在活细胞浓度为108细胞/mL的时候最适宜,有必要针对所使用的菌株确定其最佳转化条件。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 E.coli DH5α,pUC18质粒由本实验室保存。
1.1.2 试剂 X-gal,IPTG,LB培养基,氨苄青霉素溶液,0.1 mol/L CaCl2溶液,均按《分子克隆实验指南》的要求配制。
1.2 方法
1.2.1 大肠埃希菌生长情况的测定[2-3]从平板上挑取单个菌落(直径2~3 mm)到含有30 mL LB培养基的锥形瓶中,37℃下250 r/min培养过夜。取出0.3 mL培养物到含有15 mL LB培养基试管中,继续振荡培养,每隔20 min取出1支试管,放于冰箱。统一测定菌液的OD600,绘制生长曲线。选取几个不同时相的菌液倍比稀释从10-1~10-6,各取0.1 mL稀释液涂布 LB 平板培养基,37℃正向培养1 h后,倒置培养12~16 h。每个稀释度铺3个平板,计数,作OD600-活菌细胞浓度图。
1.2.2 标准质粒制备[4]利用裂解法抽提pUC18质粒,琼脂糖凝胶电泳检测,紫外分析仪下观察,将显示为超螺旋DNA带型的凝胶切下,利用透析袋法进行回收后,电泳确保质粒全部为超螺旋状态,测定其浓度及纯度,IE缓冲液稀释为0.05 μg/mL,保存于 -20 ℃。
1.2.3 大肠埃希菌感受态细胞制备及转化[5-7]37℃下250 r/min培养过夜的大肠埃希菌培养物,按1∶40接种于15 mL LB培养基的试管中,继续振荡扩大培养。根据生长曲线,每隔一定时间取1支菌液,测定OD600后,1.5 mL转入10 mL无菌离心管,冰浴中冷却10 min,4℃,4 000 r/min离心10 min,弃上清,用1/2体积的预冷0.1 mol/L CaCl2溶液悬浮细胞,冰浴中放置30 min,4℃,4 000 r/min离心10 min。根据OD600-活菌细胞浓度图,加入一定体积的0.1 mol/L CaCl2溶液,调整细胞浓度为2.5×109细胞/mL,取200 μL感受态细胞,分装到1.5 mL无菌离心管,4℃保存过夜。加入0.1 g质粒DNA,冰浴30 min后42℃热休克60~90 s,冰浴中迅速冷却2~3 min,加入0.8 mL LB培养基,37℃低速振荡培养1 h,室温,4 000 r/min 离心5 min,吸去0.9 mL 培养基,混匀剩余培养物,全部涂布在加有X-gal,IPTG及氨苄青霉素的LB平板培养基上,37℃正向培养1 h后,倒置培养12~16 h,每个时相涂布9个平板,并以未加质粒DNA的转化液作对照。
2 结果与分析
2.1 E.coil DH5α的生长曲线
在菌株与菌株之间,OD值与每毫升中活细胞数间的关系变化很大,因此有必要通过测定特定E.coli的生长培养物在生长周期的不同时相的OD600,从0~10 h,测定细菌不同生长时期的OD600,绘制生长曲线。为保证细菌培养物的生长密度不至过高,应每隔15~20 min检测OD600(表1)。得到E.coli DH5α的生长曲线(见图1),以便预测培养物的OD600达到0.4的培养时间。如图1所示,该生长曲线主要包括了E.coli DH5α在37℃培养条件下群体生长周期中的迟缓期、对数期及稳定期初期。
2.2 E.coli DH5α的 OD600-活菌细胞浓度图
将10-4、10-5、10-6稀释度的培养物涂布于无抗生素的LB平板培养基上以计算每一时相的活细胞数,选取一组数据(见表2)经线性化处理得E.coli DH5α 的 OD600-活菌细胞浓度图(图2),使分光光度计读数得到标准化。由图2可看出细菌细胞浓度与菌液光密度值成正比。
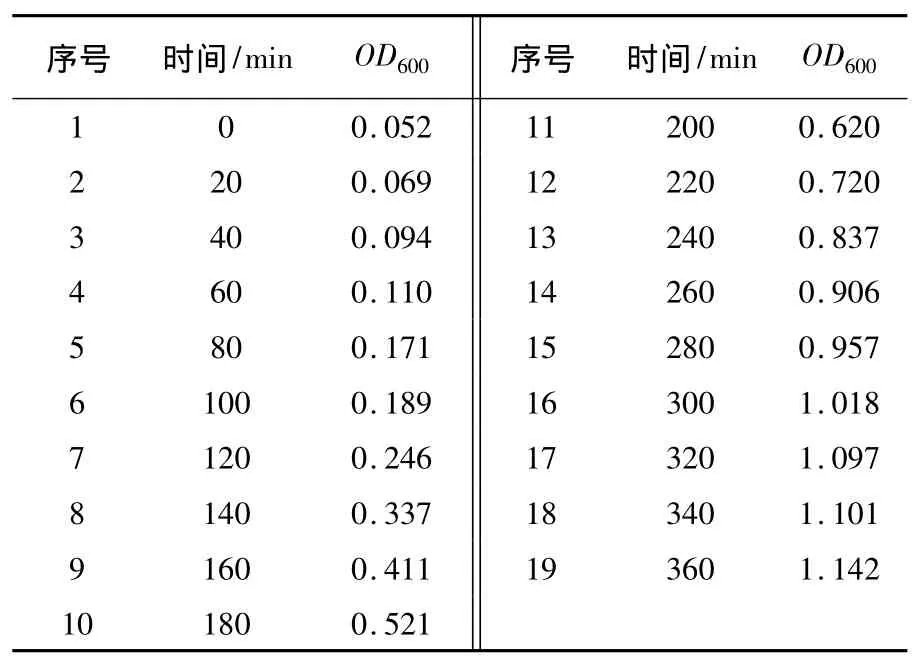
表1 E.coli DH5α的生长曲线Table 1 Growth curve of E.coli DH5α

图1 E.coli DH5α的生长曲线Fig.1 Growth curve of E.coli DH5α
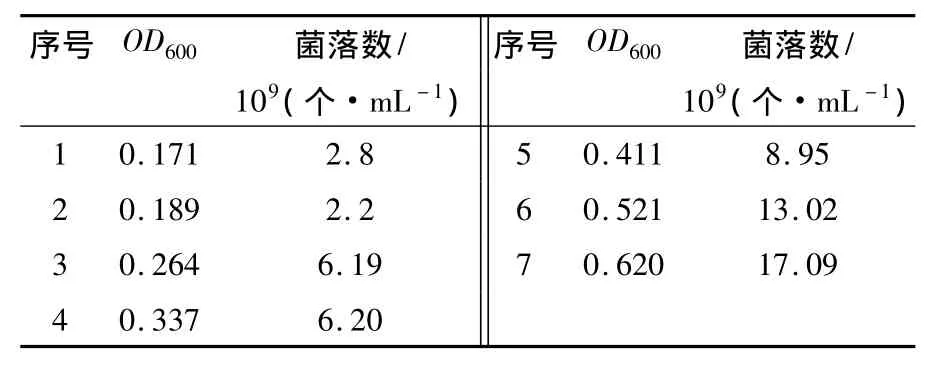
表2 E.coil DH5α的OD600-活菌细胞浓度Table 2 E.coil DH5α 的OD600-Viable cell concentration
2.3 不同生长时期的E.coli DH5α菌株转化率的测定
细菌在不同生长时期的活细胞浓度不同。要进行不同生长时期转化率的比较,必须调整细胞密度至相同情况。为达到高效转化,活细胞数务必少于 108细胞/mL。根据 CaC12法,第 2次CaCl2处理时,活细胞浓度浓缩至2.5×109细胞/mL,转化菌平板培养后计数,并计算转化率(每微克DNA转化后所产生的单菌落个数,菌落数/μg DNA),见表3。结果如图3所示,发现感受态细胞的转化率与OD600值显著相关。E.coli DH5α菌株在OD600值为0.40~0.42时获得最高转化率。
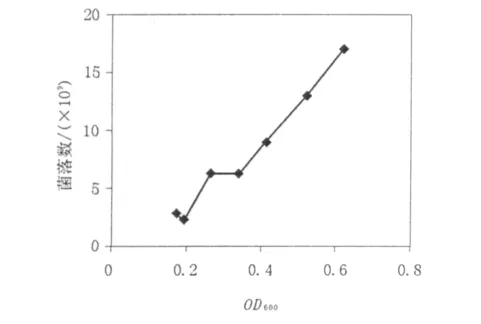
图2 E.coli DH5α的OD600值-活菌细胞浓度图Fig.2 E.coli DH5α OD600-Viable cell concentration diagram
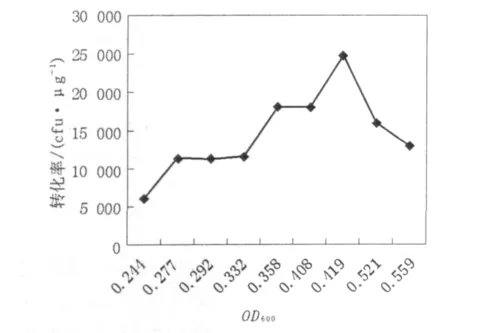
图3 E.coil DH5α不同生长时期的转化率Fig.3 Transformation of E.coil DH5α in the different fevelopment
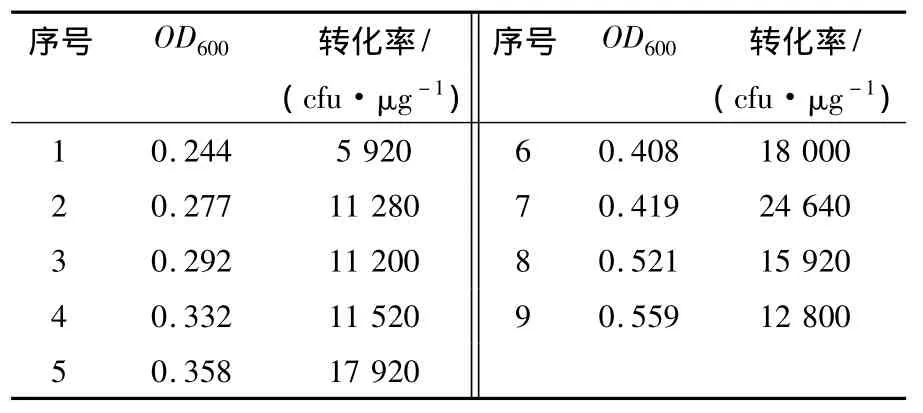
表3 E.coil DH5α不同生长时期的转化率Table 1 Transformation of E.coil DH5α in the different fevelopment
3 讨论
细菌转化率取决于细菌被质粒转化的能力以及细菌的数量,随着细菌生长,单位体积内的细菌数目增加,细菌被质粒转化的能力有所下降,尤其当生长过度后下降更为明显[8]。因此,合适的生长浓度应该能保证上述两方面的综合效应处于理想范围。
大肠埃希菌群体生长周期包括迟缓期、对数期、稳定期、衰亡期。结合所绘制的生长曲线可知:当 OD600值为 0.40 ~0.42 时,细菌正处在对数期的中期,此时,细菌处于最理想的生长状态。细菌在该期生命力强,对转化缓冲液的反应性强,被诱导处于感受态的细菌较多[9],本研究获得转化率为2×106~4×106cfu/μg DNA的感受态细胞,可完全满足常规分子克隆操作对感受态细胞的要求。同时研究还应注意到,当加入的外源DNA的量过多或体积过大时,则会使转化率下降,所以DNA溶液的体积不应超过感受态细胞体积的5%。
[1] J萨姆布鲁克,DW拉塞尔,黄培堂译.分子克隆实验指南(第3版)[M].北京:科学出版社,2002:87-96.
[2] 纠敏,汪伦记,张敏.大肠埃希菌感受态细胞转化能力影响因素的研究[J].安徽农业学报,2007,13(16):23-24.
[3] 卢圣栋.现代分子生物学实验技术[M].北京:高等教育出版社,1995.
[4] 李代宗,赵晓瑜,倪志华,等.少量制备大肠埃希菌感受态细胞条件探索[J].生物技术,2006,16(6):55-57.
[5] 倪志华,赵晓瑜,刘建荣,等.碱裂解提取质粒DNA的改进方法[J].河北大学学报(自然科学版),2005,25(2):222-224.
[6] 朱帆,刘忠纯,李健.大肠埃希菌质粒的快速提取[J].微生物学杂志,2004,24(3):59.
[7] 蒋隽,刘小兰,马海明,等.猪肠毒素大肠埃希菌F4受体的微卫星标记筛选[J].湖南农业大学学报(自然科学版),2010,36(3):321-325.
[8] 陈飞,吴红艳,桓明辉,等.Tetramycin抗性基因克隆及生物活性的测定[J].微生物学杂志,2012,32(1):17-22.
[9] 刘平,李宗军,许爱清.茯砖茶水提物对大肠埃希菌感染小鼠的免疫调节作用[J].湖南农业大学学报(自然科学版),2011,37(5):537-539.