中华卵索线虫核型分析
2013-09-11刘建拓张丽红王国秀
刘建拓, 张丽红, 王国秀
(华中师范大学生命科学学院,遗传调控与整合生物学湖北省重点实验室,武汉 430079)
染色体数目、形态、大小等特征具有种的特异性,即每种生物都具备自己特有的核型(karyotype)[1]。核型分析(karyotype analysis)是对整套生物染色体的形态特征进行综合分析,是生物分类的重要依据[2],对生物的遗传变异、发育机制以及物种的起源进化等研究有着重要理论价值[3]。同时,染色体中的性染色体与性别决定有关[4],因此核型分析对确定不同的性别决定机制也具有重要意义。
中华 卵 索 线 虫 (Ovomermis sinensis Chen et al.)是一种昆虫病原索科线虫,其寄生前期幼虫能主动侵染斜纹夜蛾[Prodenia litura(Fabricius)]、黏虫[Mythimna separata (Walker)]、棉铃虫[Helicoverpa armigera (Hübner)]等鳞翅目幼虫,寄生率即等于害虫死亡率,具有很大的生物防治潜力和潜在应用价值[5]。为充分利用这一宝贵资源,研究人员试图通过体外培养来解决其大量繁殖问题,但由于培养过程中性别没分化,生殖腺不发育、未能获得成功[6]。因此,中华卵索线虫性别决定机制成为目前研究的重点。已有的生物学研究结果表明,中华卵索线虫性别分化是由线虫的感染强度及其宿主体内营养物质的丰度所决定。感染强度越大,每条线虫吸收的营养越少,越有可能发育为雄虫,反之,则为雌虫[7]。这种特殊的营养决定性别分化机制,在动物界极其少见[8]。目前,本课题组从线虫生理生化及分子生物学水平对该机制进行了初步研究,取得了阶段性成果[9-11],并对中华卵索线虫营养决定性别分化的分子机理有了一定的认识。但迄今,尚未有人从细胞水平研究这一特殊性别决定机制。为此,本试验从染色体组学方面,对中华卵索线虫染色体数目及核型进行了研究,探究性染色体的有无,旨在进一步了解中华卵索线虫的性别决定机制。
1 材料与方法
1.1 试验材料
中华卵索线虫:2001年河南上蔡县麦田采得,本实验室通过宿主棉铃虫在(28±1)℃恒温培养箱传代培养,挑取活力良好的雌、雄成虫为试验材料。
棉铃虫(宿主):购于中国科学院病毒所(武汉),(28±1)℃恒温培养箱饲养。
1.2 试剂
(1)线虫生理盐水:0.70%NaCl溶液。2.8g NaCl溶于ddH2O(双蒸水)至400mL,4℃冰箱保存。
(2)秋水仙素溶液:秋水仙素由Sigma公司提供。以0.7%生理盐水配制成浓度为0.4mg/mL溶液,置于棕色瓶中,高压灭菌,4℃冰箱保存。
(3)低渗溶液:0.075mol/L KCl溶液。0.28g KCl溶解于ddH2O至50mL,室温保存。
(4)分散液:V(冰乙酸)∶V(50%乳酸)=3∶1。先用ddH2O和乳酸按体积比配制成50%乳酸溶液,之后按比例加入冰乙酸,配制成分散液,室温保存。
(5)固定液、磷酸缓冲液、Giemsa染色液配制:方法见郑喜邦等[12]。
A.1/15mol/L 磷 酸 盐 缓 冲 液 (PBS,pH=6.8):无水 Na2HPO49.465g,KH2PO49.047g,分别配成1000mL溶液,然后取 KH2PO4溶液510mL和Na2HPO4溶液490mL,混合即可,也可按比例配制PBS溶液。
B.Giemsa原液:Giemsa粉由Sigma公司分装。Giemsa粉0.5g,甘油33mL,将少量甘油先与Giemsa粉混合后,用研钵进行研磨,直至颗粒消失为止,然后再将剩余甘油全部倒入,56℃水浴锅中保温2h,最后加入33mL的甲醇,保存于棕色瓶内,置于阴暗处,待用拿出。
C.0.91%的Giemsa应用液:按Giemsa原液和磷酸盐缓冲液(PBS,pH=6.8)1∶10比例配制染液,置于阴暗处。
1.3 试验方法
(1)秋水仙素处理:挑取活力好的中华卵索线虫雌、雄成虫,置于浓度为0.4mg/mL秋水仙素溶液处理2h。
(2)生殖腺的提取:将线虫置于洁净玻片上,在虫体前1/3处截断,用刀背将生殖腺挤压出来,解剖镜下用昆虫针仔细挑出生殖腺。
(3)低渗处理:将生殖腺迅速置于装有0.075mol/L KCl溶液的1.5mL EP管中,低渗处理1h(28℃)。
(4)固定:1.34×104r/min离心3min,弃上清,用新配制的卡诺氏固定液[V(无水甲醇)∶V(冰乙酸)=3∶1],固定20min,1.34×104r/min离心2min,重复3次,每次固定加入新配制固定液。
(5)分散与终固定:用昆虫针挑出生殖腺,置于预冷无菌的玻片上,迅速滴入少量分散液[V(冰乙酸)∶V(50%乳酸)=3∶1],使细胞分散开来,然后再加上述固定液固定。
(6)染色制片:加一滴 0.91%Giemsa染液(pH=6.8,磷酸盐缓冲液(PBS)稀释配制),室温下染色20min,流水冲洗,自然干燥。
(7)观察拍照分析:显微镜下观察、拍照,选取染色体分散良好的中期分裂相进行染色体统计分析,计算染色体的相对长度及臂比值,参照Levan标准进行染色体分类,即臂比值为1.0~1.7、1.7~3.0、3.0~7.0及7.0~∞分别代表中着丝粒染色体、亚中着丝粒染色体、亚端着丝粒染色体以及端着丝粒染色体。
2 试验结果
中华卵索线虫单倍体数目为6(图1),二倍体数目为12(图2),染色体相对长度最长为9.25,最短为5.71,臂比值介于1.18与2.10之间,其核型公式为2n=2x=3sm+3m,其中1、3、4号为亚中着丝粒染色体,2、5、6号为中着丝粒染色体(表1),其核型模式图如图3。试验结果证实雌、雄中华卵索线虫染色体数目一致,未发现异形性染色体与随体。

图1 中华卵索线虫单倍染色体(10×100)Fig.1 The haploid chromosomes of O.sinensis(10×100)

图2 中华卵索线虫中期分裂相与核型图(10×100)Fig.2 The metaphase chromosomes and karyogram of O.sinensis(10×100)
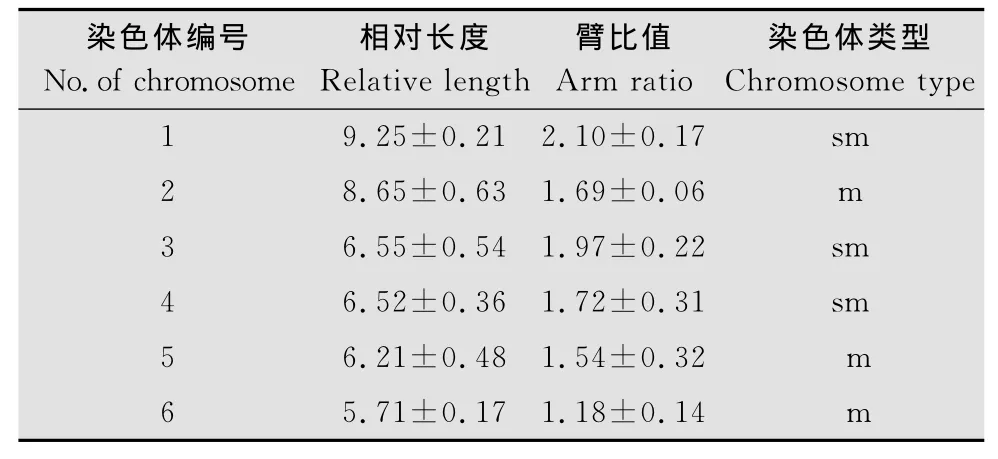
表1 中华卵索线虫染色体相对长度及臂比值Table 1 Relative length and arm ratio of O.sinensis chromosomes

图3 中华卵索线虫核型模式图Fig.3 The idiogram of O.sinensis karyotype
3 讨论
3.1 染色体制备方法探讨
核型分析最关键的是试验材料,一般线虫的核型分析是取材成虫精巢和卵巢。但由于中华卵索线虫的精巢或卵巢很难分离,所以本试验以整条活力好的线虫为试验材料。本试验进行了以下优化:(1)由于中华卵索线虫体内充满滋养体(脂肪粒),显微镜下无法看清其内部结构,使解剖提取其生殖腺的难度加大,也易导致精巢和卵巢丢失或活力下降。因此,本试验采用先用秋水仙素处理整条线虫,然后解剖并提取生殖腺;(2)处理过程中,秋水仙素浓度与处理时间同样会影响到染色体制备。由于中华卵索线虫体壁很厚,低浓度(0.02mg/mL)秋水仙素溶液很难渗透到虫体内发挥作用,所以必须提高秋水仙素浓度,经试验反复摸索,当浓度为0.4mg/mL,处理时间2h时,其效果达到最好。
3.2 核型分析与性别决定机制
国内关于昆虫病原索科线虫的研究,主要停留在形态分类、资源调查、生物学特性等[13]。近年开始涉及分子生化方面研究,但有关此类线虫细胞遗传学方面的研究,还从未有报道。中华卵索线虫的核型分析,从细胞遗传学角度为其营养决定性别分化机制提供了重要科学依据。
线虫性别决定机制是复杂多样的,但总体上主要分为两类:基因决定型(genotypic sex determination,GSD)和环境决定型(environmental sex determination,ESD)。研究表明,昆虫病原索科线虫性别是由营养环境决定的[14],这种机制在动物界极其特殊。为深入了解这一机制,本试验对中华卵索线虫的染色体进行了研究,探究其有无性染色体。结果表明,中华卵索线虫二倍体染色体数目为12,且雌、雄虫染色体数目一致,这首先排除了XX/XO性别决定类型;通过对其核型分析发现,配对染色体之间形态特征差异不显著,未发现异形性染色体(见图2),不存在典型的XX/XY性别决定类型。以上结果表明,中华卵索线虫性别决定应该为环境决定型,这也与前人的研究结果相一致[14]。尽管如此,染色体形态学结果也不能完全排除中华卵索线虫存在性染色体的可能,由于物种进化比较低级,性染色体分化程度低,虽然性染色体有一定的分化,但在形态上分辨不出来,这种情况在鱼类就有发现,有研究表明,大部分鱼类核型无异形性染色体,但通过进一步研究,发现一些鱼类存在性染色体,如通过C-带技术,科学家证明了美洲齿鲤(Poecilia sphenops)和Pseudatocindus tetensis的性别决定类型分别为ZZ/ZW 和 XX/XY[4]。
综上所述,本试验首次从细胞水平对中华卵索线虫染色体进行了形态学研究,对其染色体数目、类型进行了分析,未发现异形性染色体,这一结果从细胞的角度佐证了该线虫环境决定性别分化机制。
[1] 闫素丽,安玉麟,孙瑞芬,等.染色体核型分析及染色体显微分离技术研究进展[J].生物技术通报,2008(4):71-74.
[2] 吴甘霖.核型分析在细胞分类学中的应用[J].生物学杂志,2006,23(1):39-42.
[3] 林明敏,朱香萍.石鲽染色体核型分析[J].青岛农业大学学报(自然科学版),2009,26(2):128-130.
[4] 常重杰,杜启艳.鱼类的性别决定和性染色体[J].淡水渔业,2002,32(2):56-58.
[5] 岳华梅,汪江一,王洪涛,等.中华卵索线虫的研究与应用[J].昆虫知识,2006,43(6):762-766.
[6] 王国秀,陈曲侯.中华卵索线虫的体外培养[J].动物学报,2001,47(2):235-239.
[7] Robin J S,Moeen A H,Randy G.Sex ratio and the infection process in entomopathogenic nematodes:are males the colonizing sex[J].Journal of Invertebrate Pathology,1998,72:288-295.
[8] 任爽,王伟娜,赵娜娜,等.中华卵索线虫的性别分化分子机理研究进展[J].应用昆虫学报,2011,48(3):716-719.
[9] 高原,王国秀,陈思礼.中华卵索线虫雌雄成虫可溶性蛋白双向电泳分析[J].动物学报,2004,50(1):141-144.
[10]贺俊飞,王伟娜,周青春,等.中华卵索线虫tra-1基因cDNA片段的克隆及实时定量表达分析[J].植物保护学报,2009,36(4):324-328.
[11]任爽,陈冲,刘绪生,等.中华卵索线虫vasa基因的克隆及其表达模式分析[J].植物保护学报,2011,38(4):333-338.
[12]郑喜邦,何宝祥.尼克红鸡染色体核型分析[J].中国家禽,2003,25(3):8-10.
[13]钟玉林,王国秀.我国昆虫寄生索科线虫研究近况[J].中国生物防治,2001,17(1):35-39.
[14]Andre P S.Evolution of the control of sexual identity in nematodes[J].Seminars in Cell & Developmental Biology,2007,18(3):362-370.
