建兰花叶病毒外壳蛋白基因和3′UTR序列测定与分析
2013-09-11郑国华苏勇波郑志忠彭德伟明艳林
郑国华, 苏勇波, 郑志忠, 彭德伟, 明艳林*
(1.厦门华侨亚热带植物引种园,国家农作物国外引种隔离检疫基地,厦门市引种检疫与植物源产物重点实验室,厦门 361002;2.厦门兆翔花卉科技有限公司,厦门 361010)
建兰花叶病毒(Cymbidium mosaic virus,CyMV)属于马铃薯X病毒属(Potexvirus)成员,是危害兰科植物最为严重的病毒之一[1]。调查表明国内兰花普遍受到该病毒的危害,特别是蝴蝶兰、文心兰、大花蕙兰、墨兰等兰花种类[2-3]。该病毒基因由约6200nt的单链正义RNA组成,5′端带有一个甲基化的核苷酸帽子结构,3′端带有一个poly(A),共编码RNA聚合酶、TGBp1、TGBp2、TGBp3和CP等5个蛋白[4]。Potexvirus属病毒的CP在病毒复制、组装和移动等过程中都发挥着重要的作用[5],因此CP基因被广泛用于开展介导抗病毒研究[6]。国内外学者先后将CyMV的CP基因转入石斛兰(Dendrobium)原球茎[7]、本塞姆氏烟(Nicotiana benthamiana)[8]、西方烟(Nicotiana occidentalis)[9]等寄主,发现病毒的复制和积累受到明显抑制,展示了CP基因介导抗性的优势。但是在马铃薯Y病毒和番木瓜环斑病毒等CP基因介导应用研究中发现,CP基因介导的转基因植株对不同分离物的抗性存在着明显的差异[10-11],从而限制了该抗性技术的应用。CyMV 分离物间CP基因(相似性85%~100%)存在明显遗传变异性[12],因此有必要分析病毒CP基因遗传变异和进化趋势,寻找稳定遗传的保守序列开展抗性基因的研究。
正单链RNA病毒3′UTR的序列及其二、三级结构在病毒RNA复制酶启动合成负链RNA时具有非常重要的作用,许多研究发现3′UTR可以通过形成的茎环结构、类tRNA结构和Poly(A)等方式参与病毒复制调控[13]。目前,Potexvirus属的竹花叶病毒(Bamboo mosaic virus,BaMV)3′UTR结构与功能研究较为深入,BaMV的3′UTR能够形成类似三叶草茎环结构A、B、C和D,形成类似tRNA的假结结构[14]。RDRP能特异结合3′UTR,启动负链RNA的合成,敲除3′UTR不同部位都能影响RNA复制[15]。CyMV与BaMV同属于Potexvirus,具有非常相似的基因组成,因此研究CyMV 3′UTR的结构和功能将有可能进一步揭示病毒复制调控机制。
本文采用单链构象多态性分析(single-strand conformation polymorphism,SSCP)快速检测侵染不同蝴蝶兰品种CyMV存在的遗传变异,从中筛选得到5个存在变异的分离物并测定其CP和3′UTR基因序列。进一步与其他分离物的CP基因进行比较分析,研究CP基因存在的遗传多样性和作用于CP基因的选择压力,为开展抗病毒研究奠定基础。并通过软件预测3′UTR二级结构,以期为深入研究该复制调控区域的结构和功能提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 病毒毒源
蝴蝶兰病株采自厦门蝴蝶兰种植圃(品种编号:pl335、kq5503、kq6113、kf540、kf1023、jt1017、ypm166、j02037),均为组培分生苗,叶片出现褪绿、花叶和环斑等症状。经斑点酶联免疫检测筛选后,将病叶研磨后摩擦接种到曼陀罗上进行单斑分离和保存。采用接种建兰花叶病毒的曼陀罗病叶作为阳性对照,并以未接种病毒的曼陀罗叶片作为阴性对照。
1.1.2 试剂
CyMV斑点酶联检测试剂由本实验室制备。cDNA合成试剂盒、Taq聚合酶购自Promega公司。内切酶Pst I、T-A克隆试剂盒、感受态细胞JM109、Trizol试剂盒、DNA胶回收试剂盒等均购自上海生物工程有限公司。分析已知分离物间的保守序列,根据保守序列设计3条引物,委托上海桑尼生物工程有限公司合成。引物5Fa(对应AM055640的4900~4923nt):5′-GTGTTAGCTTTTACTGCAGTGATC-3′、引物4R(与 AM055640的5278~5298nt 互 补 ):5′-ATTGCCAGGATGGTAGGAAA-3′;引 物 M4T(与 poly(A)互 补 ):5′-GTTTTCCCAGTCACGACTTTTTTTTTTTT-3′,其中5Fa/4R引物对预期扩增条带大小为399bp,5Fa/M4T引物对预期扩增条带约为1350bp。
1.2 方法
1.2.1 RT-PCR
采用Trizol试剂盒分别提取8个样品、阳性对照和阴性对照叶片总RNA,采用cDNA合成试剂盒合成cDNA。用5Fa/M4T引物对扩增部分TGB-ps、全长CP和3′UTR基因序列,PCR扩增体系如下:50μL 总体积包括 10 × PCR buffer 5μL、dNTP mix(10mmol/L)1μL、引物5Fa(10μmol/L)和 M4T(10μmol/L)各2μL、cDNA 1μL、Taq酶(5U/μL)0.4μL;补充ddH2O至50μL。PCR反应程序:94℃预变性10min,先进行94℃45s、50℃30s、72℃120s5个循环后将退火温度提高58℃再进行24次循环,最后72℃延伸5min。PCR产物经1.0%琼脂糖凝胶电泳观察。
1.2.2 SSCP
取PCR产物稀释1×105后作为模板,用5Fa/4R引物对扩增TGB部分序列,PCR扩增体系同1.2.1。PCR反应程序:94℃预变性5min,94℃30s、58℃20s、72℃30s,共24个循环,72℃延伸5min。扩增产物经胶回收试剂盒回收纯化后,取纯化产物2μL加入4μL上样缓冲液(95%甲酰胺、0.5%溴酚蓝),混匀后于95℃变性10min,取出立即冰浴5min后上样。将电泳槽置于4℃冰箱内,先使用10V/cm电压电泳5min后,改用4V/cm电压电泳12h。EB染色30min后在紫外灯下观察。
1.2.3 序列测定与分析
将5Fa和M4T扩增得到的8份PCR产物经胶回收试剂盒回收纯化后,分别与pUCm-T载体进行连接转化DH5α,筛选得到pUmcy07(pl335)、pUmcy11 (kq5503)、pUmcy18 (kq6113)、pUmcy42(kf540)、pUmcy46(kf1023)、pUmcy54(jt1017)、pUmcy58(ypm166)和pUmcy59(j02037)等阳性克隆,委托上海生物工程有限公司进行序列测定。通过 Clustal Omega-Multiple Sequence Alignment(http:∥www.ebi.ac.uk/Tools/msa/)软件进行序列分析,通过基于Nei &Gojobori方法的SNAP在线分析软件(http:∥www.hiv.lanl.gov/content/sequence/SNAP/SNAP.html)分析CP基因各位点非同义置换率(dN)和同义置换率(dS)值。采用RNAshapes软件分析3′UTR形成的二级结构。
2 结果
2.1 RT-PCR扩增结果
经1%的琼脂糖凝胶电泳分析发现,采用5Fa和M4T这对引物从来自8个蝴蝶兰品种的CyMV分离物中均能扩增得到1300bp左右的目的条带。由于M4T引物与Poly(A)结合位点略有不同,扩增片段大小应该存在一定差异,但这种差异在电泳图中没有得到体现(图1)。PCR产物经稀释后作为模板采用5Fa和4R这对引物进行扩增均能得到400bp左右的目的条带(图2)。

图1 引物对(5Fa和M4T)PCR扩增产物电泳分析Fig.1 Electrophoresis of PCR products using the primers 5Fa/M4T
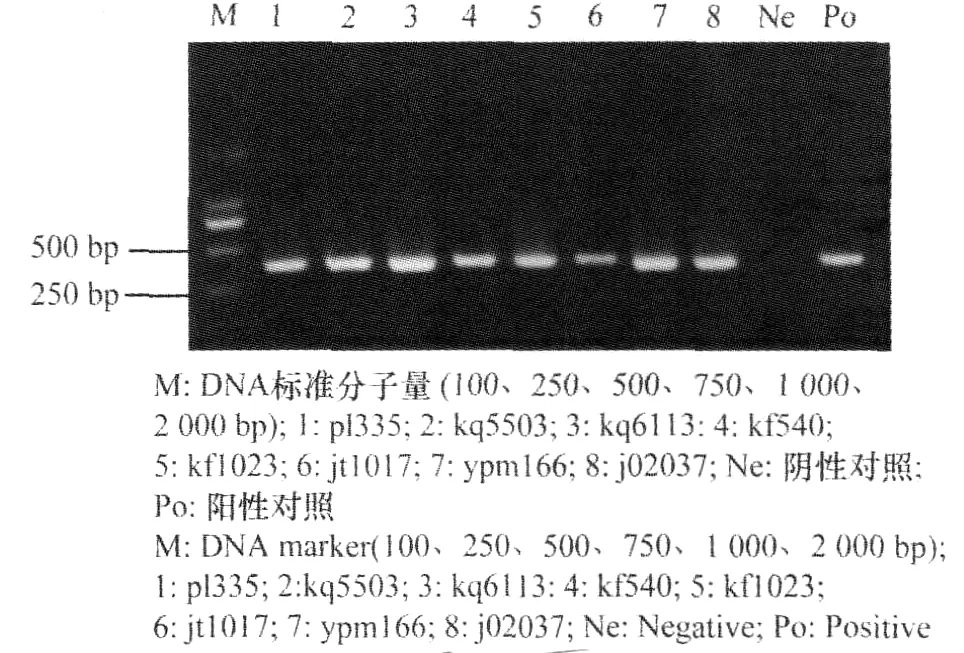
图2 引物对(5Fa和4R)PCR扩增产物电泳分析Fig.2 Electrophoresis of PCR products using the primer 5Fa/4R
2.2 变异分离物筛选
采用SSCP对5Fa和4R扩增得到的8个产物进行分析,发现经过优化SSCP条件均得到稳定的带型(图3)。8个分离物扩增片段均出现2个条带,总共有5个带型,其中kf1023、jt1017和ypm166带型一 致,kf540、j02037 带 型 一 致,pl335、kq5503、kq6113分离物带型差异明显。通过条带存在的多态性,推测这8个分离物由5种存在明显差异的分离物组成。进一步提取8个分离物重组质粒委托测序,结果表明5Fa和4R扩增片段大小均为399bp。通过序列分析比对发现,pUmcy46(kf1023)、pUmcy54(jt1017)和 pUmcy58(ypm166)序列一致,pUmcy42(kf540)、pUmcy59(j02037)序列一致,其他3个分离物各不相同(图4),与SSCP分析结果一致。
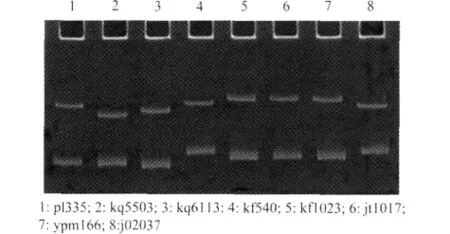
图3 PCR产物单链构象多态性电泳分析Fig.3 Electrophoresis of SSCP products of 8isolates
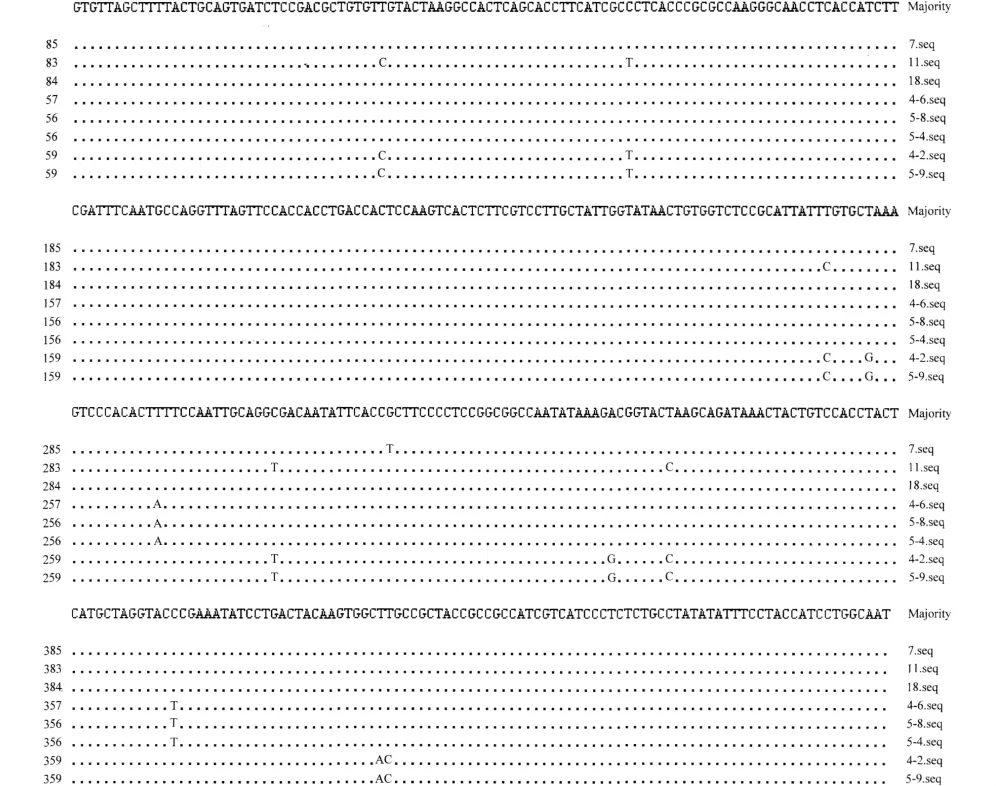
图4 8个分离物扩增片段碱基变异分析Fig.4 Molecular differentiation of 8isolates
2.3 CP基因进化树分析
根据SSCP分析和序列测定分析结果,本文对pl335、kq5503、kq6113、kf1023、j02037等分离物 CP基因进行分析,通过分析发现它们的相似性为95.5%~99.9%。从已知GenBank登录的130个分离物CP基因序列中选择具有代表性的56个登录序列和本研究的5个序列建立系统进化树(图5),分析表明这5个分离物都属于亚组A。其中pl335(图5:Phalaenopsis-pUmcy07)、kq6113(Phalaenopsis-pUmcy18)和 kf1023(Phalaenopsis-pUmcy46)3个分离物间相似性为99.4%~99.9%,与来自厦门(GQ507023)、广东(FJ356061)蝴蝶兰分离物亲缘性较近(相似性为98.1%~98.8%)。kq5503(Phalaenopsis-pUmcy11)和 j02037(Phalaenopsis-pUmcy54)2个分离物间相似性为97.6%。与来自浙江(DQ067884、DQ067885)、福建(DQ067879)、广东(AY360410)建兰分离物亲缘性较近(95.2%~97.6%)。分析分离物间的地理分布和寄主发现,各分离物间不存在明显的地域和寄主相关性。
2.4 CP基因dN和dS的分析
对CP基因各碱基非同义替代率(dN)和同义替代率(dS)进行计算,dN 平均为0.0418,dS平均为0.1205,平均dN/dS为0.3379,说明CP基因全长仍然为负向选择。通过SNAP分析的dN和dS分布(图6),可以看到CP的N端dN>dS,表明受到正选择压力的作用,氨基酸发生变异的频率较高;而CP的C端dN<dS,表明受到负选择压力的作用,在病毒进化过程中会净化这些变异。
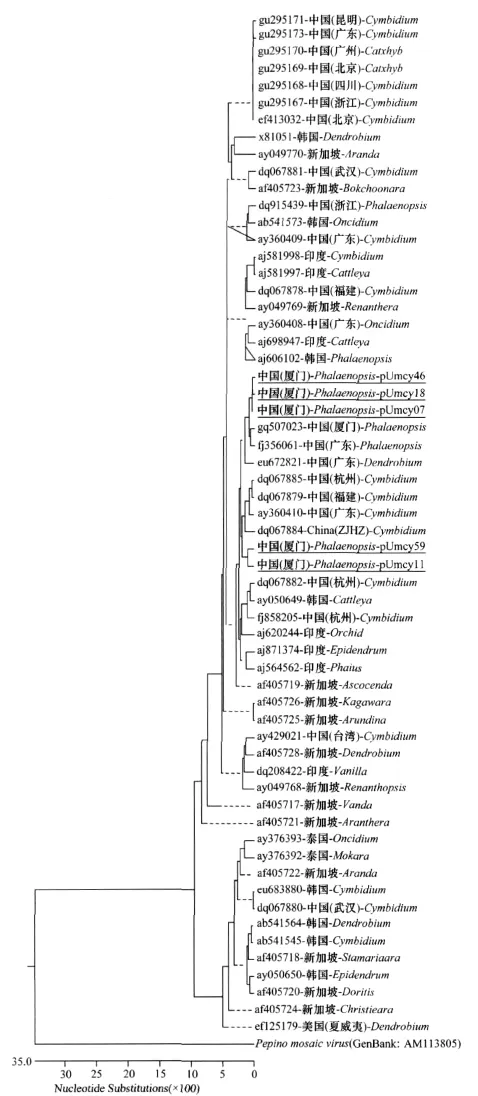
图5 CP基因系统进化树分析Fig.5 Phylogenetic tree based on CP nucleotide sequences between different isolates of CyMV
2.5 3′UTR二级结构预测
分析3′UTR序列发现含有Potexvirus属病毒RNA合成必需的顺式元件“AC(C/T)TAA”和Poly(A)信号“AATAAA”。采用RNAshapes软件预测3′UTR形成的二级结构,发现该区域能够形成类似三叶草茎环结构(图7A),顺式元件位于茎环结构A中,推测该区域在启动负链RNA合成的过程中具有重要作用。
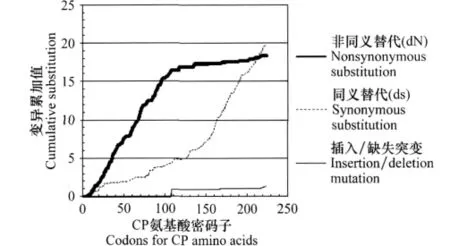
图6 CP基因核苷酸的非同义替代率(dN)和同义替代率(dS)Fig.6 Cumulative plot of average nonsynonymous nucleotide substitution(dN)and average synonymous nucleotide substitution(dS)represented codon by codon
进一步分析各分离物的3′UTR存在的遗传变异(图7B),发现10位(A/T)、28位(C/T)、31位(A/T/G)、47位(G/A)、59位(A/T/C)、60位(A/T/G)、61位(C/T)等变异位点均位于未配对区域,它们间的变异没有改变茎环结构;位于配对区域的49位(C/T)和68位(A/G)则是分别形成 A-T和G-C配对的稳定结构。56位碱基A出现缺失和突变为G的情况降低了茎环稳定性。由此可见,各分离物进化过程中始终保持这种二级结构的稳定,推测这种结构对病毒具有重要意义。
3 讨论
Zhou等[16]根据CP基因序列相似性进行进化树分析,认为CyMV分离物间亲缘关系与地理位置大体相关,亚洲各分离物和夏威夷分离物以很高相似系数聚集在一起,欧洲各分离物集成一大类,新加坡的一个分离物和泰国分离物是特例。Moles等[17]则明确这两类分离物划分为亚组A和亚组B。本文通过将这5个分离物与其他分离物进行比对,结果发现它们都属于亚组A,未发现亚组B成员。进一步分析各分离物CP基因的非同义替代/同义替代率,发现该CP基因5′端存在较高的非同义替代,推测该区域的变异是病毒应对不同寄主和环境选择压力的策略。CP基因3′端普遍发生同义替代,编码的氨基酸序列较为保守,因此可以作为抗性研究的重点。

图7 CyMV 3′非编码区茎环结构预测Fig.7 Stem-loop structure prediction of CyMV 3′UTR
CyMV 3′UTR形成的类似三叶草的茎环结构在同属的BaMV已经得到验证,而且CyMV不同分离物间的变异始终都维持着这种结构的稳定性,由此可以推测这种结构对于病毒具有非常重要的作用。但是目前仅仅通过分子结构的热力学稳定性进行模拟,其结构和功能还有待进一步的试验验证。
[1] 明艳林,李梅,郑国华.建兰花叶病毒研究进展[J].福建农业学报,2005,20(1):30-33.
[2] 王钰丽,李凡,李正跃,等.侵染兰花引起坏死斑症状的病毒种类鉴定[J].云南农业大学学报,2007,22(2):222-224.
[3] 明艳林,郑国华,李梅.建兰花叶病毒厦门分离物的鉴定及其抗血清的制备与应用[J].植物病理学报,2005,35(4):366-369.
[4] Wong S M,Mahtani P H,Lee K C,et al.Cymbidium mosaic potexvirus RNA:complete nucleotide sequence and phylogenetic analysis[J].Archives Virology,1997,142(2):383-391.
[5] Chapman S,Hills G,Watts J,et al.Mutational analysis of the coat protein gene of Potato virus X:effects on virion morphology and viral pathogenicity[J].Virology,1992,191(1):223-230.
[6] 明艳林,郑金龙,郑国华,等.兰花抗病毒基因工程研究进展[J].亚热带植物科学,2010,39(1):92-96.
[7] Chang C,Chen Y C,Hsu Y H,et al.Transgenic resistance to Cymbidium mosaic virus in Dendrobiumexpressing the viral capsid protein gene[J].Transgenic Research,2005,14(1):41-46.
[8] Chia T F,Chan Y S,Chua N H.Characterization of Cymbidium mosaic virus coat protein gene and its expression in transgenic tobacco plants[J].Plant Molecular Biology,1992,18(6):1091-1099.
[9] Lim S H,Ko M K,Lee S J,et al.Cymbidium mosaic virus coat protein gene in antisense confers resistance to transgenic Nicotiana occidentalis[J].Molecules and Cells,1999,9(6):603-608.
[10]Tennant P F,Gonsalves C,Ling K S,et al.Differential protection against Papaya ringspot virus isolates in coat protein gene transgenic papaya and classically cross-protected papaya[J].Phytopathology,1994,84:1359-1366.
[11]Vlugt V D,RenéA A,Goldbach R W.Tobacco plants transformed with the potato virus YNcoat protein gene are protected against different PVY isolates and against aphid-mediated infection[J].Transgenic Research,1993,2(2):109-114.
[12]Sherpa A R,Hallan V,Pathak P,et al.Characterization of the coat protein gene of Cymbidium mosaic virus isolates from India[J].Journal of Phytopathology,2006,154(5):275-280.
[13]刘长龙,袁世山.单股正链RNA病毒基因组3′非编码区功能[J].中国动物传染病学报,2010,18(3):76-81.
[14]Cheng J H,Ding M P,Hsu Y H,et al.The partial purified RNA-dependent RNA polymerases from bamboo mosaic potexvirus and potato virus X infected plants containing the template-dependent activities[J].Virus Research,2001,80(1-2):41-52.
[15]Huang C Y,Huang Y L,Meng M,et al.Sequences at the 3′untranslated region of bamboo mosaic potexvirus RNA interact with the viral RNA-dependent RNA polymerase[J].Journal of Virology,2001,75(6):2818-2824.
[16]周国辉,陈晓琴,李梅辉,等.广东地区两种兰花病毒病害的分子鉴定及检测[J].中国病毒学,2004,19(2):149-152.
[17]Moles M,Delatte H,Farreyrol K,et al.Evidence that Cymbidium mosaic virus (CymMV)isolates divide into two subgroups based on nucleotide diversity of coat protein and replicase genes[J].Archives of Virology,2007,152(4):705-715.
