三叶草病毒病症状类型及发病条件研究
2013-09-11梁巧兰徐秉良刘雪峰
相 栋, 梁巧兰, 徐秉良, 刘雪峰
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,兰州 730070)
三叶草又名车轴草,广泛应用于城市美化、水土保持、绿肥压青、饲用牧草和医药等领域[1-3]。适宜生长在温暖湿润的环境中,为各种病虫害的滋生提供了机会,病毒病作为三叶草主要病害之一,在世界范围内普遍发生[4]。已报道可以感染三叶草的病毒至少有十余种,其中,以苜蓿花叶病毒(AWV)和白三叶草花叶病毒(WCMV)危害较严重[5-7]。三叶草感染病毒后,常表现为叶片坏死,系统花叶畸形等症状,严重影响其品质和价值。国内外至今还没有找到防治包括三叶草病毒病在内的植物病毒病切实有效的方法。因此,加强检测检疫工作,了解病情的分布动态,从而有针对性地采取无毒种苗、隔离检疫、销毁病株等措施,是防控该类病害的重要措施之一。
近年来,随着三叶草在我国绿肥作物以及园林设计中的应用不断增多,三叶草在甘肃省种植面积也逐年扩大,然而,病毒病的发生也日益加重,严重影响其长势和品质,使其经济价值得不到充分发挥,已成为影响三叶草栽培和持续利用的主要限制因素之一。为此对甘肃省兰州市绿化带及种植区三叶草病毒病的发生情况进行了详细的调查,对其主要病毒病原进行了鉴定,并测定了其寄主范围,试验结果对指导甘肃省三叶草的种植,减轻病毒病的发生具有重要意义。现将结果报道如下。
1 材料与方法
1.1 病害调查和毒源采集
2010-2012年间,于每年4-9月中、下旬对兰州市不同区绿化带(南北滨河路绿化带、五泉山绿化区、西湖公园绿化区、南昌路绿化带等)、甘肃农业大学校园、甘肃农业大学红三叶草试验田、兰州市榆中县红三叶草试验田三叶草病毒病的发生定期定点进行调查,其中,除了甘肃农业大学红三叶草试验田、兰州市榆中县红三叶草试验田以红三叶草为调查和采集对象,其余地块均为白三叶草。所有调查采用五点取样法,每样点取1m2,调查其中50株的150片叶,共750片叶,按以下9级分级标准,统计发病情况,计算发病率及病情指数。
三叶草病毒病分级标准[8]为,0级:无症状;1级:轻度花叶;3级:中度花叶;5级:轻微皱缩或轻花叶皱缩;7级:花叶或皱缩或畸形;9级:重度花叶且皱缩或坏死。
按以下公式计算发病率和病情指数:


调查过程中用无菌塑料袋采集具病毒病典型症状的白三叶草和红三叶草叶片为试材,样品一式3份,一份于4℃冰箱短期保存、一份于-20℃冰箱保存,另一份长期保存于-70℃冰箱中,部分样品将病株整体移回,种植于实验室隔虫网室中,进一步观察研究。
1.2 环境因素对白三叶草病毒病发生的影响
以白三叶草(Trifolium repens Linn.)作为供试植物,将消毒三叶草种子播种在灭菌的土壤中,置于防虫网室中培养。等株高达到13cm左右时,将采集的白三叶草病叶用pH7.0磷酸缓冲液按1∶2(m/V)冰浴匀浆后摩擦接种[9]于供试植株上,分别置于相对湿度为45%,温度5、10、15、20、25、30℃下和温度为25℃,相对湿度为30%、45%、60%、75%、90%下观察其发病状况并统计病情指数[10]。每种供试植物接种5株,以接种磷酸缓冲液为对照,重复3次。温度、湿度通过RXZ型智能人工气候箱控制。
1.3 三叶草病毒病病原鉴定及寄主范围测定
1.3.1 三叶草病毒病病原鉴定
采用双抗体夹心法(double antibody sandwich ELISA DAS-ELISA),按武汉基因美公司提供的AMV、WCMV DAS-ELISA试剂盒试验步骤进行测定。田间采集的正常植株叶片及具有典型病毒病症状的三叶草叶片为试验材料,分别记为,W0:正常;W1:黄斑花叶;W2:斑驳花叶;W3:花斑花叶;W4:丛簇矮化;W5:皱缩褪绿;W6:环斑及环纹每个样品设4个重复。
最后结果首先通过目测法观察,即如果阳性对照变色,空白、阴性对照都没有变色,观察待测材料是否发生颜色变化;然后进一步进行酶标仪测定法,即用550型酶联免疫测定仪(Bio-Rad厂家产品),分别测定450nm下各孔的A值,并根据公式:临界值(CUT OFF)=阴性对照A 平均值+0.15,当样品A值≥临界值者,为阳性(+)带毒;当样品A值<临界值者,为阴性(-)不带毒。
1.3.2 三叶草病毒病病原提纯
根据金磊磊[11]报道的苜蓿花叶病毒提纯方法和Wetter[12]报道的白三叶草花叶病毒提纯方法,分别对AMV、WCMV进行提纯,然后将提纯的病毒分别接种于心叶烟、菜豆上进一步扩繁保存。
1.3.3 寄主范围测定
以种植于隔虫网室中的昆诺藜、苋色藜、心叶烟、普通烟、本氏烟、番茄、辣椒、龙葵、菜豆、豇豆、苜蓿、地三叶、豌豆、藿香蓟、鹅绒藤、莴苣、向日葵、黄瓜、千日红、鸡冠花、大白菜等7科21种植物作为供试寄主,将提纯扩繁的AWV、WCMV采用汁液摩擦分别接种(方法同1.2)于以上2~3叶期供试寄主幼苗,以接种磷酸缓冲液为对照,每种植物接种6~10株,重复2次,置于防虫网室中观察记录症状表现。
2 结果与分析
2.1 三叶草病毒病田间发病情况
2.1.1 田间发生情况
通过2010-2012年连续3年对兰州市三叶草病毒病调查发现,4-9月三叶草病毒病均有发生,平均发病率为28.14%,平均病情指数为17.45;田间症状主要为花叶、褪绿皱缩、斑驳、丛簇矮化。调查还发现,红三叶草平均发病率和平均病情指数均高于白三叶草,不同地区发病情况不同。由于三叶草为多年生植物,发病情况严重的地块每年都保持较为严重的发病率。

表1 甘肃省兰州市三叶草病毒病发病情况Table 1 Prevalence of clover virus disease in Lanzhou City,Gansu Province
2.1.2 田间症状类型
调查结果表明,三叶草受到病毒侵染后,在田间的症状类型主要有以下几种(图1):
(1)黄斑花叶:沿叶脉产生褪绿条点,连接为褪绿黄条斑,形成黄色条纹或不规则花叶(症状代号为YM);
(2)斑驳花叶:叶片上出现黄绿相间的斑驳花叶,或叶脉坏死、叶片皱缩,后逐渐形成坏死斑(症状代号为MoM);
(3)花斑花叶:叶片呈现弱的、散射的、有时是不规则的淡黄色或白色花斑(症状代号为VaM);
(4)丛簇矮化:顶部叶片扭曲不能正常张开,有的叶片沿叶脉皱缩坏死,植株严重矮化(症状代号为Rstu);
(5)皱缩褪绿:叶片扭曲皱缩,并在皱缩处出现不规则褪绿或由边缘开始向内褪绿(症状代号为Shch);
(6)环斑及环纹:一般出现于田间垂直下部叶片,整个叶片出现圆形或近圆形斑,有4~50个不等,后期逐渐连接造成坏死斑(症状代号为RS&RP);
(7)其他症状类型:沿叶片主脉,整个叶片由中间向两边褐化;叶片边缘或整个叶片沿着叶脉红叶;叶片出现褐色短线。
其中,(1)、(5)、(6)、(7)症状表现在白三叶草上;(2)、(3)、(4)症状表现在红三叶草上。
2.1.3 三叶草病毒病田间发生流行动态
通过三叶草病毒病田间发生流行动态研究表明,在不同季节三叶草病毒病发生情况不同(图2),白三叶草和红三叶草发病症状及高峰期有明显差别。5月均表现出不同程度的病毒病症状,4月下旬到5月上旬白三叶草达到发病高峰,发病率和病情指数分别为29.62%、14.04,6月红三叶草达到发病高峰,发病率和病情指数分别为56.53%、34.34。在发病高峰期,白三叶主要症状表现为黄斑花叶,红三叶主要症状表现为花斑花叶、丛簇矮化。

图1 三叶草病毒病田间症状类型Fig.1 Symptom types of clover virus disease in the field

图2 不同时期三叶草病毒病发生情况Fig.2 Occurrence status of clover virus disease during difference periods
2.2 环境因素对三叶草病毒病发生的影响
2.2.1 温度对三叶草病毒病发生的影响
通过温度对三叶草病毒病发生的测定表明,温度在5~30℃三叶草病毒病均能发生。当温度为25℃时,发病最重,病情指数为74.81;当温度为30℃时发病最轻,病情指数为40.00。方差分析表明,当温度为15、20、25℃时,3个处理之间无显著性差异,但是与其他处理5、10、30℃间存在显著性差异(图3)。
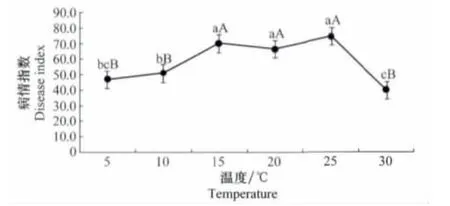
图3 温度与三叶草病毒病发生的关系Fig.3 The relationships between different temperatures and occurrence of clover virus disease
2.2.2 湿度对三叶草病毒病发生的影响
不同相对湿度条件下三叶草病毒病均能发生。随着相对湿度的增大,病情指数先升高后降低。当相对湿度45%时,病害发生最严重,病情指数达到最大为74.07;而相对湿度为60%时,病情指数最低,为30.37,其他3个处理发病情况介于两者之间。方差分析表明,相对湿度为45%时比其他处理发病显著严重,其他处理之间无显著性差异(图4)。
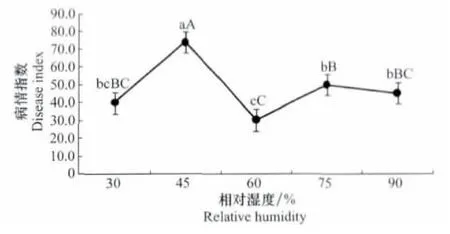
图4 相对湿度与三叶草病毒病发生的关系Fig.4 The relationships between different humidity conditions and occurrence of clover virus disease
2.3 三叶草病毒病生物学测定
2.3.1 三叶草病毒病病原DAS-ELISA检测
DAS-ELISA对28份三叶草样品AMV、WCMV的检测结果表明:具有典型症状的6类样品均受到AMV的侵染(表2),目测发现其均有不同程度的黄色显示,酶标仪检测结果均为阳性带毒,AMV的检出率为100%;皱缩褪绿型目测观察发现其轻微显色,但酶标仪检测结果显示A值小于临界值为阴性外,其余5类均受到WCMV的侵染(表2),其目测观察与酶标仪检测结果相一致,WCMV的检出率为83.3%;正常叶片两种病毒均未检测出。通过ELISA检测结果发现在6类三叶草样品中存在AMV和WCMV复合侵染的现象,复合侵染率为83.3%。
2.3.2 AMV寄主范围测定
通过AMV寄主范围测定表明,用PB缓冲液(pH7.0)作对照,通过重复处理发现,AMV可以侵染6科16种植物,不同寄主潜育期不同,接种3d后表现症状不等,主要症状有系统花叶、褪绿、枯斑等。在不同寄主上的症状反应如表3所示。
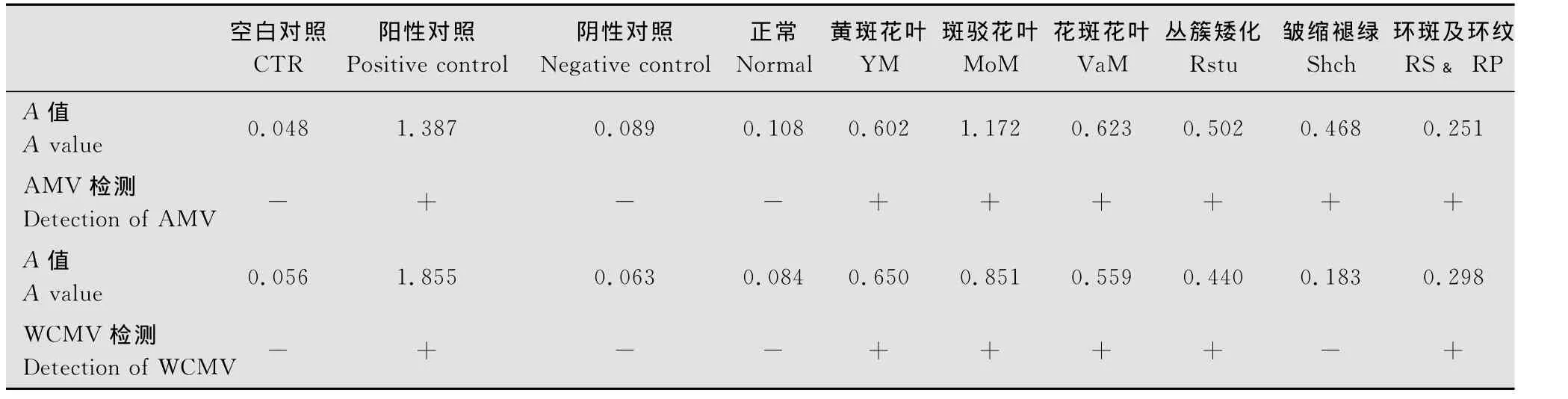
表2 三叶草病毒病原DAS-ELISA检测结果Table 2 Detection of the clover viral pathogens by DAS-ELISA

表3 AMV在不同测试寄主上的反应1)Table 3 The reaction of AMV against different test hosts

续表3 Table 3(Continued)
2.3.3 WCMV寄主范围测定
WCMV寄主范围测定表明,WCMV可侵染豌豆、菜豆、豇豆、苜蓿、昆诺藜,症状反应如表4所示,在其他植物上未表现出侵染症状。

表4 WCMV在不同测试寄主上的反应Table 4 The reaction of WCMV against different test hosts
3 结论与讨论
对兰州市不同绿化带及试验种植区三叶草病毒病症状表现和发病情况调查表明,三叶草病毒病在调查区普遍发生,平均发病率为28.14%,病情指数为17.45。三叶草病毒病症状类型主要有6种,其中,花叶型和皱缩型比较普遍,并且在红三叶草和白三叶草上的症状类型不同。病原主要以侵染叶片对三叶草生长造成危害。4月下旬到5月上旬白三叶草达到发病高峰,主要症状为黄斑花叶;6月份红三叶草达到发病高峰,主要症状为花斑花叶、丛簇矮化。8月份兰州市温湿度相对较高,此时黄斑花叶型症状基本消失,9月下旬到10月份黄斑花叶和花斑花叶两种症状的发生又达到一个高峰期。三叶草病毒病的发生与温、湿度均有很大的关系,当温度为25℃、相对湿度为45%时接种白三叶草幼苗发病较重,这与调查一致。当温度过高时有些症状消失,这可能与存在隐症现象有关。
引起甘肃省兰州市三叶草病毒病的主要病原为苜蓿花叶病毒(AMV)和白三叶草花叶病毒(WCMV),通过DAS-ELISA检测法其检出率分别为100%、83.3%,田间自然感病三叶草以复合侵染为主,复合侵染率为83.3%。McLaughlin[13]在对美国东南部豆科牧草病毒病检测中,通过ELISA检测在白三叶草和红三叶草上AWV、WCMV的检出率分别为9.4%、7.3%。据报道三叶草黄叶脉病毒(Clover yellow vein virus,CYVV)、红三叶草脉花叶病毒(Red clover vein mosaic virus,RCVMV)、大豆矮缩病毒(Soybean dwarf virus,SbDV)、菜豆黄花叶病毒(Bean yellow mosaic virus,BYMV)也是侵染三叶草的主要病原[5-7,14],田间自然感病三叶草是否还受CYVV、RCVMV、SbDV、BYMV感染还有待进一步检测,并且近年来与RT-PCR和核酸分子杂交相结合的方法可使检测更为准确[15]。
寄主范围测定表明,经提纯的AMV分离物在豇豆、菜豆、豌豆、苜蓿、黄瓜、昆诺藜、苋色藜、番茄、辣椒、心叶烟、普通烟、大白菜、鸡冠花等一些测试寄主上的反应与国内魏宁生[16]及陈集双等[17]报道的苜蓿花叶病毒分离物Wc及SHy在测试寄主上的症状反应相似,但在千日红不表现系统黄斑与报道存在差异,并发现向日葵也为寄主;WCMV在国内尚未报道,这可能与我国环境、栽培制度以及它经常和其他病毒复合侵染有关系,但本试验提纯的WCMV在豌豆、菜豆、昆诺藜等上的症状与Jacqueline[18]、Potter[19]及 Gardiner[20]报道的相似。
本试验仅对兰州市三叶草病毒病的发生与温度、湿度的关系进行了初步探讨,对于不同品种、气象因素、传毒昆虫迁飞动态等与病毒病发生的关系尚未涉及;并且测试寄主植物也仅限于试验中选取的种类,是否还有其他寄主,有关这些问题还有待进一步研究。
[1] 陈学福,史高峰.三叶草属植物研究进展[J].安徽农业科学,2006,34(13):3087-3089.
[2] 马进.我国草坪业若干问题探讨[J].四川草原,2001(1):32-35.
[3] 邢珊珊,龚束芳.黑龙江省三叶草研究应用现状及发展建议[J].黑龙江农业科学,2011(1):102-103.
[4] 赵桂琴,慕平.苜蓿花叶病毒外壳蛋白基因对红三叶的遗传转化及转基因植株的抗病性分析[J].西北植物学报,2004,24(10):1850-1855.
[5] Hanson E W,Hagedorn D J.Viruses of red clover in Wisconsin[J].Agronomy,1961,33:63-67.
[6] Michael J P.Clover viruses in eastern Canada in 1967[J].Plant Disease,1968,48(3):87-92.
[7] Pratt M J.Studies on clover yellow mosaic and white clover mosaic viruses[J].Canadian Journal of Botany,1961,39:655-665.
[8] 王信.青海蚕豆、豌豆病毒病调查和菜豆花叶病毒(BYMV)全系列分析[D].杨凌:西北农林科技大学,2007.
[9] 方中达.植病研究方法[M].北京:中国农业出版社,1998.
[10]古丽君,徐秉良,梁巧兰,等.兰州市草坪禾草根腐病的发生及病原菌鉴定[J].草业学报,2009,18(4):175-180.
[11]金磊磊.一株苜蓿花叶病毒的全基因组序列及其寄主生物学研究[D].杭州:浙江理工大学,2011.
[12]Wetter C.Partial purification of some elongated plant viruses and their use as antigens in immunization by means of Freund’s adjuvant[J].Archiv für Mikrobiologie,1960,37:278.
[13]McLaughlin M R,Boykin D L.Virus diseases of seven species of forage legumes in the southeastern United States[J].Plant Disease,1988,72:539-542.
[14]Ragland C K,Campbell C L,Moyer J W.The effects of clover yellow vein virus and peanut stunt virus on yield of two clones of ladino white clover[J].Phytopathology,1986,76(5):557-561.
[15]袁小环,李青.血清学方法和分子生物学方法检测植物病毒研究进展[J].热带农业科学,2001(6):63-68.
[16]魏宁生,李毅.苜蓿花叶病毒(AMV)白三叶草分离物-Wc的研究[J].病毒学杂志,1987(4):54-60.
[17]陈集双,洪健.从白车根草(Trifolium repens)上分离的一株苜蓿花叶病毒[J].浙江农业大学学报,1994,20(1):24-28.
[18]Jacqueline D B,Brunt A A.The natural occurrence of white clover mosaic virus in sweet pea(Lathyrus odoratus)in southeast England[J].Plant Pathology,1988,37(3):445 -446.
[19]Potter L R.The effects of white clover mosaic virus on vegetative growth and yield of clones of S.100white clover[J].Plant Pathology,1993,42(5):797-805.
[20]Gardiner T J,Pearson M N,Hopcroft D H,et al.Characterization of a labile RNA virus-like agent from white clover[J].The Annals of Applied Biology,1995,126(1):91-104.
