抗水稻条纹病毒安全表达载体的构建及遗传转化
2013-09-11李红伟王锡锋
雷 阳, 李 羽, 王 彪, 李红伟, 李 莉, 王锡锋
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
由水稻条纹病毒(Rice stripe virus,RSV)引起的水稻条纹叶枯病是东亚稻区,尤其是中国、日本、韩国等的重要病毒病害,造成了巨大的经济损失[1]。曾经于2001、2003、2004、2006和2008年在江苏、山东、安徽、河南和上海等省份的粳稻种植区大规模暴发,2004年仅江苏省的发病面积就达157万hm2,占全省水稻种植面积的79%。流行年份,一般田块减产20%~30%,严重田块达到80%以上,甚至颗粒无收[2]。采取传统治虫防病策略对水稻条纹叶枯病有一定的防效,但大量使用化学农药既污染环境,也易使害虫产生抗药性,而且介体灰飞虱(Laodelphax striatellus Fallén)传毒具有瞬时性和持久性,使得防病效果欠佳,因此防治病毒病最有效的途径是通过增强品种自身的抗性,达到主动预防病毒病害的目的。
RNA干扰(RNA interference,RNAi)机制的发现为植物抗病毒基因工程提供了一条全新的思路。RNAi是一种重要的基因沉默现象,可以通过双链RNA(dsRNA)特异性降解对应序列的 mRNA,从而特异性地抑制相应基因的表达[3]。RNAi是一种古老的且进化上高度保守的防御机制,但是通过长期的共进化,病毒已经能够从RNAi中逃逸,甚至产生抑制子来与之抗衡,植物体内天然的RNAi系统不能起到完全或较高水平地抵御某种病毒侵染的作用。利用基因工程手段将病毒的某一序列设计成双链发夹结构,导入植物体使之表达,以便诱发RNA沉默,就有可能强化植物体内天然的RNA沉默病毒基因的能力。2007年代玉华等[4]构建了RSV全长CP基因RNAi载体,遗传转化水稻,获得了稳定遗传、高抗或免疫的植株。2011年Shimizu等[5]将RSV编码的7个基因都构建成RNAi载体,分别导入水稻,接种试验表明:转CP、SP基因的水稻植株对RSV免疫,转pC1基因的水稻植株抗病性显著提高,但转pC2和pC4基因的水稻植株抗病性没有增加。
在抗病基因工程中,外源基因整合到植物基因组中的频率很低,一般从千分之几到百万分之几不等[6]。为了便于筛选到低频率的转化事件,常将外源目的基因与易于识别的选择标记基因串联,再通过标记基因筛选低频率的转化事件。然而,使用选择性标记基因对植物细胞的生长和分化有不利的影响;对环境存在潜在危害,标记基因可能转移到土壤微生物和其他植物,引起其他生物产生抗性;在食品上有一定的安全风险和消费心理障碍[7]。因此培育无选择标记基因的安全转基因植物已成为植物基因工程发展的趋势。
目前获得无选择标记基因植物的方法主要有位点特异性重组、转座子系统和共转化法等。位点特异性重组系统能精确地引入外源基因,但需要进行二次转化或杂交,费时、费力[8]。利用转座子系统虽然能完整地删除选择标记基因,但需要通过有性繁殖分离目的基因和标记基因,周期长、效率低,且不稳定,难以定向优化[9]。共转化法具有操作简便,适用范围广,基因转化效率较高等优点,被广泛应用于水稻、烟草、油菜、大豆、玉米等植物中[10-12]。共转化法就是把目的片段和选择性择标记基因分别构建于不同载体或同一载体的不同T-DNA区,期望借助于基因枪或农杆菌介导等转化方法将选择标记基因和目的基因同时导入同一受体细胞的不同染色体上。一方面利用选择标记基因编码的性状,筛选出同时含有目的基因的细胞或再生植株。另一方面,通过转基因植株后代自交,使目的基因和选择标记基因发生分离,从而获得不携带选择标记基因的转基因阳性植株。虽然已有利用共转化法培育无选择标记转基因水稻的报道[13],但由于RNA干涉载体片段大,结构复杂,无抗性选择标记基因植株的获得率还不尽如人意。本研究应用RNAi原理,构建了RSV CP基因(RSV-HCP)安全表达载体,利用农杆菌介导的双菌、双质粒共转化法,对转化体系进行了优化,成功获得了转基因再生植株,经T1代自交分离、抗病性筛选,获得了无选择标记基因的抗RSV植株。
1 材料与方法
1.1 转基因受体、病毒分离物及传毒介体材料
水稻模式品种‘爱知旭’(‘Aichiasahi’)以及对RSV高感、优质高产的品种‘武育粳3号’(‘Wuyujing 3’)和‘淮稻5号’(‘Huaidao 5’)用作转基因的受体材料。
RSV分离物(RSV-JS)采集自江苏南京自然发病的水稻(Oryza sativa Linnaeus)植株,经 ELISA和PCR鉴定、纯化后保存在-70℃备用。携带RSV-JS的灰飞虱由江苏省农业科学院植物保护研究所提供,饲养在高感品种‘武育粳3号’上(26℃,14h光照)。
1.2 菌株和质粒载体
大肠杆菌[Escherichia coli (Migula)Castellani et Chalmers]JM110、根瘤农杆菌 [Agrobacterium tumefaciens(Smith Townsend)Conn]EHA105和RNAi载体pMCG161均为本实验室保存。载体pCAMBIA1301为澳大利亚CAMBIA中心产品,本实验室保存。
1.3 载体构建
1.3.1 目的基因的克隆
按照已公布 RSV CP基因序列(GenBank.DQ299166.1)设计引物。上游引物 RSV-HCP-F:5′-AGACTAGT GGCGCGCCGACTATGTGCATCACCATGAG-3′,引入限制性酶切位点SpeⅠ和AscⅠ;下 游 引 物 RSV-HCP-R:5′-AGGAGCTCCCTAGGACAGCCATCTTAACACCAG-3′,引 入酶切位点SacI和Av rⅡ,预期扩增片段约256bp。
采用Trizol法(Invitrogen)提取水稻叶组织的总RNA为模板,以RSV-HCP-R为引物合成第一链cDNA。再以合成的cDNA为模板,以RSVHCP-F和RSV-HCP-R为引物对进行PCR扩增,反应总体积50μL(模板100ng,dNTP 1mmol/L,聚合酶5U,RSV-HCP-F 0.5μmol/L,RSV-HCPR 0.5μmol/L),反应条件:94℃4min;94℃40s,52℃40s,72℃1min,30个循环;72℃10min。将扩增到的RSV-CP基因部分片段命名为RSVHCP。试验以健康植株为阴性对照。将RSV-HCP克隆于pMD18-T载体,经验证序列正确的重组质粒命名为pMD18-T-HCP(基因的测序工作由上海生物工程公司完成)。
1.3.2 无潮霉素抗性基因载体pCMBIA1301-hpt(-)的获得
用限制性内切酶XhoI酶切载体pCMBIA1301,经电泳检测、回收、纯化大片段,再经T4DNA连接酶16℃连接过夜,即可得到去除潮霉素标记基因的pCMBIA1301载体,经PCR和酶切验证的载体命名为pCMBIA1301-hpt(-)。
1.3.3 RSV-HCP基因RNAi载体的构建
选择含有来源于水稻Intron的RNAi载体pMCG161,通过酶切、T4连接酶作用,将RSV-HCP正向片段插入在载体的酶切位点Asc I、AvrⅡ间,将反向片段插入在载体的Spe I、Sac I间,获得RNAi载体pMCG161+/-R。由于该载体含有氯霉素抗性基因,不适合根瘤农杆菌介导的遗传转化,因此将中间载体pMCG161+/-R上的发夹结构,用BamH I、HindⅢ双酶切,回收6920bp的片段,在T4DNA连接酶作用下,与同样经BamH I、HindⅢ酶切的载体pCMBIA1301-hpt(-)连接(16 ℃过夜),得到无潮霉素标记基因的RNAi载体,以antisense IP 5′(5′-TTCCTGGGCTAAAAGAATTGTTGATTTGGC-3′)和 antisense IP 3′(5′-CCGGTTCTGCCGCTTTTTTTAAAATTGGAT-3′)为 引物对,进行PCR鉴定,正确的质粒命名为pCMBIA1301+/-R。
利用电击法将质粒pCMBIA1301+/-R和pCAMBIA1301分别转化到农杆菌EHA105感受态细胞中,得到的阳性重组子分别命名为E13R和 E1301[10]。
1.4 不同水稻品种对共转化率的影响
分别将水稻品种‘爱知旭’、‘武育粳3号’和‘淮稻5号’的成熟种子灭菌后置于愈伤诱导培养基上,28℃黑暗培养10~15d。剥下成熟胚盾片长出的愈伤组织,进行继代培养,每个品种各取长势良好的愈伤900个,分为3个重复。将E13R和E1301分别在YM培养基(酵母膏0.3%,胰蛋白胨0.5%,麦芽糖0.5%,pH=9.0;Kana 50μg/mL;利福平50μg/mL)平板上划线,28℃黑暗培养2~3d,挑取单菌落,220r/min振荡培养。当A600至0.8时,4000r/min离心收集菌体,用AAM+100μmol/L AS培养基重新悬浮沉淀至A600为0.4。将E13R和E1301的悬浮液按照体积比为1∶1混合,分别对3个水稻品种共转化。水稻愈伤组织诱导培养、与农杆菌的共培养、抗性愈伤组织的筛选再生及所用培养基配方等参照易自立[11]的方法。对T0代再生植株进行PCR检测,分别统计出抗性愈伤数、苗数和阳性植株数,并计算出愈率、再生率和共转化率。计算公式如下:

1.5 不同菌液配比对共转化率的影响
将E13R和E1301的悬浮液按照体积比3∶1、2∶1、1∶1和1∶2混合,以水稻品种‘爱知旭’为受体,分别进行共转化。对T0代再生植株进行PCR检测后,分别统计出抗性愈伤数、苗数和阳性植株数,并计算出愈率、再生率和共转化率。
1.6 转基因植株的PCR检测
以改进的CTAB法[14]提取转基因植株幼嫩叶组织总DNA,采用两重PCR反应体系,同时扩增RSV-HCP和hptⅡ基因。反应总体积50μL(模板100ng,dNTP 1mmol/L,聚合酶5U,RSV-HCP-F 0.3 μmol/L,RSV-HCP-R 0.3 μmol/L,N-hpt-F 0.3μmol/L,N-hpt-R 0.3μmol/L),反 应 条 件 同1.3.1节,预期PCR产物RSV-HCP片段为265bp,hptⅡ基因片段为1042bp。反应产物经1%琼脂糖凝胶电泳检测。hptⅡ扩增引物对为N-hpt-F和N-hpt-R。引 物 N-hpt-F 序 列 为 5′-CCCATGGGATGAAAAAGCCTGAACTCACCGCGAC-3′,N-hpt-R为5′-CCCATGGGCTATTTCTTTGCCCTCGGACGAGTGC-3′。
1.7 转基因植株的抗病性分析
对水稻条纹叶枯病的抗性鉴定试验在本所防虫温室内进行(温度26~30℃,光照14h),以‘镇稻88’为抗病对照,‘武育粳3号’为感病对照,管理按常规方法进行。接种和调查方法参照张世贤等[15],水稻条纹叶枯病分级标准参照卢百关等[16]。
1.8 数据处理
以ANOVA/MANOVA统计方法分析数据,并进行多重比较。
2 结果与分析
2.1 RNAi载体的构建
2.1.1 RSV CP基因部分核苷酸片段的克隆
以水稻叶组织总RNA为模板,以RSV-HCP-F和RSV-HCP-R为引物,通过 RT-PCR 扩增 RSVHCP,1%琼脂糖电泳分析结果表明:从RSV侵染的水稻样品中扩增到约260bp的预期片段,阴性对照则没有扩增到任何片段。将该片段克隆到pMD18-T载体,得到重组质粒pMD18-T-HCP,对其测序结果表明目的片段长度为256bp,与GenBank No.DQ299166.1序列的201~434bp序列完全一致,说明获得了RSV CP基因的部分核苷酸片段RSVHCP。通过在NCBI上BLAST发现,与RSV-HCP核苷酸序列一致性达100%的分离物达42个,这也说明RSV-HCP序列是高度保守性,将有利于通过RNAi获得抗RSV的转基因植株。
2.1.2 中间载体的构建
构建RNAi载体需要一个两侧带有多酶切位点的合适Intron序列,以便将RSV-HCP的正反义链插入在Intron的两翼,形成发夹结构。本研究选择了具有水稻Intron的载体pMCG161,将RSV-HCP的正义链插入在酶切位点Asc I和AvrⅡ间,将反义链插入在酶切位点Spe I和Sac I间。当片段正向、反向均连入载体后,此时的载体含有两个AscⅠ酶切位点,它们分别位于正义片段和负义片段的两端,因此采用AscⅠ对重组质粒进行单酶切时,阳性质粒得到两个片段,其中1650bp的小片段为有效的 发 夹 结 构,包 括 正 向 片 段 (256bp)、intron(1138bp)和反向片段(256bp);而作为阴性对照的空质粒,只得到一条约12913bp的大片段条带(图1),说明RNAi载体构建成功,命名为pMCG161+/-R,该载体具有氯霉素抗性。

图1 重组质粒pMCG161+/-R的酶切鉴定(Asc I)Fig.1 Restriction analysis of recombinant plasmid pMCG161+/-R with AscⅠ
2.1.3 适合农杆菌转化的安全RNAi载体构建
为了获得适合农杆菌遗传转化水稻的去潮霉素抗性基因的RNAi载体,采用限制性内切酶BamH I和HindⅢ将RNAi载体pMCG161+/-R上有效的发夹结构切下,并在T4连接酶的作用下,连入到去除潮霉素抗性基因的载体pCMBIA1301-hpt(-)上获得了重组载体pCAMBIA1301+/-R,该载体具有卡那霉素抗性。以 antisense IP5′/antisense IP3′为引物,单克隆为模板进行菌落PCR鉴定,结果表明:部分待检样品和阳性对照(pMCG161+/-R)扩增出1121bp的特异条带,与预期片段大小一致,而阴性对照(pCMBIA1301-hpt(-))未扩增出任何条带。pCAMBIA1301+/-R的酶切鉴定结果与pMCG161+/-R相似,同样得到了1650bp的条带,证明无标记基因的RNA干涉载体构建成功。进一步测序结果也说明RSV-HCP发夹结构已连入载体pCMBIA1301-hpt(-)中,成功获得了适合农杆菌转化,且在T-DNA区内不含有抗生素标记基因的安全RNAi载体,命名为pCAMBIA1301+/-R(图2)。

图2 RNAi载体pCMBIA1301+/-R的T-DNA区示意图Fig.2 The construct of pCMBIA1301+/-R T-DNA
2.2 不同水稻品种的共转化率
采用重组农杆菌E13R和E1301(按照1∶1浓度配比),选择水稻模式品种‘爱知旭’和对RSV高感、但优质高产的水稻品种‘武育粳3号’和‘淮稻5号’等进行了共转化。在转化过程中,3个品种的成熟胚最初产生愈伤组织的能力无明显的差别,但在重组农杆菌侵染后,经潮霉素筛选,‘爱知旭’产生的抗性愈伤组织最多,出愈率最高(25.6%);其次是‘武育粳3号’,出愈率为23.3%;而‘淮稻5号’产生的抗性愈伤数最少,仅为7.9%。在随后成苗过程中,‘爱知旭’成苗需要时间最短,约45d左右,成苗数也最多,再生率为38.3%;而‘武育粳3号’的成苗时间稍晚,需要50d左右,同时成苗数也略少(35.7%)。3个品种中‘淮稻5号’的成苗时间最晚,80d后才出现少量再生苗,同时成苗数也最少,仅5.6%的再生率。对再生植株进行PCR检测后,对阳性植株数进行统计,计算共转化率,采用ANOVA/MANOVA统计分析数据,并进行多重比较,3个品种的共转化率有显著差异。可以看出水稻品种‘爱知旭’的共转化率最高,达9.07%;推广品种‘武育粳3号’的共转化率略低于‘爱知旭’,达到6.59%;而‘淮稻5号’的所有再生植株均未检测到外源目的基因(表1)。由此可见,本研究所用的遗传转化体系最适合模式品种‘爱知旭’的转化,其次是‘武育粳3号’,而不适合‘淮稻5号’的转化。

表1 不同水稻品种的转化效率1)Table 1 Co-transformation efficiencies of different rice varieties
2.3 不同菌液配比对共转化率的影响
选用最适合RNAi载体pCAMBIA1301+/-R的共转化受体品种‘爱知旭’,分别用菌液E13R与E1301按照3∶1、2∶1、1∶1、1∶2混合对350个愈伤进行了共培养,对抗性愈伤、再生植株数等的统计,发现当E1301菌液浓度较高时(E13R:E1301为1∶2),尽管抗性愈伤和再生苗数都相对较多,但hptⅡ和RSV-HCP的共转化率较低(5.97%),而当 E13R菌液浓度较高时(2∶1和3∶1)hptⅡ和 RSV-HCP的共转化率较高(13.56%~16.33%),最终获得的转基因再生阳性植株数目较多(表2)。

表2 不同农杆菌菌液浓度对转化效率的影响Table 2 Effects of different density ratios on co-transformation efficiency
2.4 无潮霉素抗性基因植株的获得
将获得的33个转基因再生植株,通过带毒灰飞虱人工接种后,其中5株未表现症状(0级),9株表现轻微症状(Ⅰ级),5株表现中等症状(Ⅱ级),12株症状严重(Ⅲ级),而受体‘爱知旭’发病严重,全部为Ⅱ级或Ⅲ级,发病率为100%。PCR检测结果表明:表现为0~Ⅰ级的转基因再生植株均扩增到潮霉素抗性基因(hptⅡ)和RSV-HCP。
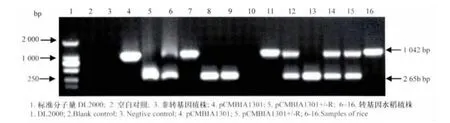
图3 T1代植株的PCR检测Fig.3 Analysis of T1transformation of hptⅡ gene and RSV-HCP fragment
对33个株系的T1代植株进行带毒灰飞虱人工接种,筛选到14个株系的87株不表现病害症状的植株,通过双重PCR检测潮霉素抗性基因(hptⅡ)和RSV-HCP(图3),其中16株(5个株系)为不携带hptⅡ的阳性植株。说明通过本研究构建的载体成功获得了不携带选择标记基因的转基因抗病毒植株,为进一步育种应用打下了良好的基础。
3 讨论
在植物转基因过程中,选择标记基因的使用使得大量筛选抗性愈伤和再生植株成为可能。传统的做法是将标记基因和目的基因串联起来,置于同一载体(T-DNA)内,以便通过标记基因筛选低频率的转化事件[1,4,17],但后期删除标记基因却非常困难。随着人们环保意识的加强,对标记基因的安全性提出了质疑,并引起了国际上的普遍关注,不同的国家也制定了相关的条款和法规加以限制。因此,在获得转基因植株后,是否能成功去除标记基因对转基因材料的育种应用和安全释放至关重要。在国内外,已有通过RNAi技术使水稻获得抗RSV特性的报道。Park[1]利用 RSV 的全长 CP,Zhou[17]利用 RSV 的全长SP分别构建了RNAi载体,遗传转化水稻,均获得了高抗或免疫的植株。Shimizu[5]更是将RSV编码的7个基因的部分核苷酸序列(500bp)都构建成RNAi载体,分别导入水稻模式品种‘日本晴’,比较含不同基因的转基因植株的抗病性差异,试验表明转化RSV CP和RSV SP的植株具有良好的抗性。但上述试验更多的是在做机制层面上的研究,为了便于筛选,其转基因植株均携带有选择标记基因,难以直接投入生产或进行育种应用。另外,已有研究表明仅60~200bp的病毒基因片段就能诱导RNA沉默从而获得抗病毒抗性[18],所以只要选择具有高度保守性的RSV基因片段,就能达到全长基因的效果,这样不仅大大简化了构建植物表达载体的工作量,还缩小了T-DNA区的长度,更利于遗传转化和减小对水稻基因组的影响。
双菌、双质粒共转化法作为一种简便易行的去除选择标记基因的转基因方法,目前得到了广泛的应用,而利用双菌、双质粒共转化法转化RNAi载体还未见报道。由于目的基因和选择标记基因分别位于两种质粒上,再加上RNA干涉载体的T-DNA区片段大,结构复杂,使其共转化效率难以达到预期结果。本文利用RSV CP基因(969bp)的高度保守区段(RSV-HCP,234bp)构建了RNA干涉载体,与全长CP基因相比,既能保证对RSV CP基因的RNA干涉效果,还大大缩短了外源插入片段,使得转化率(转化率=再生苗数/共培养的愈伤数×100%)最高可达到19.14%,相比单质粒转全长CP基因的转化率(15%)[4]有明显提高。
在双菌双质粒转化中,通常的做法是将重组农杆菌菌液浓度按照1∶1配比,本试验首先比较了在该配比下转化水稻模式品种‘爱知旭’及生产上的推广品种‘武育粳3号’和‘淮稻5号’的差异。结果表明,‘爱知旭’的共转化率最高,‘武育粳3号’次之,而‘淮稻5号’没有获得任何阳性植株,不同品种间的差异较为显著。这主要是由于在植物的遗传转化中,决定转化成功与否的重要因素为材料的再生能力和效率,而这两者最终是由品种的基因型决定的。此外,本研究结果表明在一定范围内,含有目的基因的重组农杆菌浓度越高转化效率越高,当E13R与E1301配比为3∶1时,共转化率最高,浓度配比为2∶1时次之,浓度比为1∶2时最低,可能的原因是pCMBIA1301+/-R 的 T-DNA 区(11297bp)相对于pCMBIA1301的 T-DNA 区(5576bp)要 大 很多,这就造成了发卡结构相对于潮霉素抗性基因更难插入水稻的基因组中。本文通过双菌双质粒共转化方法转化水稻模式品种‘爱知旭’和生产上推广品种‘武育粳3号’,均获得了无标记基因抗RSV的转基因植株,为转基因材料进一步的推广应用铺平了道路。
[1] Park H M,Choi M S,Kwak D Y,et al.Suppression of NS3 and MP is important for the stable inheritance of RNAi-mediated rice stripe virus(RSV)resistance obtained by targeting the fully complementary RSV-CP gene[J].Molecules and Cells,2012,33(1):43-51.
[2] 陈洁,吴丽娟,周彤,等.江苏省主栽水稻品种对条纹叶枯病与灰飞虱的抗性评价[J].南京农业大学学报,2010,33(4):105-108.
[3] Ding S W,Voinnet O.Antiviral immunity directed by small RNAs[J].Cell,2007,130(3):413-426.
[4] 代玉华,王锡锋,李莉,等.一种适合水稻农杆菌转化的RNAi载体的构建和潮霉素对水稻转化的影响[J].植物保护,2007,33(2):37-40.
[5] Shimizu T,Nakazono-Nagaoka E,Uehara-Ichiki T,et al.Targeting specific genes for RNA interference is crucial to the development of strong resistance to rice stripe virus[J].Plant Biotechnology Journal,2011,9(4):503-512.
[6] De Vetten N,Wolters A M,Raemakers K,et al.A transformation method for obtaining marker-free plants of a cross-pollinating and vegetatively propagated crop[J].Nature Biotechnology,2003,21(4):439-442.
[7] Komamine Heksemsekya.Systems for the removal of a selection marker and their combination with a positive marker[J].Plant Cell Reports,2001,20(4):383-392.
[8] 邱淑萍,陈在杰,王锋.Cre/loxp位点特异性重组系统在转基因植物中的应用[J].福建农业学报,2008,77(2):211-217.
[9] 金维正,段瑞君,张帆,等.利用Ac/Ds转座子系统在水稻中获得无选择标记转基因植株的方法[J].生物工程学报,2003,19(6):668-673.
[10]Tenllado F,Diaz-Ruiz J R.Double-stranded RNA-mediated interference with plant virus infection[J].Journal of Virology,2001,75(24):12288-12297.
[11]Tenllado F,Llave C,Diaz-Ruiz J R.RNA interference as a new biotechnological tool for the control of virus diseases in plants[J].Virus Research,2004,102(1):85-96.
[12]Wang M B A D,Waterhouse P M.A single copy of a virus-derived transgene encoding hairpin RNA gives immunity to barley yellow dwarf virus[J].Molecular Plant Pathology,2000,1(6):347-356.
[13]刘峰,赵伊英,苏永昌,等.双农杆菌共转化获得无标记转pepc基因的水稻植株(英文)[J].应用与环境生物学报,2005,11(4):393-398.
[14]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemical Bulletin,1987,19(4):11-15.
[15]张世贤,李莉,王锡锋,等.我国北方稻区水稻条纹病毒分子变异和水稻品种抗病性分析[J].植物保护,2007,33(5):45-50.
[16]卢百关,方兆伟,刘汉清,等.不同粳稻品种抗水稻条纹叶枯病情况的调查研究[J].中国稻米,2006(1):22-24.
[17]Zhou Y,Yuan Y,Yuan F,et al.RNAi-directed down-regulation of RSV results in increased resistance in rice(Oryza sativa L.)[J].Biotechnology Letters,2012,34(5):965-972.
[18]Sijen T,Wellink J,Hiriart J B,et al.RNA-Mediated virus resistance:role of repeated transgenes and delineation of targeted regions[J].The Plant Cell,1996,8(4):2277-2294.
