番木瓜DNA提取与性别分子鉴定——遗传学综合性实验
2013-09-08申艳红陈晓静
申艳红,陈晓静
(福建农林大学 园艺学院,园艺植物遗传育种研究所,福建 福州 350002)
为了适应基因工程和基因组学的快速发展,在遗传实验教学中增加了“植物基因组DNA的粗提与鉴定”实验[1]。但是该实验为验证性实验,学生只能按部就班地完成实验步骤,学生处于被动接受的地位,不利于培养学生的分析问题和解决问题的能力[2];而且这样的实验不能说明任何生物学问题,学生积极性不高。为了更好培养学生的实践动手能力、创新设计能力和科学研究能力,设计了“番木瓜DNA提取与性别分子鉴定”综合性实验。该实验将基因组DNA提取、PCR扩增、琼脂糖凝胶电泳和分子标记分析整合到一个实验中。通过对本实验的操作,学生学习了移液枪、离心机、PCR仪和电泳仪等常用分子遗传学研究仪器的使用方法,了解基因工程和基因组学研究的基本方法。而且通过本实验,学生可以清楚认识到分子标记辅助选择的神奇功能,简单的PCR操作就可以将番木瓜的两性株和雌株分辨开,大大地激发了学生的学习兴趣。
1 材料
植物材料:实验用新鲜番木瓜叶片采自福建农林大学校园。
试剂:SDS、CTAB、Tris、EDTA、NaCl、PVPP、乙醇、氯仿和异戊醇均为国产分析纯;ExTaq、dNTPs等购自TaKaRa公司;质粒提取试剂盒购自北京天泽基因工程有限公司。
2 实验方法
2.1 DNA提取
(1)改良2×CTAB法。参照植物基因工程[3]的方法,并加以改进。
① 取番木瓜叶片0.1g并剪碎放入研钵中,加入1 mL提取缓冲液(0.02g/mL CTAB,1.4mol/L NaCl,20 mmol/L EDTA,100mmol/L Tris-HCl),加少许PVPP,充分研磨至浆糊状;然后用1mL提取缓冲液将糊状物洗入2mL的离心管中,65℃水浴15min。
②4℃、13000r/min离心10min。
③ 取上清,加入体积比为24∶1的氯仿和异戊醇,剧烈振荡,4℃、13000r/min,离心10min。
④取上清,加入2倍体积的无水乙醇,轻轻向一个方向转动试管,可见有白色絮状沉淀出现,即为DNA。
⑤ 用枪头将絮状物挑出到1.5mL离心管中,用500μL、75%乙醇洗涤沉淀,4℃、10000r/min,离心5min。
⑥ 用移液枪吸取上清,弃掉,放在50℃烘箱中5min,以除去乙醇。
⑦ 加入50~100μL ddH2O溶解沉淀,-20℃保存备用。
(2)SDS-KAc小量提取法。参照何玮毅等[4]的方法,并简化了步骤。
① 称取番木瓜叶片0.1g,加入1500μL、缓冲液 (500mmol/L NaCl;pH 8.0 的 100mmol/L Tris-HCl;50mmol/L EDTA),加少许PVPP,迅速研磨成匀浆,转移至2mL离心管中,加入100μL 20%SDS,65℃温育15min。
② 加入300μL KAc,放入4℃冰箱10min,4℃、13000r/min离心10min;之后步骤同方法(1)的③—⑦步。
(3)2×CTAB+质粒提取试剂盒法。将番木瓜叶片于2×CTAB缓冲液中研磨成匀浆,65℃温育15 min后,离心,然后将上清液加入质粒提取试剂盒的柱子中,其余步骤参照试剂盒使用说明书。
(4)SDS-KAc+质粒提取试剂盒法。完成方法(2)的①、②步后,将上清液加入质粒提取试剂盒的柱子中,其余步骤参照试剂盒使用说明书。
2.2 DNA质量检测
取3μL DNA样品并稀释100倍,在TU-1901型紫外分光光度计上测定A260、A280,并计算检测DNA的纯度、浓度和产率。计算 DNA浓度c:c/(mg·L-1)=A260×50×100。各取8μL DNA样品,经1%琼脂糖凝胶电泳检测DNA质量。各取8μL DNA样品用Sau3AI与EcoR I酶切,将酶切产物经琼脂糖凝胶电泳检测酶切效果。
2.3 番木瓜性别连锁SCAR标记的扩增
根据Deputy等[5]发表的番木瓜性别连锁SCAR标记合成引物,上游引物 T12-F:5′-GGGTGTGTAGGCACTCTCCTT-3′,下游引物 T12-R:5′-GGGTGTGTAGCATGCATGATA -3′,片段长度为800bp。利用番木瓜Actin基因保守区做阳性对照[6],上游引物为5′-CACTGCTGAGCGGG AAATTGT-3′,下游引物为5′-GATCCTCCAATCCAGACACTGT-3′,片段长度为426 bp。以提取的番木瓜基因组DNA为模板,扩增性别连锁SCAR标记。PCR扩增程序:94℃预变性5min;35个扩增循环的94℃变性30s,52℃退火30s,72℃延伸50s;最后72℃继续延伸7min。扩增PCR产物经1%琼脂糖凝胶电泳检测。
3 实验结果及4种DNA提取方法的比较
由电泳结果可以看出,4种方法提取的番木瓜基因组DNA条带完整、清晰,说明没有降解。2×CTAB法和SDS-KAc法DNA的得率比与试剂盒结合的方法高,但是这2种方法RNA污染严重,而且点样孔稍亮,说明有蛋白质污染(见图1)。采用分光光度计测定OD值,2×CTAB法与SDS-KAc法提取的DNA A260/A280接近2,A260/A230均为2.16(见表1)。如果单从数据上看,这2种方法提取的DNA质量很高,没有RNA、蛋白质以及小分子杂质的污染。但是从DNA电泳图谱已经看出,这2种方法获得的仅是粗提DNA,既有RNA污染,又有蛋白质污染,因此粗提得到的DNA不适于用分光光度法分析其质量。Sau3AI与EcoR I酶切结果表明,采用这4种方法提取的DNA均能被完全酶切(见图2)。分别以这4种方法提取的DNA为模板,扩增番木瓜Actin保守区,均能扩增出目的条带(见图3),说明4种方法所提取的DNA质量可以满足PCR扩增的要求。

表1 番木瓜叶片DNA的紫外分光光度计测定结果
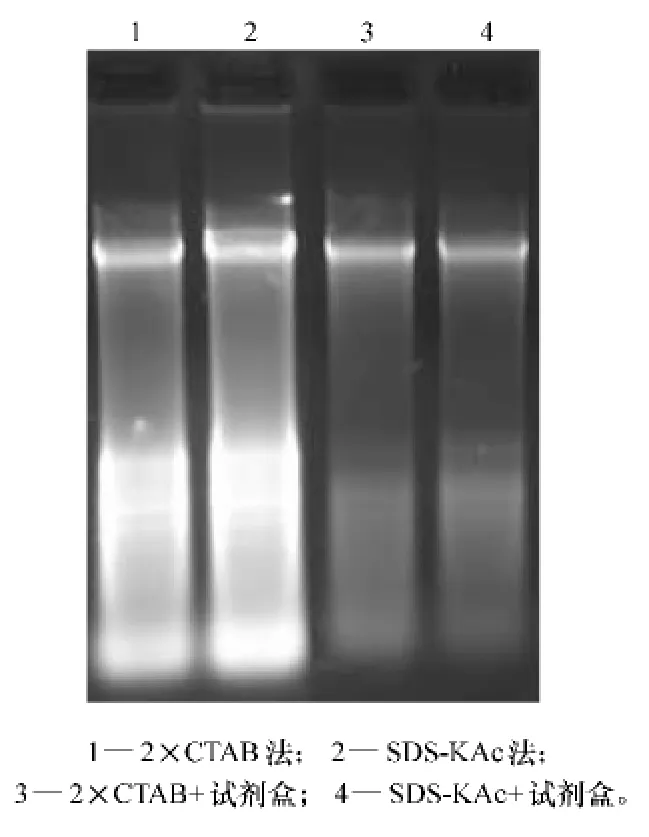
图1 番木瓜DNA电泳图谱

图2 番木瓜DNA的Sau3AI和EcoRI酶切

图3 番木瓜Actin基因的扩增
采用2×CTAB法分别提取了两性株与雌株的基因组DNA,分别扩增番木瓜Actin基因和SCAR性别连锁标记。将PCR产物跑电泳,结果如图4所示,两性株和雌株都能扩增出Actin基因,但是只有两性株能扩增出SCAR标记,说明SCAR标记仅出现在两性株的基因组中,因此PCR扩增可以鉴定番木瓜性别。

图4 番木瓜性别连锁SCAR标记的扩增
4 讨论
番木瓜株性复杂,有雄株、雌株和两性株,是研究植物性别决定的模式植物。早在20世纪30年代,Hofmeyr[7]和Storey[8]就推断番木瓜的性别受3个复等位基因控制,雄株、两性株及雌株的基因型分别为M1m、M2m、mm。Horovitz和Jimenez[9]根据属间杂交的结果提出番木瓜性别是由性染色体决定的,属于经典的XXXY型。随着研究的深入,Liu等[10]认为番木瓜包含一个原始的Y染色体,其雄性特异区域可能与2亿4千万到3亿2千万年前人Y染色体的祖先相似。
番木瓜雄株一般不结果,雌株和两性株均能结果,但是雌株果实果腔大、果肉薄,市场价值不如两性株果实。番木瓜性别分化较迟,一般在开花后才能准确鉴别其性别,因此在生产中果农总是1个穴中种2~3株小苗,等到7~9个月开花后再将雄株和雌株拔掉,这在生产上造成极大的浪费[11]。因此,番木瓜性别早期鉴定在番木瓜生产上具有重要意义。Deputy等[5]获得了与番木瓜性别紧密连锁的2个RAPD标记,并将其转化为SCAR标记。SCAR T12在两性株上能扩增出约800bp的特异条带,而在雌株中不出现,重复性良好,能很好地将两性株和雌株区分开,在生产上具有重要应用价值。
番木瓜是热带、亚热带常种果树,在我国广东、广西、云南、台湾、福建等地广泛种植[12]。在福州,番木瓜全年开花,雌花没有雄蕊,花型胖大,两性花既有雌蕊又有雄蕊,花型瘦小,容易分辨,方便学生自己动手采集、处理材料,完成实验全过程。
常规植物组织DNA提取方法中,一般将植物组织放在液氮中研磨成粉末,这样有利于抑制DNAase的作用,以防DNA降解。在我们所用的4种方法中均没有使用液氮,因为液氮价格较贵,而且易挥发,不容易保存。本研究中,将番木瓜叶片直接放在提取缓冲液中,室温下进行研磨,未见DNA降解,效果良好。实验证明,4种方法提取的DNA虽然都有些杂质污染,但是可以进行PCR扩增、酶切鉴定等实验。4种方法与传统DNA提取方法[3]相比,简化了多个实验步骤,因此大大节约了操作时间。传统DNA提取大约2h,而这4种改进方法只需约1h就可以完成。2×CTAB法比SDSKAc法少1个步骤,可以节约10min时间。与试剂盒结合的方法又比上面2种方法节约10min时间。因此,如果没有时间上的考虑,完全可以选用前面2种传统方法,而且全部用的是常规药品,价格便宜。其实,植物基因组DNA提取试剂盒种类很多,效果也不错,作者之所以选用质粒提取试剂盒,也是出于价格的考虑。天泽柱式植物DNA提取试剂盒50次包装的价格为390元,而天泽柱式质粒提取试剂盒100次包装的价格仅为99元。因此,在教学经费短缺,又想让学生感受柱式植物DNA提取时,采用2×CTAB或SDS-KAc+质粒提取试剂盒法是不错的选择。
(References)
[1]申艳红,陈晓静.适合本科教学的“DNA粗提与鉴定”实验[J].生物学通报,2008,43(12):33-34.
[2]皮妍,林娟,郭滨,等.改革遗传学实验教学方法培养新型创新人才[J].实验室研究与探索,2008,27(10):86-88.
[3]王关林,方宏筠.植物基因工程[M].2版.北京:科学出版社,2005:755.
[4]何玮毅,陈晓静,申艳红,等.番木瓜组培苗叶片基因组DNA的微量提取[J].福建农林大学学报:自然科学版,2009,38(1):34-38.
[5]Deputy J C,Ming R,Ma H,et al.Molecular markers for sex determination in papaya(Carica papayaL)[J].Theor Appl Genet,2002,106(1):107-111.
[6]申艳红,陈晓静,何玮毅,等.番木瓜肌动蛋白CpActin基因的克隆及在果肉中的表达研究[J].果树学报,2010,27(6):859-862.
[7]Hofmeyr J D J.Genetical studies of Carica papayaL[J].South African Department of Agriculture and Science Bulletin,1938,187:64.
[8]Storey W B.Segregation of sex types in Solo papaya and their application to the selection of seed[J].American Society for Horticultural Science Proceedings,1938,35:83-85.
[9]Horovitz S,Jim nez H.Cruzamientos interespecificos e intergenericos en caricaceas y sus implicaciones fitotechicas[J].Agron Trop,1967,17:323-343.
[10]Liu Z Y,Moore P H,Ma H,et al.A primitive Y chromosome in papaya marks incipient sex chromosome evolution[J].Nature,2004,427:348-352.
[11]Urasaki N,Tokumoto M,Tarora K,et al.A male and hermaphrodite specific RAPD marker for papaya(Carica papayaL)[J].Theor Appl Genet,2002,104(2/3):281-285.
[12]华南农业大学.果树栽培学各论[M].北京:中国农业出版社,1989:243.
