pIRES-PML-RARα重组载体的构建和表达研究
2013-09-07胡刚岑东芝杨力建陈少华周羽竝李扬秋
胡刚,岑东芝,杨力建,陈少华,周羽竝,李扬秋,4
(1.广东省惠东县人民医院内一科,广东 惠东 516300;2.暨南大学医学院血液病研究所;3.暨南大学医学院生物化学教研室;4.暨南大学再生医学教育部重点实验室)
利用染色体易位形成的融合基因构建疫苗诱导机体产生特异抗白血病免疫效应,是白血病疫苗研究领域的一个热点,这种疫苗对清除微小残留病变,提高疗效有重要作用[1-7]。DNA疫苗所包含的目的基因序列以及基因片段的大小,对于DNA疫苗的免疫效果至关重要,如何筛选出合适的抗原片段是DNA疫苗研发的一个重要内容。为了选择合适的PML-RARα融合基因片段用于构建DNA疫苗,本研究选择在PML-RARα基因融合点附近通过逆转录多聚酶链反应 (reverse transcription polymerase chain reaction,RT-PCR) 扩增出包含融合点的具有不同基因序列长度不同的PMLRARα融合基因片段,并利用这些融合基因片段构建重组真核表达质粒。
1 材料与方法
1.1 材料 pIRES质粒、NB4细胞株由本实验室保存,DH5α感受态菌株购自北京天为时代公司,内切酶和连接酶购自大连宝生 (TaKaRa)生物公司,Taq酶购自 Promega公司,LipofectamineTM2000购自Invitrogen公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中PMLRARα基因编码序列特点,按照酶切位点对侧翼序列的要求设计包含相应酶切位点的引物,引物由上海博亚生物公司合成。引物构成如下:用于扩增PML-RARα基因 (245 bp) 的引物 (上游引物编号为 PP1,下游引物为 PP2):PP1:5'-TTA GCTAGC ACCATGCTGGATGGACCGCCTA-3'( 方框内为NheⅠ酶切位点)。PP2:5'-CAA ACGCGT CTACTCACTCAGTAGCCTGAGGACTTG-3'(方框内为MluⅠ酶切位点),扩增的目的片段长度为245 bp,PCR 产物标记为 PML-RARα(1)。
用于扩增PML-RARα基因 (384 bp)的引物(上游引物编号为PP3,下游引物为PP4):PP3:5'-CAA GCTAGC AGCATGGTCTCCAATACAACGA-3'(方框内为 NheⅠ酶切位点)。PP4:5'GCG ACGCGT TCAGTCCTGACAGACAAAG-3'(方框内为MluⅠ酶切位点)。扩增的目的片断长度为384 bp,PCR 产物标记为 PML-RARα[2]。
1.2.2 PCR扩增 从NB4细胞株中提取RNA逆转录合成cDNA作为模板 (NB4细胞的RNA提取和cDNA合成均按常规方法进行),PP1和PP2作为引物扩增出 PML-RARα(1),PP3和 PP4作为引物扩增出 PML-RARα(2)。总反应体积为 20 μl,其中含2 μl cDNA和1 U聚合酶 (Promega),其余各试剂的终浓度为:引物 0.5 μmol/L,dNTP 0.1 mmol/L,MgCl21.5 mmol/L,1×Buffer。反应在PCR扩增仪 (BioMetra)中进行。反应条件:首先94℃ 3 min,然后94℃ 1 min,56℃ 1 min,72℃1 min循环30次,最后72℃ 6 min。扩增产物(标记为PCR1)。扩增产物用1.5%琼脂糖凝胶电泳检测,胶回收试剂盒纯化后备用。
1.2.3 pIRES-PML-RARα 重组质粒的构建和鉴定将纯化后的 PCR 产物 PML-RARα(1)和 PMLRARα(2)用NheⅠ和MluⅠ (TaKaRa)进行双酶切后分别与经过同样酶切处理的pIRES质粒利用T4 DNA连接酶 (TaKaRa)连接后,转化DH5α感受态菌。用NheⅠ/MluⅠ双酶切筛选出含有245 bp和382 bp的外源插入片段的阳性克隆pIRESPML-RARα(1)和 pIRES-PML-RARα(2)。
1.2.4 重组质粒DNA序列分析 1 μl质粒DNA用于直接序列分析,应用非放射性、双脱氧核苷酸末端终止法和 Big-Dye Terminator cycle sequencing ready reaction试剂盒及3100 DNA测序仪(ABI,Perkin Elmer)进行序列分析。
1.2.5 转染真核细胞后在转录水平进行检测 利用LipofectamineTM2000 Kit转染K562细胞,收集转染后培养48 h的K562细胞提取总RNA,逆转录合成cDNA作为模板,分别用引物PP1、PP2(用于扩增 PML-RARα(1),245 bp) 和 PP3、PP4(用于扩增 PML-RARα(2),384 bp) 进行 PCR扩增,PCR产物于琼脂糖凝胶电泳观察结果。以转染pIRES-PML-RARα(1)后的 K562 细胞的 RNA 和 cDNA为模板,以PP1、PP2作为引物,进行实时荧光定量PCR检测。
2 结果
2.1 目的基因的扩增 以NB4细胞的cDNA作为模板,分别用引物PP1、PP2和PP3、PP4进行扩增,扩增出两种不同长度的PML-RARα基因片段,其大小分别为245 bp和384 bp,PCR产物琼脂糖凝胶电泳结果如图1、图2所示,产物大小与预期结果相符。

图1 PML-RARα(1)基因PCR产物电泳图
2.2 重组质粒的构建及鉴定 构建的pIRES-PMLRARα(1)重组质粒经过NheⅠ和MluⅠ双酶切鉴定证明有大小为245 bp的外源插入片段 (图3)。构建的 pIRES-PML-RARα(2)重组质粒经过 Nhe Ⅰ和MluⅠ双酶切鉴定证明有大小为384 bp的外源插入片段 (图4)。
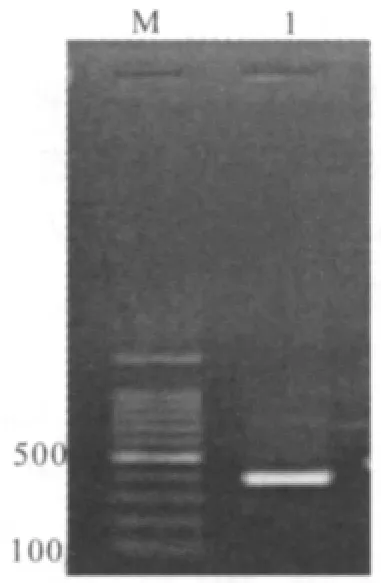
图2 PML-RARα(2)基因PCR产物电泳图

2.3 序列分析结果 序列分析结果证实重组质粒中外源插入片段分别与GenBank中各种不同长度的PML-RARα基因序列完全一致,重组质粒pIRES-PML-RARα(1)测序结果见图 5,重组质粒pIRES-PML-RARα(2)测序结果见图 6。

2.4 转录水平检测外源质粒在真核细胞中的表达转染后培养48 h的K562细胞提取总RNA,逆转录合成cDNA作为模板,用于扩增PML-RARα基因,PCR结果显示转染了各种重组质粒的K562细胞的cDNA中均含有相应的目的基因,提示这些质粒都已经成功地转染到了K562细胞中,并且能够在细胞中进行正常转录。
以转染 pIRES-PML-RARα(1)后的 K562 细胞的RNA和cDNA为模板,分别以PP1、PP2作为引物,实时荧光定量PCR检测结果见图7。图中曲线A代表cDNA模板的检测结果,曲线B代表RNA模板的检测结果。从该图中可以看到对于同一种标本,以cDNA为模板的PCR体系荧光信号开始出现指数增长的循环数比以RNA为模板的PCR体系少,即前者的Ct值比后者要低 (Ct值的定义是PCR扩增过程中,荧光信号开始由本底进入指数增长阶段的阈值所对应的循环次数)。说明cDNA模板中含有的相应目的基因拷贝数要高于RNA模板,而这是因为cDNA模板中含有被转染细胞表达的目的基因的cDNA所致。
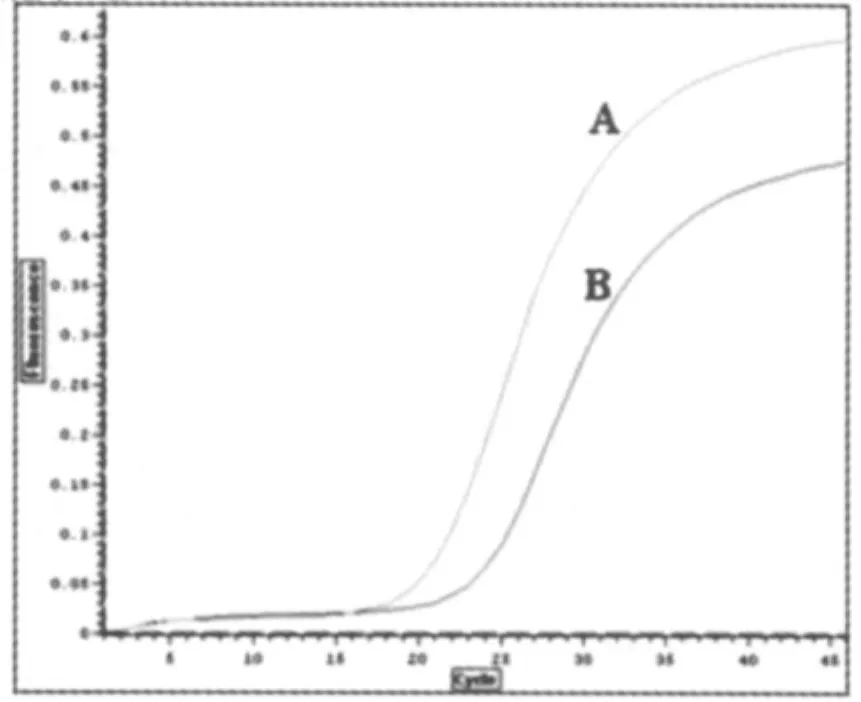
图7 实时荧光定量PCR检测结果
3 讨论
利用白血病融合基因构建DNA疫苗,是当前疫苗研究领域的热点。利用BCR-ABL融合基因构建的DNA疫苗,可以体外诱导特异性抗白血病效应[1,5]。由于许多急性早幼粒细胞白血病 (acute promyelocytic leukemia,APL)患者体内存在 t(15;17) (q22;q21),形成 PML-RARα 融合基因。有研究发现含有PML-RARα融合基因的细胞可诱导T细胞克隆性增殖[6],该现象提示 PMLRARα融合蛋白可以被MHC分子加工提呈,因此可以利用PML-RARα融合基因诱导产生针对APL细胞的特异性免疫应答。Osman等[2]利用 PMLRARα融合蛋白诱导PML-RARα肽特异的CD4+或CD8+CTL。Padua 等[3]应用 PML-RARα 融合基因制备的DNA疫苗在小鼠体内诱导出了特异性免疫保护作用。在构建DNA疫苗时,DNA疫苗所包含的目的基因序列以及基因片段的大小,对于DNA疫苗的免疫效果至关重要,如何筛选出合适的抗原片段是DNA疫苗研发的一个重要内容。为了比较包含不同长度PML-RARα基因片段的DNA疫苗的免疫效果,本研究尝试构建了包含245 bp和384bp 的 pIRES-PML-RARα(1)和 pIRES-PMLRARα(2)真核表达质粒,通过序列分析证明了该克隆的正确性,并且该质粒能够在真核细胞中正常转录。本研究的进一步目的在于筛选出用于构建DNA疫苗的合适的PML-RARα基因片段,下一步我们还将在PML-RARα基因融合点附近扩增出不包含融合点的PML-RARα基因片段用于构建重组质粒,并将这些质粒与我们前期已经构建成功的质粒进行小鼠体内试验,以筛选出具有最佳免疫原性的PML-RARα基因片段,从而为治疗APL的DNA疫苗研发提供重要资料。
[1]Sun JY,Krouse RS,Forman SJ,et al.Immunogenicity of a p210(BCR-ABL)fusion domain candidate DNA vaccine targeted to dendritic cells by a recombinant adeno-associated virus vector in vitro [J].Cancer Res,2002,62(11):3175 -3183.
[2]Osman Y,Takahashi M,Zheng Z,et al.Dendritic cells stimulate the expansion of PML-RAR alpha specific cytotoxic T-lymphocytes:its applicability for antileukemia immunotherapy [J].J Exp Clin Cancer Res,1999,18(4):485-492.
[3]Padua RA,Larghero J,Robin M,et al.PML-RARA-targeted DNA vaccine induces protective immunity in a mouse model of leukemia[J].Nat Med,2003,9(11):1413-1417.
[4]胡刚,李杨秋,陈少华,等.pIRES-PML-RARα-hIL-2 重组质粒的构建和表达研究[J].癌症进展,2008,6(4):357-361.
[5]张玉平,李扬秋,陈少华,等.慢性粒细胞白血病相关的TCR Vβ T细胞的诱导及其限制性和克隆性分析[J].中国病理生理杂志,2004,20(3):330-334.
[6]汤冀,李扬秋,杨力建,等.NB4和HL-60细胞诱导的脐血T细胞TCR Vβ基因谱系分析 [J].暨南大学学报,2005,26(6):740-745.
[7]Cen D,Hu G,Zhou Y,et al.Enhancement of specific cellular immune response induced by DNA vaccines encoding PML-RARalpha and hIL-2 genes [J].Hematology,2010,15(2):88 -95.
