骨髓源性血管内皮祖细胞的分离培养及鉴定
2013-09-07韩莹施鹏王奕丹闫青爽韩清吴璠张玲
韩莹,施鹏,王奕丹,闫青爽,韩清,吴璠,张玲*
(1.沈阳医学院基础医学院病理教研室,辽宁 沈阳 110034;2.沈阳医学院奉天医院妇科;3.沈阳医院基础医院2011级临床医学专业4班;4.沈阳市文官屯95979部队卫生教研室)
自从Asahara等首次报道外周血存在内皮祖细胞 (endothelial progenitor cells,EPCs)且具有分化为成熟内皮细胞的潜力以来,对EPCs促进血管再生的研究,尤其是组织缺血所致损伤后局部EPCs的增殖分化迁移更是倍受青睐[1]。然而EPCs在缺血局部的增殖分化迁移回归巢数量从目前实验研究结果看尚不理想,为此,本实验旨在通过观察由大鼠骨髓单个核细胞分离,体外诱导培养EPCs的生长过程,对其进行鉴定,建立一套重复性好、纯度高的培养方法,从而为EPCs下一步研究打下基础。
1 材料与方法
1.1 材料 3~4周龄Wistar雄性大鼠,体重300~400 g,中国医科大学实验动物中心提供。纤维连接蛋白 (FN)(美国BD公司),优级胎牛血清(FBS,杭州四季青公司),EGM培养基试剂盒(美国 Cloncties公司),血管内皮细胞生长因子(vascular endothelial growth factor,VEGF) (美国Peprotech公司),碱性成纤维细胞生长因子 (basic fibroblast growth factor,bFGF)(美国 Peprotech公司),兔抗CD34单克隆抗体、兔抗CD133单克隆抗体 (北京博奥森公司),兔抗Ⅷ多克隆抗体 (武汉博士德公司),大鼠淋巴细胞分离液 (天津灏洋公司),SP试剂盒、兔抗山羊 IgG FITC(Santa Cruz)。
1.2 方法
1.2.1 EPCs的分离培养 (1)骨髓细胞的获取:颈椎脱臼法处死大鼠,75%酒精浸泡消毒后无菌操作,取大鼠股骨、胫骨,将其移入培养液内,使其完全浸入防止凝固。用10 ml注射器抽吸培养液,从骨髓腔一端向另一端反复吹打,直至骨髓腔呈白色。(2)单个核细胞的分离:将细胞混悬液移入试管,1 000 r/min离心10 min。在另一试管中加入淋巴分离液 (密度1.083)5 ml。细胞混悬液分离后,弃上清,加入PBS 5 ml并充分吹打混匀。将该细胞混悬液用吸管在淋巴分离液上方2~3 cm处沿管壁缓缓加入盛有淋巴分离液的试管,使二者体积比为1∶1,2 000 r/min离心20 min。用吸管轻轻插到白膜层,沿管壁周缘轻轻吸取白膜。将白膜层吸入另一试管,加入PBS液5 ml,混匀后1 000 r/min离心10 min。(3)单个核细胞计数:离心后弃上清,加入PBS液3 ml,混匀后吸出100 μl,加入 PBS液2 ml中 (1∶20稀释),按公式:3 ml溶液所含细胞总量=镜下4个中方格细胞总数÷4×20(稀释倍数) ×3(液体总量) ×104,计算分离所得细胞总数。同时在试管内追加 PBS液2 ml,1 000 r/min离心10 min。(4)EPCs接种培养:离心后弃全部上清,分别加入1 ml常规EPCs培养液与特殊EPCs培养液 (含地塞米松和维生素C)中各自混匀,根据计数结果,吸相应数量的细胞混悬液到3 ml培养基中,使各自细胞浓度均达到4×106/ml,然后将细胞接种到24孔板上,每孔0.5 ml(1×106/cm2)。放入37℃、5%CO2、饱和湿度100%的培养箱中培养。48 h半量换液,以后每3 d半量换液1次。(5)EPCs的消化及计数:细胞生长第7天,取出培养板,先将培养液吸出,D-Hank's液洗2遍,加入0.25%胰酶、0.02%EDTA各0.5 ml,放培养箱3~5 min,并随时倒置显微镜下观察,多数细胞突起回缩、变圆时,及时用等量含胎牛血清的培养液终止消化,移入试管,再用D-Hank's液轻轻吹打培养板上仍贴壁细胞2遍,将洗涤液一同加入试管,1 000 r/min离心10 min。弃上清,PBS洗2遍后,加入1 ml PBS液,显微镜下计数细胞数目,移植备用。另取部分细胞加入培养液爬片鉴定。(6)EPCs的爬片和鉴定:将细胞悬液接种到放有玻片 (预先铺一层FN)的6孔板中爬片,在37℃、5%CO2、饱和湿度95%的培养箱中培养24 h后,各孔加入PBS洗2遍,取出玻片,4%多聚甲醛固定15 min,再用PBS洗2遍,干燥后,-20℃冰箱保存或直接免疫组化鉴定。
1.2.2 EPCs鉴定
1.2.2.1 细胞形态学鉴定及生长曲线测定 通过光学显微镜观察诱导培养1、7、15 d的细胞形态学变化。将原代 EPCs制备细胞悬液,以5×103个/孔的密度接种于包被FN的96孔板中,每孔体积200 μl。从1~14 d,隔日随机抽取4个培养孔,每孔加入MTT溶液 (5 g/L)20 μl,37℃继续孵育4 h,终止培养,吸出孔内上清,每孔加入100 μl DMSO,振荡10 min,使结晶能充分溶解。选择490 nm波长比色,在酶联免疫检测仪上测定各孔OD值,以时间为横轴,吸光值为纵轴,绘制细胞生长曲线。设不加细胞只加培养液的为空白对照孔。
1.2.2.2 免疫组化鉴定 将由FN包被培养4、7、9、14 d的细胞爬片,爬满后PBS洗涤,10%中性甲醛固定,按SP试剂盒的说明操作,分别滴加CD34、CD133、vWF、ⅧF一抗,DAB染色,阳性细胞呈棕黄色。用PBS作阴性对照。
1.2.2.3 内皮祖细胞吞噬功能的鉴定 取消化培养的细胞悬液离心 (4℃,300 r/min,6 min)后去上清,用加入5 ml培养液稀释并计数;在细胞悬液中加入12.5 pg(密度:2.5 pg/mL)的DilacLDL在37℃孵育1h,然后用2%多聚甲醛固定细胞10 min,PBS 洗后加入 50 μg(密度:10 μg/ml) 的FITC-UEA-l,37℃孵育1 h后,激光共聚焦显微镜观察。Dil-acLDL 和 FITC-UEA-1,双染色阳性细胞(黄色)被认为是正在分化的EPCs。
2 结果
2.1 EPCs形态变化及生长状况 培养4 d换液去除未贴壁细胞后,细胞形态多为短梭型或多角形;培养7 d,梭型细胞较前增多,形成细胞团,可见集落形成;10 d可见细胞形成索状或网状血管样结构;14 d时,细胞呈鹅卵石样外观,见图1。
2.2 免疫组化鉴定 按照上述方法对培养细胞进行免疫组化鉴定,结果显示:CD133(+),CD34(+),ⅧF(++),vWF(+)。见图2。

2.3 EPCs 摄 取 DiL-acLDL,结 合 FITC-Lectin-UEA-1的实验 培养细胞胞浆摄取DiL-acLDL呈红色,胞膜结合 FITC-Lectin-UEA-1呈绿色,正在分化的EPCs为黄色。见图3。
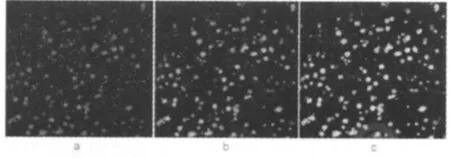
图3 培养细胞摄取DiL-acLDL呈红色 (a),结合FITC-Lectin-UEA-1呈绿色 (b),正在分化的EPCs为黄色 (c)免疫荧光染色(×200)
2.4 大鼠骨髓来源EPCs原代培养生长曲线分析
大鼠骨髓单个核细胞接种后,前3 d细胞数量变化不大,生长较缓慢,为生长的潜伏期,5~8 d细胞生长增殖速度加快,并形成集落,为对数生长期,9 d后,细胞基本铺满培养板底部,进入生长平台期。见图4。

图4 EPCs生长曲线
3 讨论
目前已知,血管再生主要由血管新生 (angiogenesis)与血管发生 (vasculogenesis)两部分构成,血管新生是指从原有血管的成熟内皮细胞的增殖和迁移,以出芽或分裂的方式长出新的毛细血管的过程;血管发生则是指通过来自于循环中的骨髓起源EPCs,聚集到新生血管的部位并在原位分化为血管内皮细胞,并形成血管的过程[2]。EPCs的增殖分化迁移的潜能及参与组织缺血或损伤后的归巢、血管新生的作用使其在各种缺血性疾病、血管性损伤以及肿瘤的诊治方面,有着广泛的应用前景,进一步深入研究EPCs有可能为这些疾病治疗开辟新的思路。
从现有研究成果来看,EPCs尚无特异性的表面标志,但不同来源、不同发育阶段的EPCs却具有不全相同的表面标志。EPCs分化早期主要表达CD34和CD133。CD34是干细胞抗原,除表达于造血干细胞外,在成熟内皮细胞也有低水平表达。它的功能可能是作为造血和内皮前体细胞相互作用的黏附分子,CD34缺失会导致造血和血管形成缺陷;CD133主要表达于造血干细胞和一些前体细胞,其确切功能尚不清楚,CD133+细胞具有分化为包括内皮细胞在内的多种细胞的能力。随着EPCs向成熟内皮细胞分化,CD133快速丢失,所以CD133对于鉴定内皮细胞和EPCs具有较高特异性[3]。
利用EPCs表面CD34、CD133标志对单个核细胞进行分选,在含有促进内皮细胞生长因子的培养基中培养可获得纯度较高的细胞。但由于缺乏特异的EPCs表面标志,对其判定仍有争议。有学者认为CD34+细胞并不是真正的EPCs,而只是可以调节血管形成。而且,体外实验表明只有CD34+和CD34-细胞共同培养时,才能形成血管样结构。CD34+和CD34-细胞共同移植于血管损伤动物体内,比任何一种细胞单独移植都会产生更多的新血管。因此,CD34+可能并不是EPCs的一个关键表面标志。最近还有研究表明EPCs也可能存在于 CD34-和 CD133-单核细胞群[4],Friedrich 等从 CD34+/CD133+/VEGFR-2+前体细胞中分离出 EPCs,而 Kim等[6]从脐血 CD133+/CD14+细胞中分离出EPCs。鉴于此,本实验采用贴壁培养法进行大鼠骨髓EPCs培养。
体外培养过程中,EPCs对周围微环境的要求很高,除了对细胞分离液密度有严格要求外,对单个核细胞悬浮液的离心速度也非常重要,离心速度过快易使细胞受损,碎片增多成活细胞减少,离心过慢则会使单个核细胞与其它细胞混杂,细胞纯度降低。因此掌握适当的离心速度也是EPCs培养的关键。另外VEGF作为定向分化依赖的特定细胞因子,通过其高亲和力受体作用于内皮系细胞,促进其分裂、增殖和迁移,在EPCs的培养中亦不可或缺。
在培养中我们还发现,单个核接种密度对细胞的生长很重要,当接种密度为1×106/cm2时细胞贴壁和分化较理想,这说明干细胞的增殖与分化依赖于细胞之间的相互作用,一定的接种密度允许细胞间充分的促进作用又不至于过分消耗养分或产生抑制。采取半量换液要比全部换液细胞生长好,这说明细胞可能分泌了一些未知的细胞因子促进了内皮祖细胞的生长与分化。贴壁对于EPCs的培养也非常重要,尽管常用的促贴壁物质有FN、明胶和贴壁因子等,但由于FN的高糖可增强细胞间黏连、细胞与基质的黏连,还通过细胞信号转导途径调节细胞的形状和细胞骨架的组织,促进细胞铺展。因此我们选用PBS稀释后的FN包被培养板,更有利于细胞的贴壁,有利于骨髓的单个核细胞向EPCs方向发展。
文献中应用EPCs进行实验的时间多为培养后7 d左右,鉴定也多于此时间段进行。EPCs的鉴定缺乏特异标准,应用流式细胞仪进行表型特征鉴定是常用方法之一。一般认为,EPCs表型特征包括:CD34+/CD133+/KDR+(VEGF-2)。但因三者皆为阳性的细胞数稀少,研究中多采用CD34+/CD133+、 CD34+/KDR+(VEGF-2) 或CD133+/KDR+(VEGF-2) 细胞作为 EPCs的标志。另一种常用的鉴定方法为摄取DiL-acLDL和结合 FITC-UEA-1实验,免疫荧光检测 DiL-acLDL和FITC-UEA-1双阳性的细胞为正在分化的EPCs。本实验中骨髓单个核细胞培养7 d后,应用DiL-acLDL和FITC-UEA-1免疫荧光染色后,双阳性细胞>90%,10 d时,双阳性细胞仍>80%,为正在分化的EPCs,说明本实验所用方法可获得较高纯度的EPCs。无论是骨髓还是外周血EPCs含量都极少,在应用EPCs应用于疾病治疗的前提条件是进行体外扩增。本实验细胞培养至第7天时,EPCs的数量等级为106,可以达到实验研究的需要。
目前,EPCs的分离培养尚无统一的标准,不同实验室分离和培养的EPCs方法条件差异较大,所培养的细胞表型特征和分化潜能亦有差别。本实验建立了一套较成熟的分离、培养以及鉴定大鼠骨髓来源的EPCs的方法,为进一步研究提供了实验基础和理论依据。
[1]Arasaha T,Masuda H,Takahashi T,et al.Isolation of putative progenitor endothelial cells for angiogenesis [J].Science,1997,275:964-967.
[2]赵旺,罗勇.血管内皮祖细胞与脑缺血的相互关系[J].中国脑血管病杂志,2009,6(5):272-276.
[3]王亮,焦俊峰,王晓楠,等.脑损伤大鼠内皮祖细胞与早期血管新生的关系[J].中国神经精神疾病杂志,2010,36(3):168-170.
[4]Matina K,Stavros D,Katherini P,et al.Circulating endothelial and progenitor cells:Evidence from acute and long-term exercise effects [J].World J Cardiol,2012,264(12):312 -326.
[5]Friedrich EB,Werner C,Walenta K,et al.Role of extracellular signal-regulated kinase for endothelial progenitor cell dysfunction in coronary artery disease [J].Basic Res Cardiol,2009,104(5):613-620.
[6]Kim S,Kim NH,Kim YK,et al.The number of endothelial progenitor cells is decreased in patients with non-dipper Hypertension[J].Korean Circ J,2012,42(5):329 -334.
