钙调蛋白在门静脉高压内脏高动力循环中的作用
2013-09-03陈骏毅周全博张岷陈炜罗蒙
陈骏毅,周全博,张岷,陈炜,罗蒙
(上海交通大学医学院附属仁济医院普外科,上海 200127)
门静脉高压症(portal hypertension,PHT)是由门静脉压力病理性升高所产生的综合征,主要由肝硬化所引起。形成PHT的因素中,肝内血管阻力增加是始动因素,而内脏及全身高血流动力循环是阻力增加的结果,也是维持PHT的继发因素。产生和维持高血流动力循环状态的重要因素是持续的肝外血管扩张,而内脏动脉血管的扩张作用尤为明显[1-2]。在不同的PHT动物模型中都有内脏血管扩张以及血流量增加的现象,从而引起门静脉的血流量增加[3]。目前已知,PHT时内脏血管扩张与血管扩张因子增多相关,其中一氧化氮(nitric oxide,NO)是最具代表性的血管扩张因子之一。动脉产生过多NO在PHT血管功能异常中具有重要作用。众多研究已经证实,PHT中过多产生的NO主要是由于内皮型NO合酶(endothelial nitric oxide synthase,eNOS)活化增加所引起[4-5]。
钙调蛋白(calmodulin,CaM)是一种稳定的钙结合调节蛋白,它参与调控各种生命进程,包括代谢、炎症反应以及血管的收缩与舒张等,是第一个被证实的可以调节eNOS的蛋白。它能够激活eNOS,从而促进NO的生物合成[6]。作为eNOS的调节蛋白,CaM是否参与了PHT内脏血管的扩张反应,国内外相关报道较少。本研究通过观察四氯化碳(CCl4)诱导的肝硬化PHT大鼠门静脉血流动力学指标及肠系膜动脉内CaM的表达变化,并比较CaM特异性抑制剂W-7干预前后PHT大鼠肠系膜微动脉对去甲肾上腺素(norepinephrine,NE)的反应性,探讨CaM在CCl4诱导肝硬化PHT内脏高动力循环中的作用及可能的机制。
1 材料与方法
1.1 实验动物
选择雄性SD大鼠80只,由上海交通大学医学院实验动物中心提供,体重(220±30)g。饲养条件:SPF级动物房,恒温恒湿,光照和黑暗各12 h交替,自由饮水和进食颗粒饲料。随机分为PHT组(n=60)和对照组(n=20),60只SD大鼠制备PHT模型。
1.2 模型制备
将配制好的60%的CCl4油溶液(CCl4∶植物油=3∶2)以 0.05 ml·kg-1作背部皮下注射,共 14 周,每周2次,同时间断饮用5%乙醇,制备PHT模型。对照组以同样的方式和剂量予生理盐水(NS)皮下注射,正常饮食饮水。
1.3 主要仪器、抗体及试剂
微血管灌流槽由美国纽约医学院生理学教研室友情赞助;超声探测仪购自美国百盛公司MYLAB,探头型号为LA523;解剖显微镜和光学显微镜均购自日本Olympus公司;兔抗鼠CaM抗体由美国AbCaM公司提供;p-eNOS抗体由美国Cell Signaling Technology(CST)公司提供;W-7由美国Sigma公司提供;MOPS缓冲液由上海利韬生物科技有限公司提供。
1.4 实验方法
四氯化碳(CCl4)诱导肝硬化门静脉压力>12 mmHg且肝脏有明显结节的大鼠纳入PHT组。PHT模型制备成功后将大鼠分成两部分,一部分(8只)与对照组大鼠各项指标进行对比,剩余的PHT组大鼠再随机分为(1)PHT+W-7组(n=26):W-7溶于 NS配成50 μmol·L-1的溶液,从第 12 周开始,于背部注射CCl4的同时按5 mg·kg-1体重腹腔注射,每周2次,连续注射2周;(2)PHT+NS组(n=26):同样的剂量和方式用NS腹腔注射。
1.4.1 门静脉流量的测定 测定前24 h大鼠禁食、不禁水,10%水合氯醛腹腔注射麻醉成功后,备皮、固定,超声探测仪测量门静脉流量。
1.4.2 门静脉压力的测定 参照文献[7]的方法操作,测定前24 h大鼠禁食、不禁水。第14周造模完成之后,以10%水合氯醛腹腔注射麻醉,麻醉成功后正中切口进腹,分离门静脉主干,将连接穿刺针的导管内充满NS,将穿刺针插入门静脉主干并固定,导管端与换能器连接,通过多功能检测仪直接读取门静脉压力值(将零点设在第一腰椎上方1 cm处,即门静脉起始部水平)。
1.4.3 标本的获取 切取大鼠的全部系膜及小肠,立即置入0~4℃、pH=7.4的MOPS缓冲液中。剪取一段近端小肠及系膜保留备用,其余部分在解剖显微镜下分离并抽取肠系膜上动脉及其主要分支,置于-80℃保存。
1.4.4 血管灌流系统的建立和肠系膜微动脉对NE反应性的测定 参照文献[8]的方法操作。在解剖显微镜下,显微解剖器械锐性分离保留的肠系膜三级微动脉(直径约100 ~150 μm,长约2 ~3 mm),并迅速转移到血管灌流槽。并将此微动脉的近端套在灌流槽入口的玻璃微管上,11-0结扎线固定,加20 mmHg压力冲去管腔内血液,另一端套在出口的玻璃微管上,同样方式固定(分离、转移和固定过程中务必不能损伤血管)。将血管灌流槽与蠕动泵连接,构成循环流动的系统。通过水浴锅的加温作用使循环温度控制在37℃。入口的玻璃微管与压力控制器相连,管腔缓慢加压,达到并维持在80 mmHg。显微镜摄像系统与显示器连接,通过VMR v1.02(一种测量软件)系统可直接测量血管内径。获取三级微动脉并在此环境中稳定30 min,按累积浓度法(10-8~10-5mol·L-1)向循环系统中加入NE,同时记录不同NE浓度下的血管内径,内经改变量(μm)占最大血管内径(μm)的百分比即为收缩率。以血管收缩率为纵坐标,NE浓度的常用对数值为横坐标,绘制NE的量-效曲线图,对比不同分组量-效曲线间的差异以及当收缩率达到50%时NE的浓度(即EC50值)。
1.4.5 肠系膜动脉内CaM和p-eNOS蛋白表达的测定 采用Western-bloting方法分别检测各组肠系膜动脉内 CaM和 p-eNOS的蛋白表达,以 β-actin为内参照。
1.5 统计学处理
2 结 果
2.1 各组门静脉流量
门静脉流量 PHT 组为(1.874 5 ±0.156 54)ml·min-1,明显低于对照组[(2.631 7 ± 0.143 98)ml·min-1],差异有统计学意义(P <0.05)。PHT组大鼠注射 W-7 后,门静脉流量为(1.915 9 ±0.141 43)ml·min-1;在注射 NS后门静脉流量为(1.867 8±0.086 05)ml·min-1。分别与 PHT 组比较,差异均无统计学意义(P >0.05,图1)。
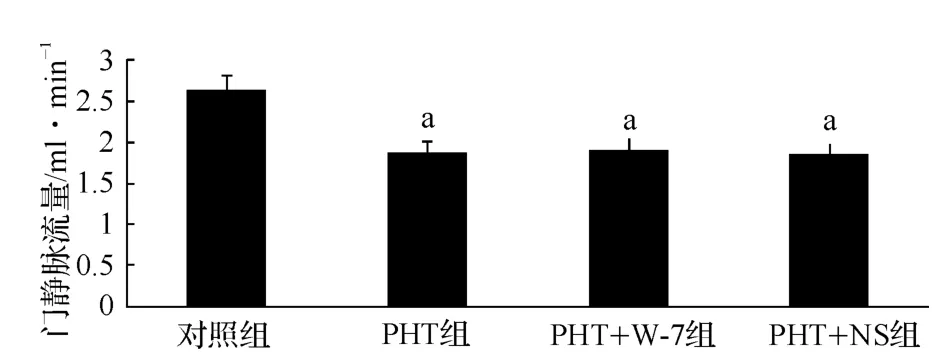
图1 各组大鼠门静脉流量的变化Fig 1 Changes of portal vein blood flow in rats of each group
2.2 门静脉压力的变化
门静脉压力对照组为(7.43 ±0.66)mmHg,PHT组为(15.15±0.78)mmHg,两组差异有统计学意义(P<0.05)。PHT组注射 W-7后,门静脉压力为(14.95±1.24)mmHg;注射 NS 后,门静脉压力为(14.786 ±1.16)mmHg,分别与 PHT 组比较,差异无统计学意义(P >0.05,图2)。
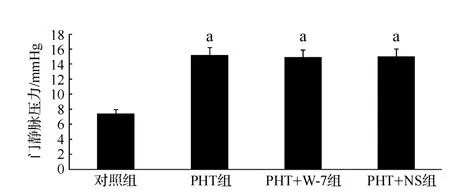
图2 各组大鼠门静脉压力的变化Fig 2 Changes of portal vein pressure in rats of each group
2.3 肠系膜微动脉对NE的反应性
与对照组相比,PHT组大鼠肠系膜微动脉的NE量-效曲线明显右移,EC50也明显增大,差异有统计学意义(P<0.05)。PHT组经W-7处理后,NE量-效曲线明显左移,EC50值也明显降低,差异有统计学意义(P<0.05);而经NS处理前后,PHT大鼠的NE量-效曲线无明显变化,EC50值也无明显差异(图3、4)。
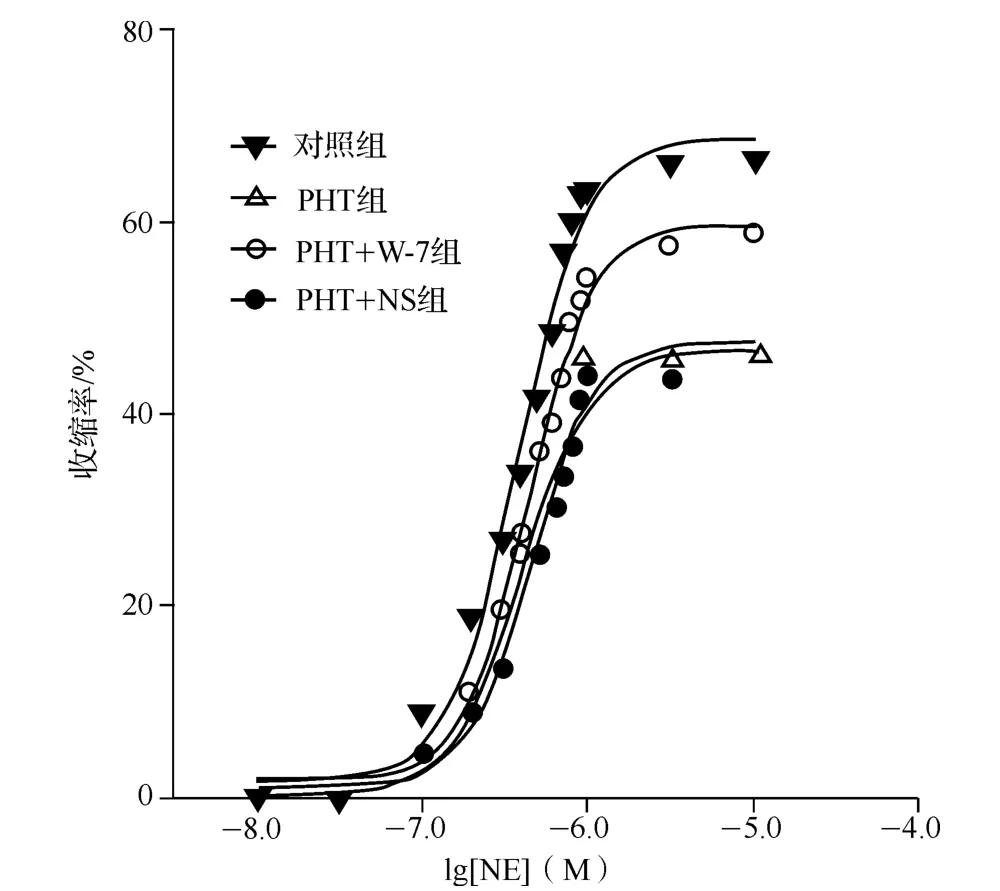
图3 各组大鼠肠系膜微动脉的NE量-效曲线图Fig 3 The dose-response curves of mesenteric microcirculation artery to NE in rats of each group
2.4 各组肠系膜动脉内CaM和p-eNOS蛋白表达的
Western-blot检测结果显示,PHT组肠系膜动脉内CaM和p-eNOS的蛋白表达比对照组明显上调,经W-7干预之后,与PHT组相比,大鼠p-eNOS的蛋白表达明显降低,但NS干预后大鼠p-eNOS的蛋白表达与PHT组无明显变化(图5)。
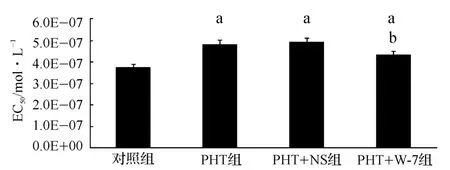
图4 各组大鼠的EC50值,Fig 4 EC50values of rats in each group
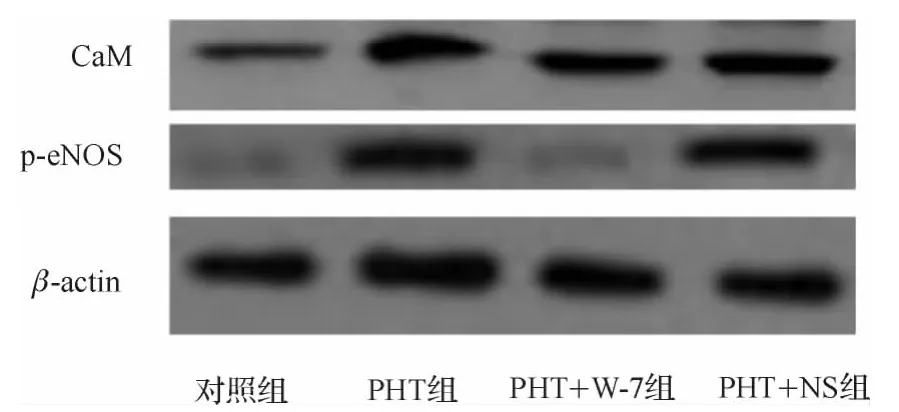
图5 各组大鼠肠系膜动脉内CaM和p-eNOS的蛋白电泳条带图Fig 5 Protein electrophoretic bands of CaM and p-eNOS in mesenteric artery in rats of each group
3 讨 论
本实验通过对比正常大鼠与CCl4诱导的肝硬化PHT大鼠的门静脉血流情况及肝内阻力情况,证实了肝硬化PHT大鼠确实存在门静脉血流量减少及肝内阻力增加的现象;通过测定大鼠离体肠系膜微动脉对NE的反应性变化还证实了肝硬化PHT内脏动脉血管对缩血管物质反应性降低。这些实验结果都与之前对门静脉结扎所致的门静脉高压大鼠的研究结论相一致[9]。
国内、外报道的其他的PHT动物模型中检测到的CaM和p-eNOS表达是升高的[10-11]。我们对CCl4诱导的肝硬化PHT大鼠进行检测,也得了相同的结论。PHT组经CaM特异性抑制剂W-7处理后,大鼠内脏动脉内p-eNOS表达明显降低。我们还发现,W-7可以增加肝硬化PHT大鼠肠系膜微血管对NE的反应性,这些均说明过表达的CaM可能通过促进eNOS活化为p-eNOS,引起NO合成增加,参与PHT大鼠内脏动脉低反应性的形成。W-7通过抑制eNOS的活化来增强肠系膜微动脉对NE的反应性,但又未能将其完全逆转,说明还有其他的因素参与了PHT内脏血管变化和高动力循环的形成,这些结果都与Gadano等[11]研究相一致。PHT组大鼠的门静脉压力较对照组明显升高,说明CCl4诱导肝硬化PHT存在肝内阻力增加,进而引起门静脉流量的减少。但是W-7既不能改善门静脉血流,也不能降低门静脉压力。我们认为门静脉血流动力学的变化及门静脉压力的调节都是受多因素调控的,仅仅通过W-7来阻断CaM信号通路可能并不足以影响门静脉血流及门静脉压力,而且众所周知,肝硬化PHT时肝内、肝外的许多现象是矛盾的,PHT肝外血管扩张的同时,肝内血管却是收缩的,CaM信号通路的阻断可能会增加肝内血管的阻力,从而抵消改善肝外血管功能所带来的益处[12]。
综上所述,本实验通过比较正常组大鼠和肝硬化PHT大鼠的内脏动脉内的CaM和p-eNOS的表达变化、肠系膜微动脉对NE的反应性变化,以及W-7能抑制eNOS的活化并改善肝硬化PHT大鼠内脏动脉对缩血管物质低反应性,证实了肝硬化PHT中过度生成的CaM通过增强eNOS的活化,增加NO的合成,降低内脏动脉对缩血管物质的反应性,进而引起内脏动脉扩张,参与高动力循环的形成,为临床肝硬化PHT相关并发症的治疗提供了新的思路。
[1]IWAKIRI Y.The Molecules mechanisms of arterial vasodilatation observed in the splanchnic and systemic circulation in portal hypertension[J].J Clin Gastroenterol,2007,41,Suppl,3:288-294.
[2]COLLE I,GEERTS A M,Van STEENKISTE C,et al.Hemodynamic changes in splanchnic blood vessels in portal hypertension[J].Anat Rec(Hoboken),2008,291(6):699-713.
[3] HENNENBERG M,TREBICKA J,SAUERBRUCH T,et al.Mechanisms of extrahepatic vasodilation in portal hypertension[J].Gut,2008,57(9):1300-1314.
[4]MARTELL M,COLL M,EZKURDIA N,et al.Physiopathology of splanchnic vasodilation in portal hypertension[J].World J Hepatol,2010,2(6):208-220.
[5]KIM M Y,BAIK S K.Hyperdynamic circulation in patients with liver cirrhosis and portal hypertension[J].Korean J Gastroenterol,2009,54(3):143-148.
[6]PIAZZA M,FUTREGA K,SPRATT D E,et al.Structure and dynamics of calmodulin(CaM)bound to nitric oxide synthase peptides:effects of a phosphomimetic CaM mutation[J].Biochemistry,2012,51(17):3651-3661.
[7]CAO H,XU J,HUA R,et al.Expression of cyclooxygenase in hyperdynamic portal hypertensive rats[J].Hepatobiliary Pancreat Dis Int,2006,5(2):252-256.
[8]SUN D,MESSINA EJ,KALEY G,et al.Characteristics and origin of myogenic response in isolated mesenteric arterioles[J].Am J Physiol,1992,263(5 Pt 2):H1486-1491.
[9]AI J H,YANG Z,QIU F Z,et al.Heat shock protein 90 is responsible for hyperdynamic circulation in portal hypertensive rats[J].World J Gastroenterol,2003,9(11):2544-2547.
[10]THEODORAKIS N G,WANG Y N,WU J M,et al.Role of endothelial nitric oxide synthase in the development of portal hypertension in the carbon tetrachloride-induced liver fibrosis model[J].Am J Physiol Gastrointest Liver Physiol.2009,297(4):G792-799.
[11]GADANO A C,SOGNI P,YANG S,et al.Endothelial calcium-calmodulin dependent nitric oxide synthase in the in vitro vascular hyporeactivity of portal hypertensive rats[J].J Hepatol,1997,26(3):678-686.
[12]SHAH V,CAO S,HENDRICKSON H,et al.Regulation of hepatic eNOS by caveolin and calmodulin after bile duct ligation in rats[J].Am J Physiol Gastrointest Liver Physiol,2001,280(6):G1209-1216.
