鼠胚实验在新建IVF 胚胎培养室中的质控研究
2013-08-29胡卫华侯文文吴满意严永旭
胡卫华,侯文文,吴满意,严永旭
(皖南医学院附属弋矶山医院 生殖医学中心,安徽 芜湖 241001)
目前,质量控制体系(quality control system,QC)已广泛地应用于各种类型的实验室管理及质量控制中[1]。生殖医学中心胚胎实验室是人类胚胎的加工厂,是人类辅助生殖技术(assisted reproductive technology,ART)顺利开展极为重要的核心部分[2]。在开展人类ART 技术前,质量控制实验-鼠胚实验(mouse embryo assay,MEA)是目前最常用于生殖医学中心胚胎培养室的生物学监控方法,适用于新建体外受精(in vitro fertilization,IVF)胚胎培养室的质量控制[3]。我院生殖医学中心于2012年4月建成IVF 胚胎培养室。前期对培养室进行“热处理”后[4],于2012年7~12月间在人IVF 技术条件下对昆明系小白鼠进行体外受精鼠胚和体内受精鼠胚(取原核胚)进行培养观察研究,并对比分析了两组体内外受精胚的受精率、卵裂率、囊胚形成率,旨在对新建胚胎培养室进行质量监控,对技术员操作水平进行训练和评估,为开展人类胚胎体外培养提供可靠的实验依据和质量控制保证。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 4~6 周龄以上雌性昆明系小白鼠(体质量30~35 g);6~8 周龄以上雄性昆明系小白鼠(体质量40~45 g),购自皖南医学院动物实验中心,适应性喂养3~5 d 后进行实验。
1.1.2 药物与试剂 马血清促性腺激素(PMSG)购自天津华孚生物技术公司,人绒毛膜促性腺激素(HCG)为中国丽珠制药生产。采用SAGE QUINN'S ADVANTAGETM 序贯培养液:HEPES 缓冲的HTF操作液(1023)、第三代HTF 培养液(1020)、卵裂培养液(1026)、囊胚培养液(1029)、血清蛋白代用品(SPS 3010)、组织培养油(4008P)等。培养液均于使用前一天下午下班前配制好后,置37 ℃、5.5%CO2、90%以上的湿度培养箱中平衡过夜。
1.1.3 耗材与设备 培养皿、试管、巴斯德管等耗材均为美国FALCON 公司产品,一次性使用。CO2气体纯度为99.995%,美国THERMO 3111 培养箱、日本SANYO 二气培养箱及日本ASTEC 三气培养箱、NIKON 解剖显微镜、NIKON 倒置显微镜、丹麦ORIGIO 1800 恒温百级工作站、德国LABOTECT CO2浓度检测仪等。
1.2 实验方法
1.2.1 鼠精的采集和获能 颈椎脱臼法处死雄鼠,在无菌条件下取附睾尾放入QUINN'S 1020 +10%SPS 液中,用一次性1 ml 注射器小心刺破输精管,轻轻挤压出精子,收集精子悬液置盛有QUINN'S 1020+10% SPS 的FALCON 锥形离心管中,放入37 ℃、5.5%CO2、90%以上湿度的培养箱中获能并直接上游30~60 min。
1.2.2 小鼠超排卵和鼠卵采集 每只雌鼠行腹部消毒后腹腔内注射孕马血清(PMSG)10 IU,48 h 后腹腔内注射人绒毛膜促性腺激素(HCG)10 IU,16 h后颈椎脱臼法处死雌鼠,无菌条件下取出膨大的输卵管,放入盛有QUINN'S 1023 +10%SPS 的培养皿中,用一次性1 ml 注射器刺破输卵管膨大部,将卵团及卵子收集到500 μl QUINN'S 1020 +10%SPS 受精皿中,放入37 ℃、5.5%CO2、90%以上湿度的培养箱中孵育。
1.2.3 体外受精 采用集中受精法(3037 皿,加油覆盖)。待精子获能并上游后在显微镜下观察其活力及浓度,吸取精子悬液到含有卵子的培养液中,使终浓度为(1~2)×106/ml,放入37 ℃、5.5% CO2、90%以上湿度的培养箱中孵育。
1.2.4 原核胚及卵裂期胚胎的观察与培养 D0:受精6 h 后观察原核胚(出现2 原核为受精成功标志),在QUINN'S 1026 +10%SPS 培养液滴中轻轻吹洗后转至新的已平衡好的QUINN'S 1026 +10%SPS 培养液微滴中,每微滴20 μl,放入5~10 枚原核胚,重新置入37 ℃、5.5%CO2、90%以上湿度的培养箱中继续培养;D1:受精16~18 h 后观察鼠胚2-细胞的发育情况;D2:观察4 细胞期鼠胚的发育情况;D3:观察8 细胞期鼠胚发育情况,之后移入已平衡好的QUINN'S 1029 囊胚培养液中序贯培养;D4:观察桑椹期鼠胚及早期囊胚形成情况;D5~D6:观察囊胚期鼠胚及其孵出情况。
1.2.5 小鼠超排卵和原核胚的采集 雌鼠腹腔注射PMSG 10 IU,48 h 后每只雌鼠腹腔注射10 IU HCG,当晚雌雄鼠(1∶1)合笼(注:3 d 内交配过或1周以上交配过的雄鼠不用),第2 天早晨查阴道栓,将明确有阴道栓的孕鼠颈椎脱臼法处死,无菌条件下解剖并取出输卵管放于1020 培养液中,在IVF 工作站解剖显微镜下,37 ℃热平台上用1 ml 注射器针头刺破输卵管膨胀部,原核胚及卵自动流出或轻轻挤出,用拉细的无菌巴氏德管收集原核胚,放置已平衡过夜的1026 培养微滴中,每微滴20 μl,放入5~10 枚原核胚。序贯培养观察鼠胚的发育情况至囊胚形成至孵出(观察方法同体外受精,见1.2.4)。
1.3 数据处理 两组胚胎不同时期的发育情况比较采用两组间χ2检验。
2 结果
2.1 昆明系白鼠体外受精的结果 严格按照人IVF 实验条件的要求,在新建人IVF 胚胎实验室条件下,给24 只昆明系小白鼠进行了24 个IVF 周期,累积获卵938 枚,原核受精胚843 个,受精率为89.87%;2-细胞胚胎数789 个,卵裂率96.32%,卵裂后形成早期囊胚760 个,囊胚形成率为95.39%,实验结果见表1。
2.2 昆明系白鼠体内受精体外培养结果 在新建人IVF 胚胎实验室条件下,共进行了24 个周期原核胚收集,累积获卵916 枚,原核受精胚882 个,受精率96.29%;2-细胞胚胎859 个,卵裂率97.21%,卵裂后形成早期囊胚835 个,囊胚形成率为93.57%,实验结果见表2。
2.3 鼠胚实验在原核受精胚后体外发育情况比较体内受精后获得的受精率为96.29%,2-细胞数859 个;与体外IVF 组获得的受精率为89.87%,2-细胞数789 个;两组经卡方检验,均P <0.05,具有统计学意义。而卵裂率及囊胚形成率两组间差异无统计学意义(P >0.05)。实验结果见表3。
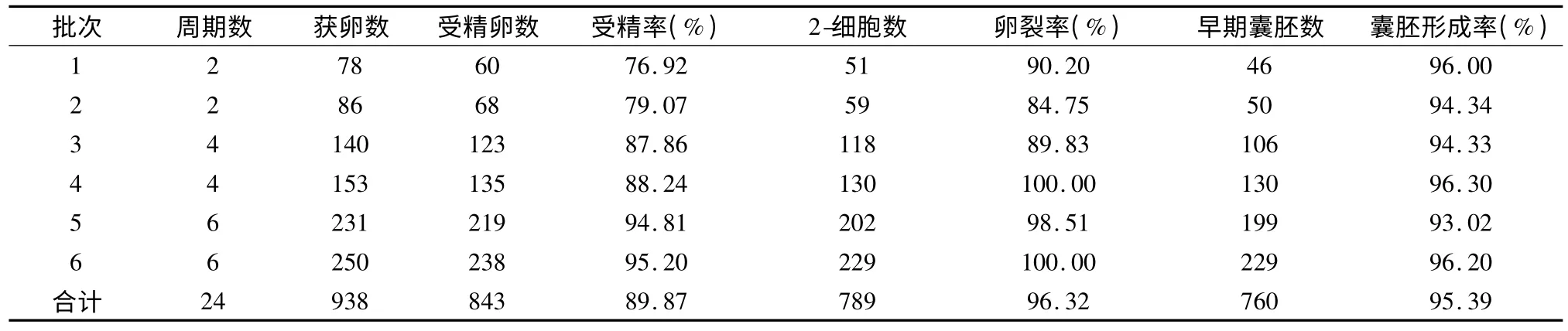
表1 昆明系小白鼠体外IVF 实验结果(%)Tab 1 Experimental results of in vitro fertilization in mice of Kunming species(%)
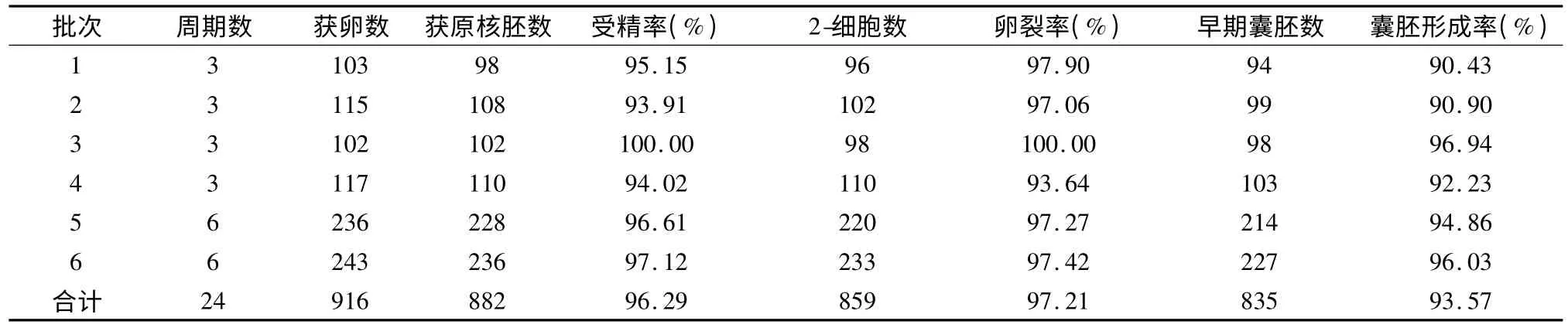
表2 昆明小白鼠体内受精体外培养实验结果(%)Tab 2 Experimental results of in vivo fertilization in mice of Kunming species(%)
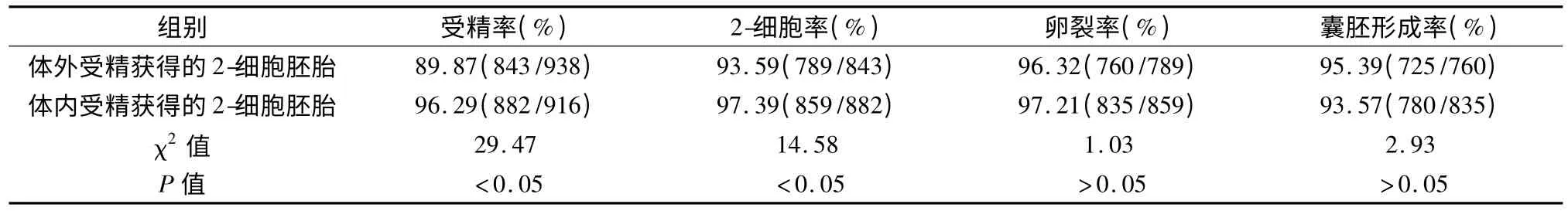
表3 不同来源昆明系小白鼠的2-细胞胚胎体外发育情况比较Tab 3 Comparison of the development frequencies of 2-cells in vitro fertilization embryo from different mouse sources of Kunming species
3 讨论
胚胎实验室是人类辅助生殖技术实施的重要支撑点,是保证ART 成功的重要核心条件。鼠胚实验分析(MEA)适用于新建或新启动周期的IVF 实验室质控[5]。通过动态观察小鼠胚胎发育情况,了解囊胚形成率及孵出等,在反映胚胎发育状况的同时,可监测胚胎实验室的各种因素,包括空气质量、温度、湿度以及各种耗材、培养液、培养箱、CO2气体和技术人员操作水平等[6]。
我们的实验结果表明,小鼠体内或者体外IVF获得的原核受精胚,皆能在胚胎培养室二气或者三气培养箱中发育至囊胚阶段,而且发育状况良好,符合MEA 的质控要求,各项指标均达到质控标准[7-8]。而且,实验结果还表明,小鼠自然合笼体内受精后获得原核受精胚数量多,受精率和2-细胞率高于小鼠体外IVF 结果为96.29%和97.39%,受精率稳定在93.91%以上。考虑小鼠体外IVF 受诸多因素影响,如:不同批次的小鼠其雌鼠和雄鼠状态不一,对环境适应亦存在个体差异。有时雄鼠精子从附睾释出后,观察其精子的存活时间相差悬殊,即可影响受精率[9-10]。除此之外,实验中我们发现:同批次昆明系小白鼠,同样的培养环境,同样批号的试剂、药品等,由不同的实验员同方法同时进行操作,其受精率也会产生差别,故认为不同的技术水平的实验员,操作技术的娴熟程度不一,配子及胚胎在培养箱外的暴露时间长短不一,可得到有差异的实验结果[11]。之后随着胚胎实验室操作人员的技术日益娴熟,小鼠体外IVF 的受精率逐步提高,最后亦能达到90%以上。因此,我们认为体内受精法采集2-细胞胚胎,该方法虽稳定简单,但其不能良好地评价配子及受精卵对培养用品的敏感性,不能对体外受精的整个过程和实验操作人员进行全面评价[12-13]。所以,我们将两种方法结合,对胚胎实验室进行了全面的质量控制,得到了较好的结果,受精率、卵裂率、囊胚形成率等,各项指标均符合辅助生殖实验室质控标准[14]。
4 结论
质量控制在体外受精(IVF)及胚胎培养过程中至关重要[15-16]。在新的胚胎实验室启用前,我们进行必要的通风散气以及热处理后,再给予无毒的吸附炭包净化室内环境之后,我们用二氧化碳检测仪校验培养箱、空气培养监测空气质量等。这些措施较好保证了我们良好的实验结果。因此,我们建议使用小鼠体内受精和体外IVF 这两种方法获得双原核受精胚作为实验室培养体系监测评价指标,特别是对于新建的胚胎培养实验室,在质控的同时促使实验操作人员熟练IVF 全过程,以确保ART 的核心部分-胚胎实验室安全稳定地运行,从而确保为临床提供更多优质胚胎。
[1]SCHWARZER C,ESTEVES TC,ARAUZO-BRAVO MJ,et al.ART culture conditions change the probability of mouse enbryo gestation through defined cellular and molecular reponses[J].Hum Reprod,2012,27(9):2627-2640.
[2]MORBECK DE.Importance of supply integrity for in vitro fertilization and embryo culture[J].Semin Reprod Med,2012,30(3):182-190.
[3]LIERMAN S,DE SUTTER P,DHONT M,et al.Double-quality control reveals high-level toxicity in gloves used for operator protection in assisted reproductive technology[J].Fertil Steril,2007,88(4 Suppl):1266-1272.
[4]黄国宁,孙海翔.体外受精-胚胎移植实验室技术[M].北京:人民卫生出版社,2012:15-37.
[5]KRISHER RL,BRAD AM,HERRICK JR,et al.A comparative analysis of metabolism and viability in porcine oocytes during invitro maturation[J].Anim Reprod Sci,2007,98(1-2):72-96.
[6]STAMATKIN CW,ROUSSEV RG,STOUT M,et al.PreImplantation Factor (PIF)correlates with early mammalian embryo development-bovine and murine models[J].Reprod Biol Endocrinol,2011,15(9):63.
[7]孙新明,魏泓,赵永聚,等.昆明小鼠成熟卵母细胞体外授精及受精卵体外培养的研究[J].中国比较医学杂志,2005,15(3):129-132.
[8]REVIL T,GAFFNEY D,DIAS C,et al.Alternative splicing is frequent during early embryonic development in mouse[J].BMC Genomics,2010,11:399.
[9]金岩.小鼠发育生物学与胚胎实验方法[M].2 版.北京:人民卫生出版社,2005:288-292.
[10]彭新良.ICR 小鼠胚胎试验结果分析对新建IVF 实验室质控的作用[J].基础医学,2009,36(12):25.
[11]MORBECK DE,KHAN Z,BARNIDGE DR,et al.Washing mineral oil reduces conta-minants and embryotoxicity[J].Fertil Steril,2010,94(7):2747-2752.
[12]GARDNER DK,REED L,LINCK D,et al.Quality control in human in vitro fertilization[J].Semin Reprod Med,2005,23(4):319-324.
[13]PENZIAS AS.Recurrent IVF failure:other factors[J].Fertil Steril,2012,97(5):1033-1038.
[14]黄国宁,刘东云,韩伟.辅助生殖技术实验室的建设及其质量控制[J].中国实用妇科与产科杂志,2010,26(10):755-758.
[15]CARRELL DT.Epigenetics of the male gamete[J].Fertil Steril,2012,97(2):267-274.
[16]庄广伦.现代辅助生育技术[M].3 版.北京:人民卫生出版社,2005:215-220.
