丁苯酞对大鼠脑缺血再灌注损伤神经保护作用的研究
2013-08-21臧福才唐伟白鹰
臧福才 唐伟 白鹰
细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下,自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。本文研究丁苯酞对大鼠脑缺血再灌注损伤神经保护作用,现报道如下。
1 材料与方法
1.1 实验材料 4-0尼龙单线。红四氮唑,上海圣宇化工有限公司。TUNEL试剂盒,武汉博士德公司。DAB显色试剂盒,武汉博士德公司。丁苯酞胶囊,石药集团恩必普药业有限公司生产。
1.2 实验动物 健康雄性SD(Sprague-Dawley)大鼠30只,体重280~300 g,由大连医科大学动物室提供。
1.3 实验方法
1.3.1 模型制备 依据Nagasawa方法[1],用10%水合氯醛(35mg/kg)行腹腔麻醉,常规备皮,颈部消毒,沿颈正中线切开皮肤,分离皮下及肌肉组织,充分暴露并分离右颈总动脉,结扎右侧颈总动脉和颈外动脉,同时分离颈内动脉,于颈总动脉分叉部横切一小口,将头端加热成光滑圆球的4-0尼龙单线自切口处插入,进入大脑前动脉近端,停止推送。此时,在右侧大脑中动脉起始部阻断了来自颈内动脉、大脑前动脉和大脑后动脉的所有血流。扎紧备线,留1.5 cm长线头于体表,缝合创口。再灌注于缺血2小时后进行,轻拉尼龙线,其球端退回颈总动脉分叉处。
1.3.2 给药方法 将丁苯酞溶解于食用油中,浓度5 mg/ml,于形成缺血再灌注后1 h时按1 ml/100 g剂量灌胃给药。对照组给予单纯的食用油,按1 ml/100 g灌胃,给药时间同丁苯酞组。
1.3.3 分组 将30只大鼠随机分成对照组(15只) 和丁苯酞组(15只) 。
1.4 细胞凋亡的检测 将大鼠断头,取脑,于4%多聚甲醛液中固定24 h,石蜡包埋,行连续冠状切片(片厚4 mm);将组织切片置于染色缸中,用二甲苯洗2次,每次5 min,用无水乙醇洗两次,每次3 min,用95%和75%乙醇各洗1次,每次3 min,PBS洗5 min 加入蛋白酶K溶液(20μg/ml),于室温水解15 min,去除组织蛋白,蒸馏水洗4次,2min/次,色缸中加入含2%过氧化氢的PBS,于室温反应5 min,BS洗2次,每次5 min;滤纸小心吸去载玻片上组织周围的多余液体,立即在切片上加2滴 TdT酶缓冲液,置室温1~5 min,用滤纸小心吸去切片周围的多余液体,立即在切片上滴加54 μl TdT酶反应液,置湿盒中于37 ℃反应 1 hr(注意:阴性染色对照,加不含TdT酶的反应液);切片置于染色缸中,加入已预热到37 ℃的洗涤与终止反应缓冲液,于37 ℃保温30 min,每10 min将载玻片轻轻提起和放下一次,使液体轻微搅动;组织切片用PBS洗 3次,每次 5 min后,直接在切片上滴加两滴过氧化物酶标记的抗地高辛抗体,于湿盒中室温反应30 min;PBS洗4次,每次5 min;组织切片上直接滴加新鲜配制的0.05%DAB溶液,室温显色3~6 min;蒸馏水洗4次,前3次每次1 min,最后1次5 min;室温用甲基绿进行复染10 min。用蒸馏水洗3次,前两次将载玻片提起放下10次,最后1次静置30 s。依同样方法再用100%正丁醇洗3次;二甲苯脱水3次,每次2 min,封片、干燥后,在光学显微镜下观察并记录实验结果。判断:光学显微镜下观察,细胞核中有棕黄色颗粒者为阳性(凋亡细胞) 。在大脑皮层梗死周围区,随机观察5个高倍视野(×400),计数每个视野的阳性细胞数,取平均值。
1.5 统计学处理 数据使用SPSS 12.0统计软件进行处理,计量资料以(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
丁苯酞组凋亡细胞数(20.35±4.16)个,对照组凋亡细胞数(34.90±6.10)个,丁苯酞组凋亡细胞数明显低于对照组(P<0.05)。丁苯酞组(图2)的神经元细胞凋亡数明显低于对照组(图1)。
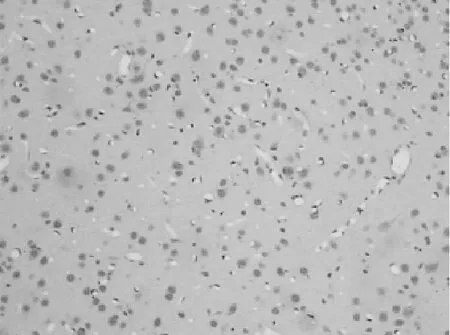
图1 对照组 TUNEL法(中倍放大)

图2 丁苯酞组 TUNEL法(中倍放大)
3 讨论
Kirino在脑缺血模型中首次观察到海马CA1区神经元细胞迟发死亡现象[2],Du又在局灶性脑缺血模型中观察到脑梗死形成迟发现象[3],此后大量的研究表明梗死区内迟发性细胞死亡是导致脑梗死形成迟发的主要原因[4]。随着细胞凋亡的发现,人们对细胞凋亡形态、基因调控、生物化学等的逐步研究,逐渐证明了此前发现的迟发性细胞死亡实质上就是细胞凋亡。在本实验中,应用TUNEL法染色,缺血再灌注组的大脑皮层区可见大量阳性细胞,表明脑缺血再灌注后有细胞凋亡存在。
细胞凋亡是缓慢的过程,时间会被延迟几天至十几天[5-6],这给治疗提供了治疗的时间窗,因此,拮抗凋亡成为缺血性脑血管病的治疗新的靶点,成为当下人们研究关注的焦点。丁苯酞软胶囊,商品名为恩必普,其化学名称为消旋-3-正丁基苯酞(简称丁苯酞或记NBP)。为石药集团恩必普药业有限公司生产,是我国拥有自主知识产的国家一类新药。研究表明丁苯酞可通过提高脑血管内皮N0和PGl2的水平。降低细胞内钙浓度,抑制谷氨酸释放.降低花生四烯酸含量,抑制氧自由基和提高抗氧化酶活性等机制作用于脑缺血所致的多个病理环节[7-11]。本实验表明丁苯酞组的神经元凋亡数明显低于对照组,说明了丁苯酞抗凋亡的活性。为丁苯酞在临床中的应用提供了新的有力依据。
[1 ]Nagasawa H, Kogure K.Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion[J].Stroke,1989,20(8):1037-1043.
[2]Kirino K. Delay neuronal death in the gerbil hippocampus following ischemia[J]. Brain Res,1982,239(1):57-69.
[3]Du C, Hu R, Csernansky C A, et al. Very delayed infarction after mild focal cerebral ischemia:a role for apoptosis[J]. J Cereb Blood Flow Metab, 1996,16(2):195-201.
[4]Charriaut-Marlangue C, Margaill I, Represa A, et al. Apoptosis and necrosis after reversible focal ischemia:an in situ DNA fragmentation analysis[J]. J Cereb Blood Flow Metab, 1996,16(2):186-194.
[5]Busto R, Dietrich W D, Globus M Y, et al. Small differences in intraischemic brain temperature critically determine the extent of ischemic neuronal injury[J]. J Cereb Blood Flow Metab, 1987,7(6):729-738.
[6]Valtysson J, Hillered L, Andine P, et al. Neuropathological endpoints in experimental stroke pharmacotherapy:the importance of both early and late evaluation[J].Acta Neurochir,1994,129(1-2):58-63.
[7]高翔,冯亦璞.丁基苯酞对大鼠局部脑缺血再灌注损伤皮层钙凋磷酸酶和钙蛋白酶活性的影响[J].药学学报,2010,35(10):790-792.
[8]种兆忠,冯亦璞.丁基苯酞对大鼠皮层神经元损伤后谷氨酸和5一羟色胺释放的影响[J].中国药学杂志,2011,34(9):591.
[9]熊杰,冯亦璞.丁基苯酞对低糖低氧引起神经细胞内钙升高的作用 [J].药学学报,2009,34(12):893-897.
[10]胡琼,刘瑞珍. 丁苯酞对大鼠局灶性脑缺血再灌注损伤后caspase-8 表达及凋亡活性的影响[J]. 中西医结合心脑血管病杂志,2010,(5):20.
[11]董莎,刘瑞珍,李晓东. 丁苯酞对大鼠局灶性脑缺血再灌注损伤后促凋亡蛋白表达的影响[J]. 中西医结合心脑血管病杂志,2010,(5):30.
