皮壳青霉原生质体制备及其形成方式研究
2013-07-23孙惜时信亚伟崔桂友
冉 昇,孙惜时,任 娇,信亚伟,崔桂友
(扬州大学旅游烹饪学院营养系,江苏扬州 225127)
随着生命科学的飞速发展,丝状真菌的原生质体技术已广泛应用于生物化学和遗传育种等诸多领域,尤其应用于原生质体制备、诱变技术进行菌种改良,为进一步研究微生物生理活性提供了有利条件。在生物催化技术日新月异的今天,丝状真菌以其在抗生素、酶制剂等多方面所具有的广泛应用价值和市场前景,正不断成为微生物催化技术所研究的新焦点,并可能成为具有产生巨大潜在食品医药价值的新颖化合物能力的微生物类群[1]。作为1株具有潜在生物催化能力的疑似菌株,研究表明皮壳青霉(Penicillium crustosum)具有独特的生物转化能力[2-3],然而关于该菌株是否存在特异性的代谢酶系的结果不得而知。原生质体的制备作为研究代谢酶系不可缺少的基础显得日益迫切,但目前暂无关于该菌株原生质体的研究报道。本文对皮壳青霉原生质体制备和其形成释放方式进行了初步研究,为通过原生质体进行菌种内部酶系的检测和分析研究、菌种诱变改良以及遗传操作等研究提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 皮壳青霉(Penicillium crustosum),本实验分离于土壤并鉴定后的保藏菌株。
1.1.2 培养基 真菌斜面保藏培养基:PDA;真菌发酵培养基:葡萄糖20 g,酵母膏5 g,蛋白胨5 g,NaCl 5 g,K2HPO45 g,蒸馏水1 000 mL,pH 6.5。
1.1.3 主要药品与试剂 溶壁酶(Lywallzyme),广东微生物制品研究所;二硫苏糖醇(DTT),阿拉丁试剂公司;PDA无水培养基,上海康源生物;蛋白胨、酵母浸出粉、葡萄糖、氯化钠、十二水合磷酸氢二钠(Na2HPO4·12H2O)、二水合磷酸二氢钠(NaH2PO4·2H2O)均为分析纯。
1.2 方法
1.2.1 溶壁酶及其配置 精确称取溶壁酶粉,添加一定体积的酶解用磷酸缓冲液[4],冰浴配制成所需浓度的原生质体酶解液。酶解液使用0.22 μm微孔滤膜过滤除菌,封口冰浴放置备用。
1.2.2 菌体材料制备 取新鲜培养4 d的斜面菌种1支,配成浓度约为4×106个/mL的孢子悬浮液。接种0.5 mL孢子悬液于装液量为50 mL新鲜真菌发酵培养液的250 mL的三角瓶中,28℃,180 r/min培养48 h,获得大小均一的菌丝球。8层纱布过滤获得菌丝球,并用无菌水洗涤3次待用。
1.2.3 原生质体制备 无菌选取大小均一,直径约为0.5 cm的菌球,沥干水分置于2 mL Eppendorf离心管中(1球1管)。离心管中加入现配原生质体酶解液500 μL,使菌球悬浮于酶解液中,封口膜封口。恒温水浴酶解,每30 min涡旋1~2 s以助酶解。
1.2.4 原生质体显微观察 取菌体原生质体酶解液,即时制片用以观察和镜下计数(25×16规格血球计数板)。
2 结果与分析
2.1 原生质体的制备
2.1.1 不同酶浓度对原生质体产量的影响 不同真菌细胞壁的结构成分存在差异,选择合适的裂解酶制备原生质体是合理实验的基础。作为一种复合型水解酶,溶壁酶具有简洁快速高效稳定等特点并且更适合青霉属真菌的原生质体制备[5-6]。实验结果如图1所示,酶解实验中原生质体的产量普遍呈现了先升高后降低的整体趋势。其中10 mg/mL的酶浓度效果较好,3 h时10 mg/mL和20 mg/mL酶浓度的作用效果大致相同,但是在酶解4 h时,10 mg/mL酶浓度作用效果出现了明显的优势,且各浓度产量均有一定增加。同时考虑到作用效果和经济因素等条件,本实验选择10 mg/mL作为最佳酶浓度用于后续实验研究。

图1 酶浓度对原生质体产量的影响Fig.1 Effect of different lywallzyme concentrations on protoplast production

图2 酶解时间对原生质体产量的影响Fig.2 Effect of different enzymolysis time on protoplast production
2.1.2 不同酶解时间对原生质体产量的影响酶解时间是影响原生质体的重要因素,较短的酶解时间能使原生质体保持较高的活性,但不能保证其充分释放[7];但时间过长将极大影响原生质体的整体活性和稳定性,甚至导致其膜结构出现损伤破裂。如图2所示,5个浓度梯度酶解作用下的原生质体产量总体都呈现了随着酶解作用时间的延长而逐渐增加的趋势。适宜的酶解时间有利于在保证较高水平原生质体释放量的情况下进一步保证其活性质量,研究表明酶解时间过长(大于4 h)会使青霉属菌原生质体的膜结构受到损伤,且影响原生质体的整体质量[4],同时在本实验的连续取样观察中发现,在酶解作用5 h时菌丝几乎全部瓦解,原有释放的原生质体可能会因酶解作用导致膜结构破损,从而导致原生质体质量下降。因此综合选择4 h作为最适酶解时间。
2.1.3 不同酶解温度对原生质体产量的影响溶壁酶具有一定的酶解温度使用参数(高于26℃,低于35℃),实验选用26、28、30、32和34℃5个梯度进行制备考察。
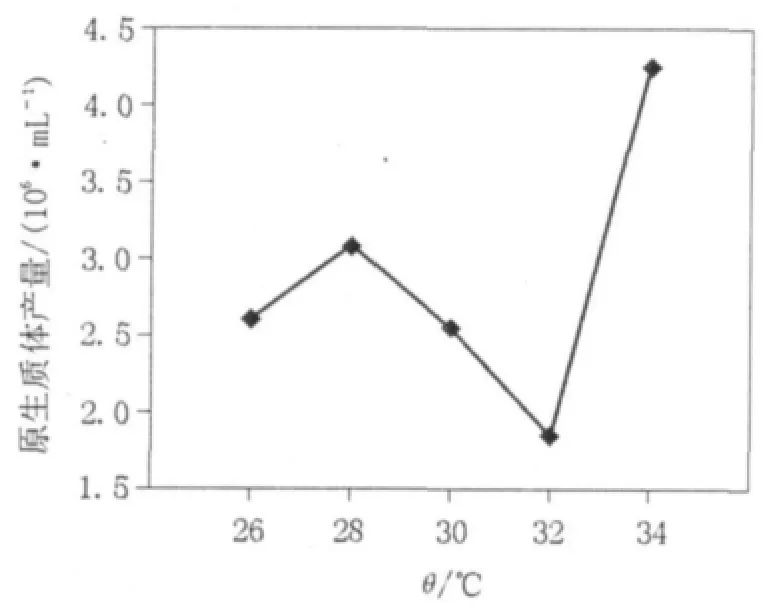
图3 不同酶解温度对原生质体产量的影响Fig.3 Effect of different enzymolysis temperatures on protoplast production
如图3所示,26~32℃的温度范围内,28℃的原生质体产量较高,产量呈现先升高后降低的变化趋势,但34℃时原生质体产量较28℃时显著提高。实验发现虽然26~32℃的温度范围内,原生质体的产量变化不规律,但是从酶解温度对原生质体产量增长速率的影响角度出发,可以发现是存在一定规律的(见图4),即在26~34℃的温度范围内,温度越高越有利于菌体产生原生质体,温度越高原生质体释放达到最大产量的时间越短,该实验结果与扩展青霉K40的原生质体制备结果吻合[8]。但是综合原生质体制备的其他情况,选取34℃作为最佳酶解作用温度,此时溶壁酶能够更好地发挥酶解作用。
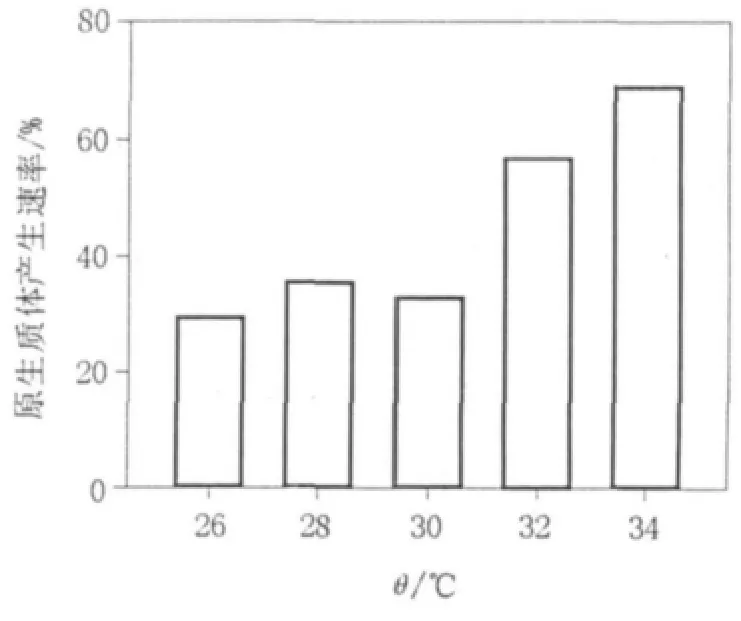
图4 各酶解温度对原生质体形成速率的影响Fig.4 Effection rate of different enzymolysis temperatures on protoplast production
2.1.4 不同前处理对原生质体产量的影响 原生质体制备的预处理方法主要集中于化学法而非物理法。许多研究表明,在酶解前或酶解过程中加入一些化学试剂(如巯基乙醇和二硫苏糖醇[5,9-11]),存在增加菌体原生质体释放的有利效果[12]。刘志成等[13]在对扩展青霉原生质体的制备研究时,对在菌体酶解前和酶解中添加化学试剂2种处理方法进行了比较,结果显示化学处理剂预先处理菌体再用于酶解效果更优。然而在化学预处理剂的选择上,巯基乙醇并不适合作为化学预处理剂[14-15],DTT较巯基乙醇更有利于青霉属菌株原生质体的释放[8]。综合比较菌体预处理物理法和化学法时,选用超声法和二硫苏糖醇(DTT)浸渍法作为代表,研究不同前处理方法对原生质体产量的影响。如表1所示,冰浴放置24 h的前处理方式并没有让原生质体产量出现明显增长,在一定程度上降低了实验效率,故不建议使用。
进一步比较DTT浸渍法和超声法在时间上对原生质体产量的连续影响。如图5,实验结果表明,1~4 h的酶解时间范围内,2种预处理组的原生质体产量都呈现上升趋势,且各时间点超声预处理法的原生质体产量都较DTT浸渍法高,但DTT处理组的原生质体产生速率均高于超声处理组,并在3~4 h的时间区间菌体原生质体的释放量急剧增加,这可能与硫醇化合物DTT可使细胞壁中蛋白质成分的二硫键还原导致细胞壁更疏松有关[16],加之酶解作用时间的不适可能造成了菌体损伤而导致4 h时的原生质体大量释放。微生物菌株的不同所导致的菌体膜结构差异,可能是物理法更适合本实验菌体制备原生质体的原因。

表1 不同预处理方法对原生质体产量的影响Table1 Comparison of different pre-treatment methods on protoplasts production

图5 超声前处理与DTT浸渍对原生质体产量影响的对比Fig.5 Comparison of protoplast production with ultrasonication and DTT pre-treatment
2.2 原生质体形态和形成释放方式的显微观察
2.2.1 原生质体形态显微观察 原生质体的形态观察结果:菌体在溶壁酶(10 mg/mL)的作用下,34℃温浴1~2 h开始缓慢释放原生质体,在3~4 h时原生质体释放量不断增加。在原生质体释放初期,菌丝顶端膨大,其间伴随着菌丝的断裂。菌丝顶端首先释放原生质体(顶端释放),随着酶解时间的延长,菌丝顶端释放逐渐完成,大多数菌丝酶解成为菌丝片段进一步开始释放原生质体(侧位释放、原位释放和顶端释放),原生质体进入释放中期,此时显微镜视野下出现大量未酶解的菌丝体片段,原生质体出现大量释放。在原生质体释放末期(5 h时),菌丝几乎全部瓦解,原有释放的原生质体因酶解作用导致膜结构破损,原生质体质量下降。在原生质体释放过程中,起初释放的较小的原生质体在温浴的过程中会逐渐增大,在显微镜下出现了大小不一的原生质体,该现象存在于真菌原生质体的相关研究中[8,17]。
2.2.2 原生质体形成和释放方式显微观察 目前丝状真菌原生质体的形成和释放方式有4种形式[18]:①顶端释放;②段端位释放;③侧位释放;④原位释放。丝状真菌因种属分类不同所呈现的原生质体形成和释放方式不同,一般仅含有少于4种的释放方式。如图6所示,本实验所采用的供试菌株皮壳青霉存在以上4种原生质体形成和释放方式,原生质体形成方式全面,且显微观察发现该菌株还出现了类似酵母“出芽”的释放方式(如图7),据报道该释放形式是酵母原生质体特有的释放方式[19],但是出现在酶解过程中的原生质体“出芽”形成释放方式还是首次报道。

图6 显微观察的菌体原生质体组图及其释放方式(400×)Fig.6 Images of protoplast formation and releasing way with microscopy(400×)

图7 显微观察的菌体原生质体类似酵母“出芽”的释放方式(400×)Fig.7 Images of protoplast formation in a new releasing way with microscopy(400×)
3 讨论
由于丝状真菌的细胞壁组成较为复杂且不同真菌的细胞壁组成也存在差异,因此原生质体的制备和形成释放方式也有所区别。本研究采用超声法预处理,在合适的酶解条件下,皮壳青霉的原生质体形成量达到4.71×106个/mL。同时观察发现该菌株原生质体的形成释放方式包括顶端释放、侧位释放、菌丝段端位释放和原位释放以外的另一种全新的类似酵母“出芽”的释放形式。
[1]谢春锋,娄红祥.天然产物的生物转化[J].天然产物研究与开发,2005,17(5):658-664.
[2]Borges KB,Bonato PS,Pupo MT.Enantioselective biotransformation of propranolol to the active metabolite 4-Hydroxypropranolol by endophytic fungi[J].Quimica Nova,2011,34(8):1354-1357.
[3]Carrao DB,Borges KB,Barth T,et al.Capillary electrophoresis and hollow fiber liquid-phase microextraction for the enantioselective determination of albendazole sulfoxide after biotransformation of albendazole by an endophytic fungus[J].Electrophoresis,2011,32(19):2746-2756.
[4]宋爱环,李红叶,刘小红.指状青霉原生质体制备和再生条件[J].农业生物技术学报,2004,12(2):197-201.
[5]戴美学,奚新伟.灰绿拟青霉U-2原生质体形成和再生条件研究[J].生物技术,1997,7(4):34-37.
[6]张永军,刘爱英,梁宗琦.蝉拟青霉原生质体形成与再生[J].贵州农业科学,1998,26(5):1-4.
[7]刘限,高增贵,庄敬华,等.木霉菌原生质体的制备和再生研究[J].沈阳农业大学学报,2005,36(1):37-40.
[8]黄文树,施巧琴,吴松刚.碱性脂肪酶产生菌—扩展青霉K40原生质体的制备和再生[J].福建师范大学学报,2000,16(3):77-82.
[9]卢文玉,郭亚文,龚未,等.提高新月弯孢霉原生质体再生率的研究[J].药物生物技术,2003,10(3):141-143.
[10]王建华,赵学慧.去壁酶与酶解方式对曲霉原生质体释放的影响[J].微生物学杂志,2004,24(6):15-17.
[11]顾克东.脂肪酶产生菌的筛选及其原生质体的制备[J].甘肃科学学报,2003,15(4):40-43.
[12]杨亚勇,李长洪,孟文伟.麦考酚酸产生菌原生质体诱变育种的研究[J].中国抗生素杂志,2006,30(10):587-590.
[13]刘志成,张淑芝,鲁迎新,等.扩展青霉原生质体的形成、再生及其影响因素[J].微生物学杂志,1989,9(2):52-57.
[14]峥嵘,张功.绿色木霉原生质体的制备与再生研究[J].内蒙古师范大学学报(自然科学汉文版),2002,31(2):145-149.
[15]周东坡,孙剑秋,于寒颖,等.抗癌药物紫杉醇产生菌原生质体形成及释放规律[J].高师理科学刊,2001,(21)2:44-46.
[16]Jerzy Dlugonski.Cotexolone 11β-hydroxylation in protoplasts ofCurvularia lunata[J].Journal of Biotechnology,1998,65:217-224.
[17]黄玉茜,梁春浩,陈捷.绿色木霉菌T23原生质体的制备和再生[J].吉林农业大学学报,2007,29(1):24-47.
[18]张志光.真菌原生质体技术[M].北京:湖南科学技术出版社,2003:75-146.
[19]袁志明,马宗孚.酵母原生质体形成中的电镜观察[J].云南大学学报(自然科学版),1991,13(2):140-145.