旋毛形线虫预感染对夏氏疟原虫感染BALB/c小鼠Th细胞变化的影响
2013-07-23曹雅明王继春
杨 洋,刘 军,赵 娜,季 楠,曹雅明,王继春*
(1.中国医科大学基础医学院病原生物学教研室,辽宁沈阳 110001;2.中国医科大学基础医学院免疫学教研室,辽宁沈阳 110001)
蠕虫分布广泛,种类繁多,发育周期复杂多样,通过侵入不同的器官系统,经过复杂的移行途径最终进入宿主的寄生部位。人体的绝大多数器官甚至组织都是蠕虫潜在的感染目标。据世界卫生组织估计,全世界有1亿以上的人患有长期的蠕虫感染。在热带和亚热带地区,蠕虫感染属于最常见的慢性感染性疾病,而疟疾作为危害人类最严重、致死率最高的寄生原虫性疾病,其地理分布与蠕虫感染疾病相似,因此混合感染十分常见[1-2]。2009年Hoeve MA等[3]在研究同时感染巴西日圆线虫(Nippostrongylus brasiliensis)和夏氏疟原虫(Plasmodiun chabaudi)的BALB/c小鼠模型时,发现混合感染使小鼠抵御疟原虫攻击感染的能力增强。虽然疟疾和蠕虫病各自具有独特的传播手段,但不同的环境和宿主因素都会影响感染和疾病的发生。因此,蠕虫感染对疟原虫感染的发生、发展乃至转归的影响仍是具有意义的研究课题。旋毛形线虫是一种具有独特发育周期的生物源性蠕虫,其成虫寄生在宿主小肠,而作为主要致病阶段的幼虫则寄生在同一宿主的横纹肌细胞内。因此,该虫种兼具肠道寄生线虫和组织寄生线虫的特征。然而,关于旋毛形线虫感染对疟疾感染进程和结局的影响及其相关机制尚不明确。因此,探讨旋毛形线虫与疟原虫之间的相互作用特点,特别是对疟疾免疫应答的影响及其相关机制,无疑可进一步充实对疟疾免疫的认识,并将为揭示疟疾流行区病原体相互作用的相关机制提供新的理论依据。本研究用旋毛形线虫小鼠模型再感染疟原虫,观察混合感染后小鼠抵御疟原虫攻击感染的能力,以期揭示旋毛形线虫与疟原虫共同感染的相关免疫学机制。
1 材料与方法
1.1 材料
1.1.1 实验动物、疟原虫 6~8周龄 BALB/c雄性小鼠购自中国医科大学实验动物中心;夏氏疟原虫(P.c chabaudiAS)由中国医科大学免疫学教研室馈赠;旋毛形线虫由大连医科大学寄生虫学教研室馈赠。
1.1.2 主要试剂 Trizol,逆转录试剂盒及荧光定量PCR试剂盒购自宝生物工程(大连)公司。
1.1.3 主要仪器 PCR仪,TaKaRa公司,日本;荧光定量PCR仪,AB公司,英国。
1.2 方法
1.2.1 实验动物混合感染模型制备 24只小鼠随机分为3组,每组8只,每只小鼠经口感染300只旋毛形肌幼虫,并分别于感染后的1 w(TPC1)、3 w(TPC3)经腹腔感染1×106夏氏疟原虫寄生的红细胞,构建混合感染模型。对照组(PC)在同一时间点单纯感染夏氏疟原虫。
1.2.2 原虫血症检测及体重观察 混合感染模型制备成功后,每天随机取3只小鼠,经尾静脉采血,制备薄血膜,Giemsa染色,显微镜检计数红细胞感染率并记录小鼠体重变化。
1.2.3 RNA提取及cDNA合成 检测出原虫血症当天无菌取小鼠脾脏,取50~100 mg组织加入1 mL Trizol试剂,用氯仿法提取脾脏RNA,用紫外分光光度计测定RNA的含量,剩余脾脏置-70℃保存。用Takara逆转录试剂盒进行反转录,反转录为cDNA后,置-20℃保存。
1.2.4 引物设计 在 GenBank中查找 Gata-3(Th2转录因子),T-bet(Th1转录因子)以及GAPDH基因(管家基因)序列,通过Primer 5.0在线软件设计实时定量PCR引物(见表1),引物由华大基因公司合成。

表1 Gata-3,T-bet以及GAPDH引物序列Table1 Sequences of Gata-3,T-bet and GAPDH primers
1.2.5 荧光定量PCR检测T-bet及Gata-3 mRNA表达水平 利用SYBR GreenⅡ染料进行各基因的实时荧光定量PCR检测,反应体系(共20 μL):SYBR Premix 10 μL,RoxⅡ 0.4 μL,上、下游引物各1.6 μL,模板2.0 μL,ddH2O 4.4 μL。反应条件:95℃ 30 s,95℃ 5 s,60℃ 34 s,共40个循环。为消除样本处理、反转录反应差异,每个样品GAPDH、Gata-3及T-bet基因同时检测3次,取平均值。
1.2.6 统计学分析 运用SPSS 17.0统计软件对实验数据进行处理,采用t检验。P<0.05表示差异有统计学意义。
2 结果与分析
2.1 混合感染模型的鉴定
旋毛虫肌幼虫感染后8 w将小鼠引颈处死,取一小块膈肌压片镜检观察,证实小鼠均成功感染旋毛虫(图1)。
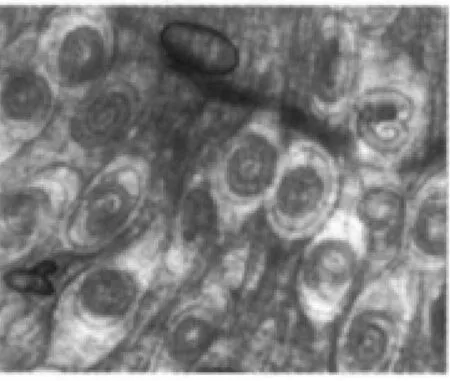
图1 膈肌压片(40×)Fig.1 Diaphragmatic tablet(40×)
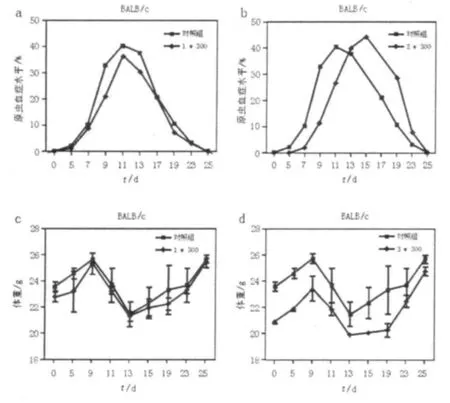
图2 小鼠感染后不同时间原虫血症水平及体重变化Fig.2 The parasitemia and weight of mice at different time points after infection
2.2 原虫血症检测及体重观察
旋毛虫预感染1 w实验组与对照组相比,感染后第5天,小鼠的外周血中出现疟原虫感染的红细胞,原虫血症水平至感染后11天达到峰值后迅速下降,对照组峰值为40.2%,预感染1 w实验组为36.4%(峰值降低)。预感染3 w实验组于感染后第7天检测出原虫血症,原虫血症出现时间推迟,至感染后15天达到峰值44.5%(峰值升高),实验组与对照组皆于感染后25天左右自愈(图2a、2b)。实验组与对照组相比体重均下降(图2c、2d)。
2.3 T-bet及Gata-3 mRNA表达水平
旋毛虫预感染1 w实验组T-bet相对表达量为1.94±0.16,Gata-3相对表达量为0.49±0.13;旋毛虫预感染3 w实验组T-bet相对表达量为0.35±0.11,Gata-3相对表达量为2.45±0.26。与对照组相比,旋毛虫预感染1 w实验组T-bet表达水平升高,Gata-3表达水平降低;旋毛虫预感染3 w实验组Gata-3表达水平升高,T-bet表达水平降低,差异有统计学意义(P<0.05)(图3a,3b)。
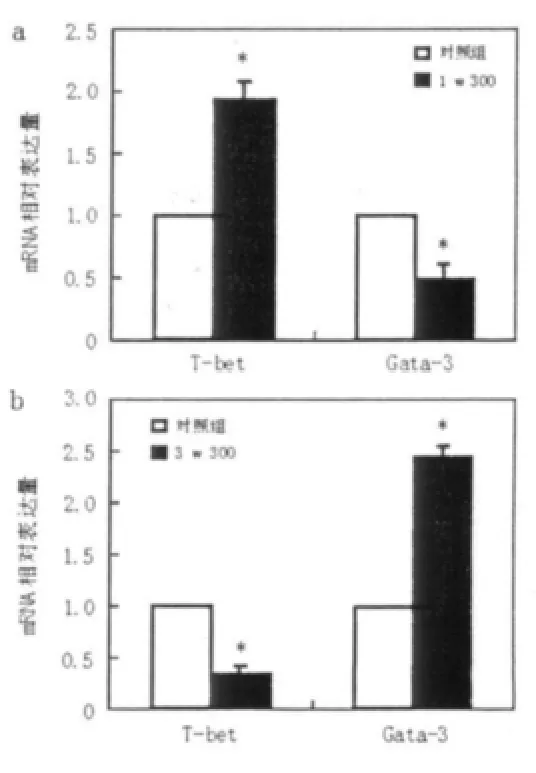
图3 T-bet及Gata-3的表达水平Fig.3 The expression of T-bet and Gata-3
3 讨论
疟疾是一类高发病率、高死亡率的疾病,疟原虫与蠕虫的混合感染可以引起对立或协调的相互作用而使疾病难以控制。近年来,探讨疟疾流行区不同病原体之间的相互作用特点,特别是其他病原体对疟疾免疫应答的影响及其相关机制备受关注。在夏氏疟原虫感染鼠疟模型中,红内期疟原虫的免疫应答为最初的适应性免疫应答,要求Th1细胞活化效应细胞(如巨噬细胞),遏制疟原虫的爆发性增殖,随后进一步转化为Th2细胞因子和抗体的产生,以彻底清除寄生虫,防止复发和再燃[4-6]。Th1细胞应答的适当建立和随后Th2细胞因子辅助B细胞产生抗体对控制和清除原虫血症至关重要,明显影响着感染进程和感染结局[7]。免疫系统中Th1/Th2的分化路径主要是由其上游的转录因子调控。近年来研究发现分别表达于Th1和Th2细胞特异性的转录因子T-bet和Gata-3基因具有重要的调节功能,最终决定Th0向Th1/Th2的分化[8]。而Th1和Th2的活性程度可以间接反应两种免疫系统参与免疫反应与调控的状态。本实验通过选择性观察主要转录因子T-bet及Gata-3 mRNA在检测出原虫血症当天的变化,发现预感染旋毛形线虫1 w时诱导以Th1激活为主的免疫状态,而预感染旋毛形线虫3 w时诱导以Th2激活为主的免疫状态。
新生幼虫是旋毛形线虫整个生活史中唯一由肠黏膜进入血液、淋巴液中移行而不寄生于宿主细胞内的发育阶段,新生幼虫抗原具有较好的免疫原性,能刺激机体发生强烈的免疫应答,诱导机体产生有效的体液免疫和细胞免疫,是宿主免疫针对的主要靶期[9]。而细胞免疫是宿主自然感染旋毛形线虫后破坏新生幼虫的主要抵制机制之一[10]。旋毛形线虫对疟原虫混合感染的影响及其相关机制鲜有研究,仅Ngwenya发现旋毛形线虫预感染可增强宿主对致死型柏氏疟原虫(P.bergheiNYU-2)的抗感染能力。研究发现旋毛形线虫预感染1w时CD8+T细胞增多,活化的CD8+T细胞主要具有杀伤活性。单核巨噬细胞系统激活,中性粒细胞、巨噬细胞、肥大细胞与嗜酸性粒细胞共同参与杀伤作用。抑制血红蛋白的产生,导致宿主贫血,原虫血症水平降低。旋毛形线虫预感染3 w时,旋毛形线虫为幼虫移形期,穿破各脏器毛细血管,此时贫血症状最严重。本实验以非致死型夏氏疟原虫为研究对象,根据以往的研究结论及本实验发现旋毛形线虫预感染1 w时,诱导宿主以Th1激活为主的免疫状态,单核巨噬细胞系统激活,抑制血红蛋白的合成,原虫血症峰值降低。预感染旋毛形线虫3 w时,诱导宿主以Th2激活为主的免疫状态,此时宿主贫血症状最严重,原虫血症出现时间推迟,原虫血症峰值升高,但是混合感染并不影响宿主最终清除疟原虫的能力,可能与Treg免疫反应的调节机制相关。一般来说,疟疾和土源性蠕虫病会造成宿主的体重降低的状况,这种现象在同时感染疟原虫和土源性蠕虫时表现突出。与对照组相比,预感染旋毛形线虫1 w、3 w的实验组体重均下降。
本研究首次表明在夏氏疟原虫感染早期,预感染旋毛形线虫1 w、3 w的小鼠对疟原虫的抗感染能力增强,研究结果证明Th细胞在疟疾感染早期免疫调控中的重要作用。本实验进一步充实对疟疾免疫的认识,为人类对抗疟原虫感染提供了新的研究思路。
[1]De Silva NR,Brooker S,Hotez PJ,et al.Soil-transmitted helminth infections:updating the global picture[J].Trends parasitol,2003,19(12):547-551.
[2]Petney TN,Andrews RH.Multiparasites communities in animals and humans:frequency,structure and pathogenic significance[J].Int J Parasitol,1998,28(3):377-393.
[3]Hoeve MA,Mylonas KJ,Fairlie-Clarke KJ,et al.Plasmodium chabaudilimits earlyNippostrongylus brasiliensis-induced pulmonary immune activation and Th2 polarization in co-infected mice[J].BMC Immunology,2009,10:60.
[4]Yazdani SS,Mukherjee P,Chauhan VS,et al.Immune responses to asexual blood-stages of malaria parasites[J].Curr Mol Med,2006,6(2):187-203.
[5]Seixas E,Ostler D.Plasmodium chabaudi chabaudi(AS):differential cellular responses to infection in resistant and susceptible mice[J].Exp Parasitol,2005,110(4):394-405.
[6]Couper KN,Phillips RS,Brombacher F,et al.Parasite-specific IgM plays a significant role in the protective immune response to asexual erythrocytic stagePlasmodium chabaudiAS infection[J].Parasite Immunol,2005,27(5):171-180.
[7]Voisine C,Mastelic B,Sponaas AM,et al.Classical CD11c+dendritic cells,not plasmacytoid dendritic cells,induce T cell responses toPlasmodium chabaudimalaria[J].Int J Parasitol,2010,40(6):711-719.
[8]USUI T,PREISS J C,KANNO Y,et al.T-bet regulates Th1 responses through essential effects on GATA-3 function rather than on IFNG gene acetylation and transcription[J].J Immunol,2007,178(5):2730-2736.
[9]赵雪,申丽洁.旋毛虫新生幼虫抗原保护性免疫的研究进展[J].中国病原生物学杂志,2007,2(4):115-118.
[10]原丽红,付宝权,刘明远,等.旋毛虫编码新生幼虫p46kDa抗原基因重组融合蛋白对小鼠的免疫保护性研究[J].中国人兽共患病杂志,2005,21(3):221-224.