聚乙二醇硬脂酸酯15对黄芩苷角膜透过性研究*
2013-07-14赵海南瞿继兰刘志东
张 锐,赵海南,瞿继兰,李 琳,李 楠,刘志东
在临床上,黄芩苷对眼科疾病如角膜炎、结膜炎的治疗作用已经得到广泛肯定,对眼科常见的病原菌也均有很强的抑菌杀菌作用。目前国内已经上市的黄芩苷眼用制剂主要为滴眼液,但是由于黄芩苷的理化性质以及滴眼液本身存在的剂型缺点,黄芩苷滴入眼部后会大量流失,从而造成药效的维持时间较短,生物利用度较低。另外,角膜是呈弧形的透明生物膜,对外源性异物具有屏障作用,由于其上皮渗透性较差,成为影响眼用制剂吸收的主要因素。所以,改善角膜透过性,增加药物的跨膜吸收,提高药物的生物利用度成为眼用制剂面临的主要问题。目前解决的方法主要是应用渗透促进剂,如聚乙二醇硬脂酸酯 15(SolutolHS 15,Sol),一种聚乙二醇-12-羟基硬脂酸酯,低毒非离子表面活性剂,已经被应用于经皮和口服给药系统。
本文的模型药物为黄芩苷,考察了渗透促进剂Sol对黄芩苷角膜透过率的影响,并探讨了其作用机制,从而明确Sol作为一种新型的渗透促进剂在眼部给药系统的应用前景。
1 仪器和试剂
改良Franz扩散池﹙上海锴凯科技贸易有限公司),TK-20A型透皮扩散试验仪﹙上海锴凯科技贸易有限公司﹚,AX205电子天平(MettleToledo,瑞士),Milli-Q超纯水系统(Millipore,美国),SPD-10Avp岛津高效液相色谱仪(HPLC)(Shimadzu,日本),AT-130柱温箱(大连中汇达科学仪器有限公司)。黄芩苷原料药(天津中新药业,含量>90%),黄芩苷对照品(中国药品生物制品检定所),聚乙二醇硬脂酸酯15(北京凤礼精求商贸有限公司),其他试剂均为分析纯。
白色家兔,雌雄兼用,体质量2.0~2.5 kg,由北京沙河通利实验动物养殖场提供,合格证号:SLXK京2010-0004。
2 实验方法与结果
2.1 实验装置 本实验采用改良的Franz立式扩散池,它由两个内径大小相同的供给池和接受池组成,供给池的容积为0.5mL,接受池的容积为4.5mL,内半径为0.4 cm,有效的扩散面积为0.50 cm2。
2.2 样品溶液的配制
2.2.1 空白溶液的配制 精密称取黄芩苷0.1g,充分溶解于100 mL的新鲜pH 6.5磷酸盐缓冲溶液(PBS)中,得黄芩苷pH 6.5 PBS溶液,作为空白对照溶液。
2.2.2 0.2%~2.0%Sol溶液的配制 分别称取适量Sol加入新配制的10 mL空白对照溶液中,得到所需的不同浓度的Sol黄芩苷pH 6.5 PBS溶液。
2.3 离体角膜透过实验 将家兔耳缘静脉注射空气致死,在致死后的20 min内,用眼科手术剪和镊子小心分离出角膜,并除去虹膜、巩膜、睫状体等多余的眼部组织,然后将离体的新鲜角膜小心的放在已放入搅拌子的接受池和供给池的中间,确定角膜的上皮层面向供给池之后,固定角膜,最后在接受池中加入4.5 mL新鲜配制的pH 6.5 PBS溶液,在供给池中加入0.5 mL不同药物浓度的Sol溶液,并将供给池用保鲜膜密封。
装置置于透皮扩散实验仪中,温度控制在37℃。实验开始之后,分别于 40、80、120、160、200、240 min从接受池中将溶液全部取出,同时分别补充同温等体积的pH 6.5 PBS溶液4.5 mL,样品经0.45 μm微孔滤膜过滤后,取样20 μL,作HPLC分析。
2.4 数据处理 单位面积累积透过量Q计算公式如下:
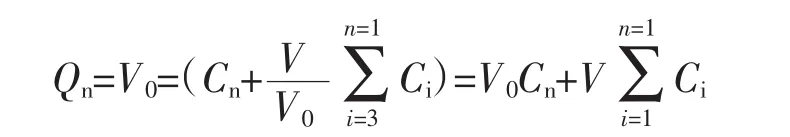
其中:Cn为t时间药物的测定浓度;Ci为t时间前的测定浓度;V0为接受池中溶液体积;V为取样体积。
表观渗透系数(Papp,cm/s)计算公式如下:
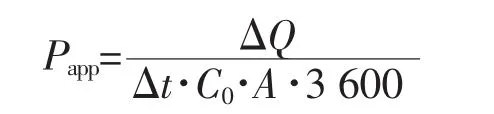
其中:C0为供给池初始药物浓度;A为有效透过面积;ΔQ/Δt可由累积透过量—时间曲线稳态部分的斜率求得。
表观渗透系数及稳态流量均以单因素方差分析进行统计学分析。
稳态流量Jss计算公式如下:

2.5 角膜水化值的测定 角膜水化值是体外评价物质对角膜组织刺激性的重要指标,本实验以水化值考察促渗剂Sol对兔眼角膜的损伤。角膜水化值(H)计算公式如下:
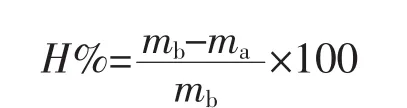
其中,mb为体外实验后暴露于扩散介质的角膜区域的角膜质量;ma为60℃干燥16 h后再次称质量的角膜质量。
2.6 样品测定
2.6.1 色谱条件 参照文献[1-2],黄芩苷色谱条件为色谱柱:Diamond DIKMAODS-C18;流动相:甲醇∶水∶磷酸(60∶40∶0.05);流速:1.0 mL/min;检测波长:280 nm;进样量:20 μL;柱温:35 ℃。
2.6.2 专属性考察 分别取空白角膜溶出物及含药角膜溶出物的pH 6.5 PBS各20μL,作高效液相色谱(HPLC)分析,记录色谱图。如图1、图2所示,空白角膜溶出物不干扰药物的HPLC测定。

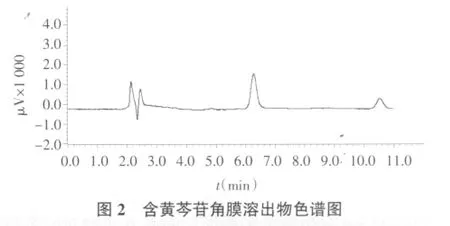
2.6.3 标准曲线的制备 精密配制浓度为0.021 1~0.7385μg/mL的黄芩苷pH6.5PBS溶液,进样20μL,记录峰面积。直线回归方程:A=562 52×C-459.01,r2=0.999 9,线性范围为 0.021 1~0.738 5 μg/mL,如图 3所示,样品质量浓度与峰面积的线性关系良好。在此范围内配制高、中、低3个质量浓度的黄芩苷pH 6.5 PBS 溶液 0.105 5、0.316 5、0.422 μg/mL,测得日内精密度RSD分别为0.32%、0.12%、0.21%,日间精密度RSD分别为0.55%、0.15%、0.19%,说明仪器精密度良好。
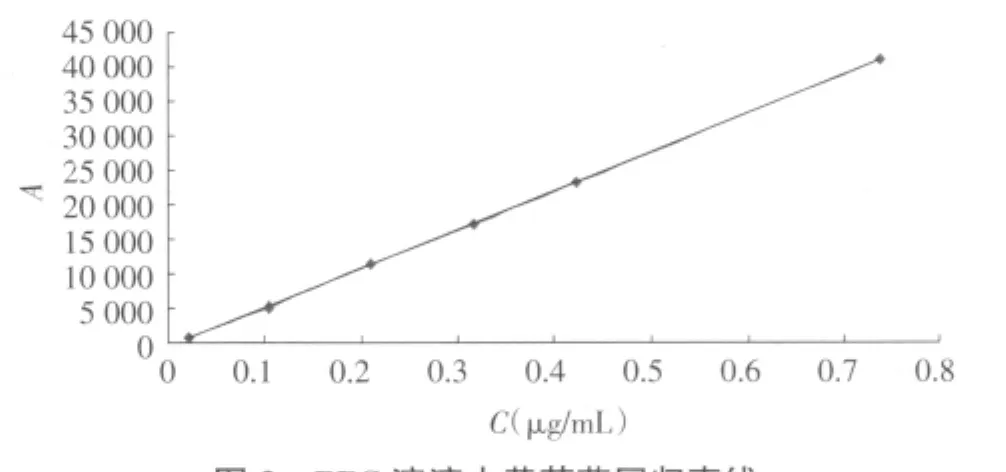
图3 PBS溶液中黄芩苷回归直线
2.7 结果 本实验以黄芩苷pH 6.5 PBS溶液为对照,分别考察了0.2%、0.4%、0.8%、1.0%和2.0%的Sol为促渗剂时黄芩苷的角膜透过性。黄芩苷离体角膜透过参数见表1、表2,角膜透过曲线图见图4,Sol对角膜水化值的影响见表3。
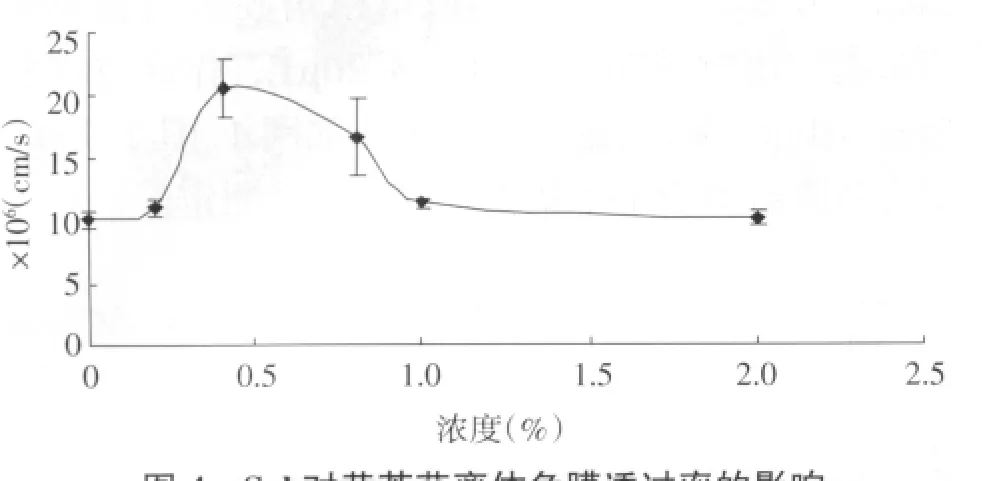
图4 Sol对黄芩苷离体角膜透过率的影响
如图4所示,黄芩苷的表观渗透系数随着Sol浓度的升高而逐渐升高,而达到最大值之后,又随着Sol浓度的继续升高而逐渐减小。Sol的浓度为0.4%、0.8%时,黄芩苷的表观渗透系数分别增加了2.05倍、1.65倍,与对照组相比差异均有统计学意义(P<0.05)。
正常的角膜水化值为76%~80%,超过83%即可判定角膜受到一定程度的损伤[3]。据文献报道[4],Sol具有较高的生理耐受性,体积分数低于10%对兔眼角膜没有刺激性。另刘睿等[5]实验过程中0.1%~1.0%的Sol对角膜无刺激性,因此本实验对此范围的体积分数进行了主要考察。由表3可知,本实验中含不同浓度Sol的黄芩苷溶液对角膜水化值没有显著影响,表明实验过程中角膜上皮细胞和内皮细胞没有被损伤。
3 讨论
本实验选用pH 6.5 PBS溶液做为扩散介质,主要因为黄芩苷为弱酸性化合物,因此其在碱性溶液中降解迅速,在偏酸性的溶液中稳定性相对较好。GBR液是一种生理溶液,其能保存离体角膜达6 h,因此在体外角膜透过实验中多采用此溶液,但因GBR液呈碱性,黄芩苷在此溶液中极不稳定,因而最终舍弃。最终选择与生理环境相近且稳定性较好的pH 6.5 PBS溶液作为体外角膜透过的接收液。
刘睿等[5]实验结果阐述了Sol增加角膜透过量的可能机制,由于Sol在角膜上皮细胞的磷脂双层中形成胶束,然后将细胞中的磷脂消除,从而达到增加药物角膜透过量的作用。另有研究表明[6-10],Sol促进药物在黏膜的吸收作用机制是使细胞膜上的磷脂双分子层运动更加有序,增加了膜的通透性,从而利于药物的吸收。本实验结果发现,Sol显著增加了药物的角膜透过,并且具有浓度依赖性,0.4%和0.8%的Sol使黄芩苷的表观渗透系数分别增加了2.05倍和1.65倍,与对照组相比差异均有统计学意义(P<0.05),且对角膜无刺激性。表明一定浓度的Sol可显著提高黄芩苷的角膜透过率,且对角膜无刺激性,因此Sol作为一种新型的渗透促进剂在眼部给药系统中可被广泛应用。
表1 不同浓度Sol对黄芩苷离体角膜累积透过量的影响(±s,n=3)
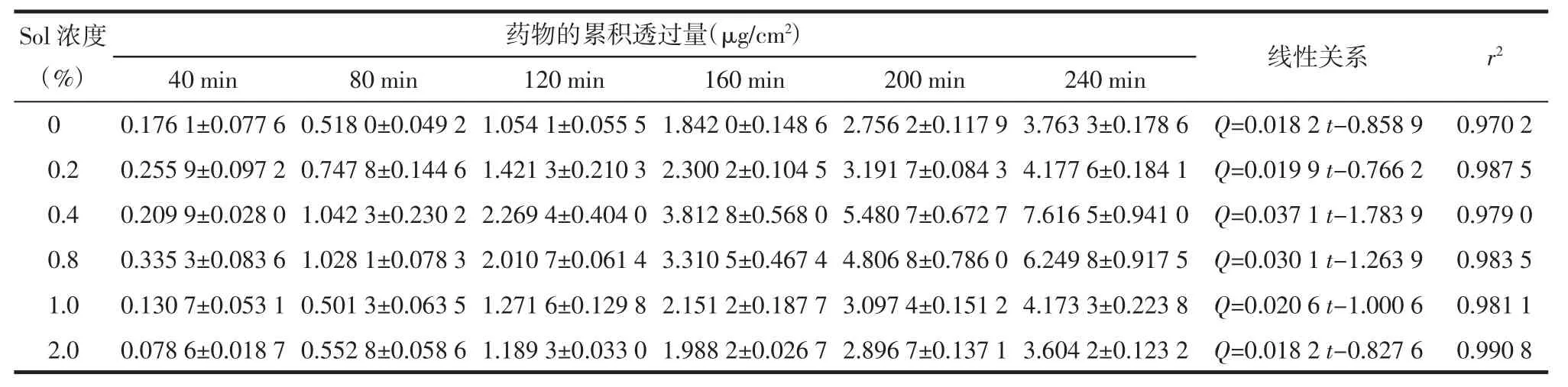
表1 不同浓度Sol对黄芩苷离体角膜累积透过量的影响(±s,n=3)
Sol浓度(%)线性关系 r2 40 min 80 min 120 min 160 min 200 min 240 min药物的累积透过量(μg/cm2)0.0 0.176 1±0.077 6 0.518 0±0.049 2 1.054 1±0.055 5 1.842 0±0.148 6 2.756 2±0.117 9 3.763 3±0.178 6 Q=0.018 2 t-0.858 9 0.970 2 0.2 0.255 9±0.097 2 0.747 8±0.144 6 1.421 3±0.210 3 2.300 2±0.104 5 3.191 7±0.084 3 4.177 6±0.184 1 Q=0.019 9 t-0.766 2 0.987 5 0.4 0.209 9±0.028 0 1.042 3±0.230 2 2.269 4±0.404 0 3.812 8±0.568 0 5.480 7±0.672 7 7.616 5±0.941 0 Q=0.037 1 t-1.783 9 0.979 0 0.8 0.335 3±0.083 6 1.028 1±0.078 3 2.010 7±0.061 4 3.310 5±0.467 4 4.806 8±0.786 0 6.249 8±0.917 5 Q=0.030 1 t-1.263 9 0.983 5 1.0 0.130 7±0.053 1 0.501 3±0.063 5 1.271 6±0.129 8 2.151 2±0.187 7 3.097 4±0.151 2 4.173 3±0.223 8 Q=0.020 6 t-1.000 6 0.981 1 2.0 0.078 6±0.018 7 0.552 8±0.058 6 1.189 3±0.033 0 1.988 2±0.026 7 2.896 7±0.137 1 3.604 2±0.123 2 Q=0.018 2 t-0.827 6 0.990 8
表2 不同浓度Sol对黄芩苷离体角膜透过参数的影响(±s,n=3)%

表2 不同浓度Sol对黄芩苷离体角膜透过参数的影响(±s,n=3)%
注:与对照组比较,*P<0.05,**P<0.01。
测定项目 0 0.2 0.4 0.8 1.0 2.0 Papp×106(cm/s)10.03±0.7511.03±0.6720.57±2.42**16.60±3.08*11.37±0.4310.08±0.55 Jss×103[μg(s/cm2)]10.15±0.76 11.08±0.76 20.82±2.44** 16.80±3.11* 11.42±0.34 10.13±0.63
表3 Sol对角膜水化值的影响(±s,n=3)%

表3 Sol对角膜水化值的影响(±s,n=3)%
测定项目 0 0.2 0.4 0.8 1.0 2.0角膜水化值 77.77±1.65 76.06±0.34 82.62±0.84 78.23±2.76 79.29±1.94 81.70±1.32
[1]崔 佳,鲁燕侠,仝青英.感咳清颗粒中黄芩苷的含量测定[J].中国中药杂志,2003,28(5):462-463.
[2]张欣华,刘志东,张伯礼,等.羟丙基-β-环糊精对黄芩苷角膜透过性研究[J].天津中医药大学学报,2008,25(6),506-508.
[3]Saettone M F,Chetom P,Cerbai R,et al.Evaluation of ocular permeation enhancers:in vitor effects on corneal transport of four blockers,and in ivtro/in vivo toxic activity[J].Int J Pharm,1996,142(1):103-113
[4]Jim Jiao.Polyoxyethylated nonionic surfactants and their applications in topical ocular drug delivery[J].Adv Drug Deliv Rev,2008,60:1663.
[5]刘 睿,刘志东,舒乐新,等.3种渗透促进剂对芒果苷离体角膜透过率的影响[J].中国中药杂志,2010,35(23):3131-3134.
[6]周 庄,林绍彬.Solutol HS15对黄豆苷元小肠吸收促进作用的研究[J].福建中医药大学学报,2011,42(1):50-51.
[7]张密霞,李 越,杜 嵘,等.黄芩苷对体外培养神经干细胞分化的影响[J].天津中医药大学学报,2007,26(4):199-201.
[8]李 越,杜 嵘,张艳军.高效液相色谱法测定人参皂苷Rg1与黄芩苷在细胞培养基中的含量变化[J].天津中医药,2006,23(2):160-162.
[9]汪丽娅,张占军,王 忠,等.黄芩苷对脑缺血大鼠的治疗作用及对Capase-3的影响[J].天津中医药,2006,23(2):143-146.
[10]赵 诤,宋西卫,刘志东.不同促渗剂对黄芩离体鼠皮透过行为的影响[J].天津中医药,2009,25(5):423-425.
