5-氮胞苷联合丹酚酸B促进大鼠骨髓间充质干细胞向心肌样细胞分化*
2013-07-14胡先同王一婧范英昌
高 青,季 红,胡先同,王一婧,范英昌
骨髓间充质干细胞(MSCs)是从中胚层发育的早期细胞,具有自我更新和多向分化潜能,可分化为脂肪细胞、成骨细胞、心肌细胞[1]。在组织工程中,MSCs作为一种重要的种子细胞越来越引起人们的关注。其中MSCs分化为心肌细胞给心肌梗死的治疗带来了新的希望,目前临床上将MSCs直接注射到心肌梗死区域虽然在一定程度上可改善心脏的功能但也有很多不良反应,如心律不齐等,因此在移植前对MSCs进行预处理是很有必要的。经典的诱导MSCs分化为心肌细胞的药物5-氮胞苷为一种去甲基化药,对细胞有一定的毒性作用,不适合应用于临床[2-3]。本研究将5-氮胞苷联合有保护心肌细胞作用的丹酚酸B应用于MSCs向心肌细胞分化的过程中,为临床应用提供参考依据。
1 材料与方法
1.1 实验动物与试剂 体质量为(200±20)g的清洁级SD雄性大鼠(中国医学科学院放射医学研究所实验动物中心,动物许可证号:scxk2009-0001)。
L-DMEM培养基(美国GIBCO公司);特级胎牛血清(FBS,美国GIBCO公司);CD44兔多克隆抗体,CD34兔多克隆抗体,即用型SABC免疫组化染色试剂盒,DAB显色试剂盒AR1025,均由武汉博士德生物工程有限公司提供;实时荧光定量PCR(QPCR)试剂盒及Western blot试剂盒(北京康为试剂);心肌早期转录因子(GATA-4)及心肌特异性肌凝蛋白重链(α-MHC)兔单克隆抗体(美国EPITMICS公司);所用引物由上海生工生物有限公司合成。
1.2 MSCs体外分离、培养方法 大鼠MSCs体外分离和培养采用贴壁培养法:取雄性SD大鼠,颈椎脱臼处死,无菌条件下取双侧股骨、胫骨,适量D-Hank’s液冲洗骨髓,100目筛网过滤,然后离心(800r/min,5min),接种于完全培养液(L-DMEM 含体积分数为10%胎牛血清、100 mg/L青霉素、100 mg/L链霉素),置于37℃、5%CO2饱和湿度的培养箱中继续培养,48 h后首次换液,以后每3 d更换1次培养液。1周后,细胞80%长满瓶底。
1.3 MSCs的鉴定 选用生长状况良好的第3代(P3)MSCs,用链霉亲和素-生物素-过氧化物酶复合物(SABC)法检测细胞表面抗原CD44和CD34。
将大鼠MSCs培养于6孔板,孔板内置无菌盖玻片,1周后,细胞80%长满瓶底,用95%乙醇(加少量冰醋酸)固定15 min。磷酸盐缓冲液(PBS)清洗3遍,每遍5min。用3%的H2O2溶液室温浸泡30min,以灭活内源性过氧化物酶。再次PBS清洗,后滴加5%牛血清白蛋白(BSA)封闭液,室温孵育20 min,甩去多余液体。滴加1∶100一抗(兔IgG)4℃过夜。PBS清洗3遍,每遍5 min,滴加生物素化山羊抗兔IgG,37℃孵育20 min。PBS清洗3遍,每遍5 min,滴加试剂SABC,37℃孵育20 min。PBS清洗3遍,每遍5 min。DAB室温显色,镜下控制反应时间,一般在5~30 min之间。蒸馏水洗涤,苏木素轻度复染,脱水,透明,封片。显微镜观察。
1.4 MSCs的诱导及继续培养 将生长良好的第4代细胞分为4个组:正常对照组、5-氮胞苷组、丹酚酸B组、5-氮胞苷+丹酚酸B组。5-氮胞苷浓度为10 μmol/L,丹酚酸B浓度为22 μmol/L。加药前1 d各组细胞加不含血清的培养基同步化培养,加药24 h后换正常培养基培养,之后隔天换液培养2周。
1.5 诱导后MSCs的QPCR检测 采用DNA/RNA/蛋白分离试剂盒从MSCs中提取总RNA;反转录制备cDNA;以cDNA为模版,在反应体系中加入目的基因和内参对照基因的引物,见表1,按照QPCR说明书加入试剂及设定条件,进行目的基因的扩增。
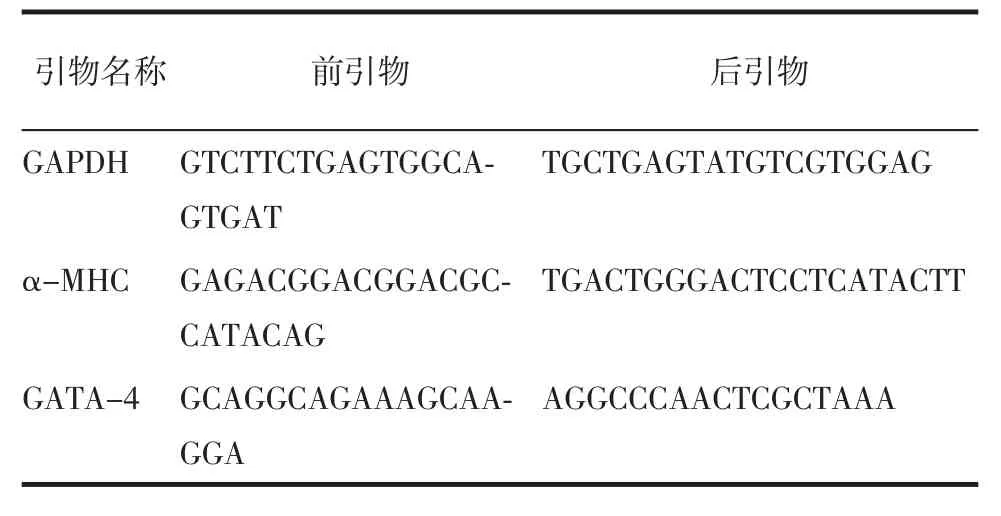
表1 QPCR的引物
1.6 Western blot检测蛋白表达 采用细胞浆及细胞核蛋白提取试剂盒从贴壁细胞中获取总蛋白,细胞裂解液均一化后用BCA蛋白定量试剂盒进行定量,加上样缓冲液煮沸5 min。SDS-PAGE电泳:按《分子克隆》方法进行SDS-PAGE,积层胶5%,分离胶6%、12%,胶厚1 mm、0.75 mm。湿法转膜:胶于转移液(含甲醇15%)中平衡10 min;从下至上分别放置滤纸、胶、PVDF 膜(0.45 μm)、滤纸,夹子夹好放入倒好转移液的转移槽中,250 mA转膜90 min。封闭:将膜取出,放入含5%脱脂奶粉的抗体稀释液(PBST),室温封闭2 h。一抗、二抗结合:取出膜,对应一抗 1∶200稀释,4℃过夜;PBST洗3次,每次10 min;二抗1∶10 000稀释,室温结合1 h;分别用PBST和PBS各洗3次,每次10 min。显影:等比例混合显色基质A液和B液,均匀滴加膜上,静置1 min,用保鲜膜将膜包好,轻轻挤出多余显色基质,放入暗盒,曝光 2~5min。
1.7 统计分析 应用SPSS 18.5统计软件分析,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 MSCs形态学观察 MSCs于接种4 h后即见细胞贴壁,24 h后可见贴壁的MSCs呈纺锤状的成纤维细胞样外观。原代培养3 d后,细胞开始呈集落样生长,增殖明显,细胞呈梭形或星形,体积较小,随着继续培养,细胞体积增大,约14 d后可铺满瓶底。
2.2 MSCs表面抗原的免疫细胞化学染色结果 MSCs免疫细胞化学染色结果显示CD44呈阳性表达,CD34呈阴性表达。阳性细胞胞浆内含棕黄色、颗粒状物质,见图1、图2。

图1 MSCs CD44表达阳性

图2 MSCs CD34表达阴性
2.3 QPCR及Westernblot检测结果 加药诱导2周后,检测各组中GATA-4、α-MHC的mRNA及蛋白的表达量。结果显示,5-氮胞苷组、丹酚酸B组、5-氮胞苷+丹酚酸B组GATA-4、α-MHC mRNA及蛋白的表达量高于正常对照组,差异有统计学意义(P<0.05)。5-氮胞苷+丹酚酸B组的GATA-4、α-MHC mRNA及蛋白的表达量高于5-氮胞苷组、丹酚酸B组,且差异有统计学意义(P<0.05)。见图3-5,表2、表3。

表2 诱导2周后GATA-4和α-MHC mRNA的表达量

表3 蛋白条带灰度分析
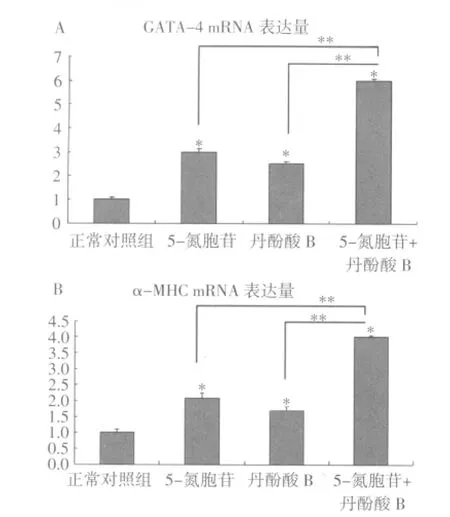
图3 诱导2周后GATA-4和α-MHC mRNA的表达量
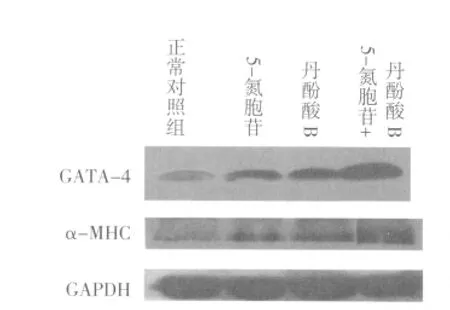
图4 诱导2周后GATA-4和α-MHC蛋白的表达量

图5 蛋白条带灰度分析
3 讨论
本研究将5-氮胞苷联合丹酚酸B作用于MSCs以检测其分化为心肌样细胞的能力。结果显示5-氮胞苷与丹酚酸B联合作用可成功诱导MSCs向心肌样细胞分化,GATA-4、α-MHC mRNA及蛋白的表达含量为正常对照组的4倍左右。且两种药物联合使用作用强于任何一种单一的药物,联合用药组中GATA-4、α-MHC mRNA及蛋白的表达含量是单独用药组的两倍左右。5-氮胞苷和丹酚酸B两组之间没有明显差异。
MSCs保持着很强的分化潜能,多年来研究者尝试各种方式促进其分化为心肌细胞,但效果不甚理想[4]。经典的5-氮胞苷是目前使用比较多的促心肌分化药物,有一定的效果,但会对细胞产生毒性作用[3]。丹酚酸B是丹参的一种单体,临床上有活血化瘀的作用,用于心血管系统疾病的治疗[5-6]。近年来,从基因水平上重塑MSCs的特征成为最新的干细胞研究热点。Islet-1基因是LIM转录因子家族的一员,在乙酰化调控间充质干细胞向心肌样细胞分化过程中发挥着重要的作用[7-9]。研究表明miR-1、206、24、181及新发现的 miR-499等 miRs具有诱导MSC向心肌细胞分化的功能,同时miR-133向对心肌细胞分化过程具有抑制作用[10-12]。此外,信号通路的开关也直接影响到MSCs向心肌细胞分化的过程。抑制经典Wnt信号通路促进MSCs向心肌细胞的分化过程[13-14],而激活Notch信号通路同样可促进此过程。Notch信号主要通过临近细胞间的相互作用来精确调控各谱系细胞的增殖与分化[15]。
综上所述,本实验证明了5-氮胞苷和丹酚酸B联合作用可提高MSCs向心肌细胞分化的程度,为临床应用提高一定的理论基础。同时,MSCs分化为心肌细胞是一个十分复杂的过程,还需要从多方面多角度的思考这个问题,进行深入的研究,阐明其分化的关键点以为临床上的应用打下基础。
[1]Fukuda K,Yuase S.Stem cells as a source of regenerative cardiomyocytes[J].Circ Res,2006,98(8):1002-1013.
[2]Xing Y,Lv A,Wang L,et al.The combination of angiotensin II and 5-azacytidine promotes cardiomyocyte differentiation of rat bone marrow mesenchymal stem cells[J].Mol Cell Biochem,2012,360(1/2):279-287.
[3]冼绍祥,杨忠奇,秦佳佳,等.5-氮胞苷诱导大鼠骨髓间充质干细胞向心肌样细胞分化及黄芪甲苷的协同作用[J].中国组织工程研究,2012,16(10):1861-1865.
[4]刘博武,吕安林,黄 炜,等.四种诱导剂诱导骨髓间充质干细胞向心肌样细胞的分化[J].中国组织工程研究,2012,16(14):2471-2476.
[5]谢 静.加味丹参饮联合BMSCs移植对IRI大鼠心肌细胞的保护作用及机制研究[D].湖南中医药大学,2012.
[6]华声瑜,赵桂峰,李庆雯.丹酚酸B预处理EPCs对AMI大鼠移植骨髓间充质干细胞后心肌微环境的影响[J].天津中医药,2012,29(2):117-120.
[7]鲁 荣,朱 静,田 杰,等.Islet-1诱导C3H10 T1/2细胞向心肌样细胞分化过程中对心肌特异蛋白基因上组蛋白乙酰化的促进作用[J].第三军医大学学报,2012,34(10):938-942.
[8]李杏肖,李晓红,林秋雄,等.转染isl1基因促进骨髓间充质干细胞向心肌样细胞分化[J].中国病理生理杂志,2012,28(1):131-135.
[9]吴慧颖.转染HO-1基因的骨髓间充质干细胞(MSCs)移植治疗慢性心衰的实验研究[D].吉林大学,2012.
[10]张鹭鹭,刘惊今,王永顺,等.microRNA499慢病毒载体转染诱导大鼠骨髓间充质干细胞向心肌样细胞分化 [J].现代生物医学进展,2012,26(12):5027-5031.
[11]文 通,魏云峰,王梦洪,等.microRNA-1诱导大鼠骨髓间充质干细胞向心肌样细胞分化[J].基础医学与临床,2011,31(1):41-46.
[12]徐秀梅,姜希娟,周 冰.条件培养液体外诱导骨髓间充质干细胞向心肌样细胞分化的实验研究[J].天津中医药大学学报,2009,28(4):191-194.
[13]Cho J,Rameshwar P,Sadoshima J.Distinct roles of glycogen synthase kinase (GSK)-3α and GSK-3beta in mediating cardiomyocyte differentiation in murine bone marrow-derived mesenchymal stem cells[J].J Biol Chem,2009,284:36647-36658.
[14]Brade T,M覿nner J,Kühl M,et al.The role of Wnt singling in cardiac development and tissue remodeling in the mature heart[J].Cardiovasc Res,2006,72(21):198-209.
[15]牛 萍,赵月强,黄星原.骨髓间充质干细胞体外增殖及分化过程中Notch信号的表达变化[J].基础医学与临床,2011,11(11):1205-1209.
