红曲霉M1发酵糙米代谢产物抗S180细胞增殖效应研究
2013-07-10王昌禄陈勉华李素珍王玉荣李贞景
王 婧, 王昌禄, 陈勉华, 杨 华, 李素珍, 王玉荣, 李贞景
(天津科技大学食品工程与生物技术学院/食品营养与安全教育部重点实验室,天津 300457)
红曲既是中药材又是食品,在我国和东南亚一些国家应用已有上千年的历史[1].红曲霉发酵产品中含有多种功能活性物质,具有降血脂、抑菌防腐、抗癌等功效,备受关注.红曲色素主要由红、橙、黄三类色素组成,红色素及橙色素具有抑菌和防腐的功效,黄色素有细胞毒活性,可促进癌细胞的凋亡[2].Monacolin类物质对高血脂有控制作用,其中主要功效来源于Monacolin K(MK),主要通过抑制胆固醇生物合成途径中关键酶——羟甲戊二酰辅酶A(HMG-CoA)还原酶的作用而起到降血脂的作用[3].红曲中γ-氨基丁酸(GABA)是降血压的有效成分,也有抗氧化及降血糖的作用[4].红曲中桔霉素是一种真菌毒素,可引起肾脏肿大,尿量增多,肾小管扩张和上皮细胞变性坏死等症状,因此,如何有效控制桔霉素产生,降低其在食物中的含量,已成为食品健康发展的关键[5].
发酵基质对红曲霉代谢产物组成及活性有显著影响:红曲霉发酵薏仁显现出更强的抗氧化活性[6];红曲山药比红曲米表现出更强的降压效果和血管紧张素转换酶(ACE)抑制活性,并且可产生更多的GABA和具有抗炎作用的色素组分[7];红曲霉发酵的当归具有良好的减肥效果[8].
糙米具有大米所没有的谷粒皮层和胚,含有多种保健功能成分,且皮层中较多的纤维类物质可减少粪便中诱导有机体突变物与肠道上皮细胞的相互作用,从而降低癌症风险[9-10].
目前,市场中功能性红曲米的发酵基质多为大米,不利于红曲功能性产品的多样性开发.本实验用红曲霉M1分别发酵大米(MR)和糙米(MBR),对其主要代谢产物含量进行对比,并通过MTT(3-(4,5-二甲基噻唑-2)-2,5-二甲苯基四氮唑溴盐)比色实验,以MK标准品为参比,对MBR、MR乙醇提取物抗S180小鼠腹水瘤细胞增殖效应进行初步研究,分析了功能性红曲对肿瘤细胞的抑制作用,对红曲霉发酵产物中MK是否为唯一抑癌因子进行了探讨,为开发特征活性红曲功能性产品提供了理论依据.
1 材料与方法
1.1 材料与试剂
糙米、大米均为市售;红曲霉M1为天津科技大学食品生物技术实验室保藏;乙腈、甲醇(色谱纯),德国CNW公司;桔霉素标准品(纯度≥99%),MK标准品(纯度≥98%),GABA标准品(纯度≥99%),MTT,均为美国 sigma公司;MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐),美国sigma公司;DMSO,北京鼎国昌盛生物技术公司.
1.2 主要设备
8453型紫外可见分光光度计,美国安捷伦科技有限公司;1200s型高效液相色谱仪(配有紫外检测器、荧光检测器和B.04.03.SP1 87色谱工作站),美国安捷伦科技有限公司;Model 1680型酶标仪,美国BIO-RAD公司.
1.3 实验方法
1.3.1 培养基
斜面培养基(麦芽汁培养基):将一定量的大麦芽粉碎,加4倍于麦芽量的自来水,于55~60℃保温糖化3~4 h,经6~8层纱布过滤除去残渣,煮沸、过滤,加水稀释至糖度为10~12°Brix,用时添加质量分数为2%的琼脂,121℃灭菌20 min.
种子液培养基(g/L):葡萄糖60 g,蛋白胨20 g,NaNO310 g,MgSO4·7H2O 5 g,KH2PO410 g,自来水1 000 mL,121℃灭菌20 min.
固体发酵培养基:将糙米和大米分别与自来水以1(g)∶1(mL)的比例浸泡过夜,分装入250 mL三角瓶中,每瓶20 g原料,自来水20 mL,121℃灭菌20 min.
1.3.2 红曲霉固态发酵条件
将菌种接种于斜面培养基,30℃培养6~8 d,制成孢子浓度为2×106个/mL的孢子悬浮液,以每瓶5 mL接种于固体发酵培养基中,30℃培养4 d,置于温度27℃,湿度75%时培养,35 d后取出.
1.3.3 红曲色素色价测定方法
将发酵样品于40℃烘干至恒重,粉碎,过40目筛,根据国标GB4926—1985[11]方法测定其色价.
1.3.4 桔霉素测定方法
1.3.4.1 标准曲线绘制
将质量浓度为500 μg/mL的桔霉素乙腈标准溶液配制成质量浓度为0,0.05,0.10,0.50,1.00,2.00,5.00,10.00 μg/mL的标准溶液系列.
1.3.4.2 样品处理[12]
将发酵样品于40℃烘干至恒重,粉碎,过100目筛.准确称取0.500 0 g样品,置于20 mL离心管中,加入8 mL体积分数75%的乙醇,超声30 min,3 000 r/min离心10 min,重复3次,合并上清液,定容至25 mL,静置30 min,经0.45 μm滤膜过滤后待测.
1.3.4.3 色谱条件
色谱柱 Agilent TC-C18(4.6 mm×250 mm,5 μm). 流动相 V(乙腈)∶V(甲醇)∶V(水)=70∶10∶20(用磷酸调pH值为2.66~2.68).检测器 荧光检测器.检测波长 λex=331 nm,λem=500 nm.柱温 25℃.流速:1 mL/min.进样量20 μL.
1.3.5 MK测定方法
1.3.5.1 标准曲线绘制
将质量浓度为500 μg/mL的MK乙腈标准溶液配制成质量浓度为0,0.1,0.5,1.0,2.0,5.0,10.0 μg/mL的标准溶液系列.
1.3.5.2 样品处理
同1.3.4.2.
1.3.5.3 色谱条件
到2049年,使现有的水土流失面积全部得到治理和巩固,江河泥沙含量减少90%,农业人均保水保土基本农田面积达到0.15 hm2,森林覆盖率达到45%以上,生态系统得到全面修复,生态环境全面进入良性循环,全市实现江河清澈、山川秀美目标,构建起实现资阳水土保持生态文明梦新篇章。
色谱柱 Agilent TC-C18(4.6 mm×250 mm,5 μm);流动相 V(乙腈)∶V(水)=6∶4;检测器 紫外检测器;检测波长 λ=237 nm;柱温 25℃;流速 1 mL/min;进样量 20 μL.
1.3.6 GABA测定方法
1.3.6.1 标准曲线绘制
将质量浓度为500 μg/mL的GABA标准水溶液配制成质量浓度为0,10,20,50,100,200 μg/mL的标准溶液系列.
1.3.6.2 样品处理
将发酵样品于40℃烘干至恒重,粉碎,过100目筛.准确称取0.500 0 g样品,加入4 mL质量分数为4%的TCA溶液,30℃水浴2 h转至离心管中,10 000 r/min离心10 min,用TCA定容至5 mL.吸取200 μL 样品溶液,200 μL 衍生剂(OPA 80 mg,β-巯基乙醇80 μL,甲醇10 mL)和1 mL硼酸缓冲液(0.4 mmol/mL,pH 10.4),振荡 5 min,经 0.45 μm 滤膜过滤后立刻检测.
1.3.6.3 色谱条件
色谱柱 Agilent TC-C18(4.6 mm×250 mm,5 μm);流动相 V(NaCOOH·3H2O(质量分数为1.6‰))∶V(甲醇)∶V(乙腈)=3∶1∶1,pH 7.2;检测器 紫外检测器;检测波长 λ=338 nm;柱温 40℃;流速 1 mL/min;进样量 20 μL.
1.3.7 MTT法体外抑制S180小鼠腹水瘤细胞增殖实验
1.3.7.1 样品制备
分别称取10.0 g MBR、MR,放入50 mL离心管中,加入16 mL 75%乙醇,超声处理30 min,3 000 r/min离心10 min,重复3次,合并上清液,35℃烘干.
为保证细胞实验中MBR、MR乙醇提取物中MK含量一致,检测提取物中MK含量,通过计算,分别称取一定量的MBR、MR乙醇提取物,备用.
1.3.7.2 红曲霉M1发酵糙米和大米提取物体外抑制S180增殖实验
从小鼠体内抽取生长状态较好的S180小鼠腹水瘤细胞,先后用红细胞裂解液和培养基清洗干净,配成1×105个/mL细胞悬液,加至96孔培养板中,每孔100 μL.设置实验组和对照组,实验组分别加入不同浓度的MK标准品、MR和MBR乙醇提取物(终质量浓度分别为50,25,12,6,3 μg/mL),每组4个平行,对照组加培养基(DMSO的质量分数均控制在0.1%以下).分别培养24,48,72 h,实验终止前4 h加入50 μL MTT(5 mg/mL)溶液,继续培养4 h,离心,弃去上清液,每孔加100 μL DMSO,490 nm处测定吸光值,计算抑制率.

2 结果与分析
2.1 红曲活性物质的检测结果
发酵样品中桔霉素、GABA和MK的液相色谱分析结果见图1(a)、(b)、(c).
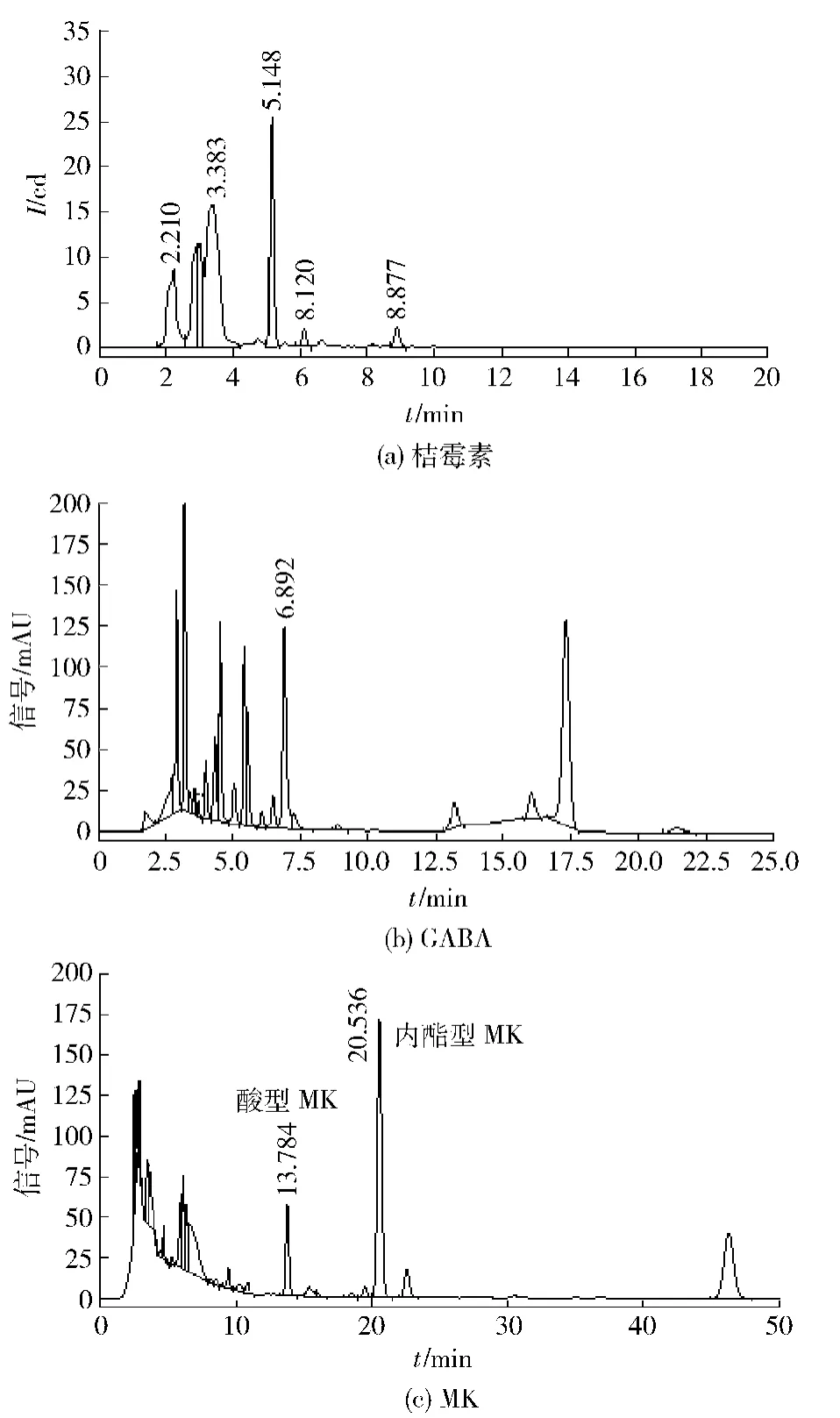
图1 样品中桔霉素、GABA、MK的高效液相色谱Fig.1 HPLC of citrinin、GABA、MK in samples
由图1(a)、(b)、(c)及标准品保留时间可以得出,样品中各物质的保留时间分别为:桔霉素5.148 min;GABA 6.892 min;酸型MK 13.784 min,内酯型MK 20.536 min.
2.2 不同发酵基质对红曲发酵产物中活性物质的影响
分别以糙米、大米为发酵基质,红曲霉M1代谢产物MK、桔霉素、GABA产量及色价对比见图2和图3.
由图2和图3可知,不同发酵基质对红曲霉M1固体发酵产物中活性物质的组成及含量均有很大影响.MBR乙醇提取物中MK总质量分数为292.34 μg/g,是MR乙醇提取物的1.3倍.在未发酵糙米中,GABA质量分数为115.01 μg/g,经红曲霉M1发酵后达到2.98 mg/g,提高了约25倍.经红曲霉M1发酵的MBR,产桔霉素和色素能力均低于MR,分别为MR的44%和47%.

图2 MBR、MR中MK含量对比Fig.2 Contrast of MK content between MBR and MR
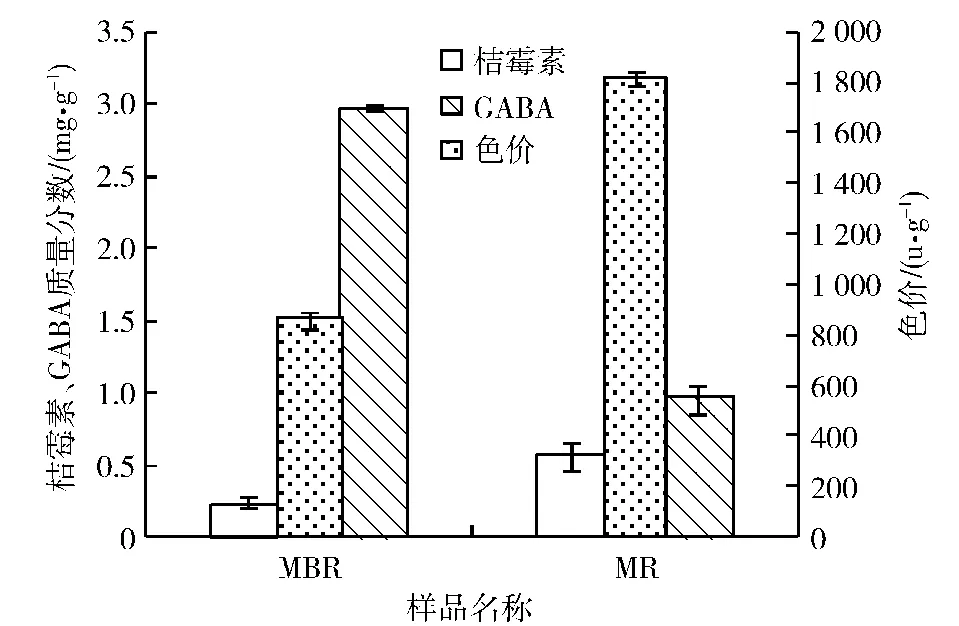
图3 MBR、MR中桔霉素、GABA含量及色价对比Fig.3 Contrast of citrinin,GABA and color value between MBR and MR
在红曲霉M1发酵产物中,MK主要以开环式酸型、闭环式内酯型以及闭环结构脱水后的酯化型三种形态存在.在人体中,内酯型MK必须经肝脏转化为酸型结构才能发挥降低血脂的效果,酯化型MK因与酶结合的部位没有—OH基团而不具有抑制活性.因此,酸式构型为红曲调脂药物的活性形式,它无需体内的羟基酯酶参与水解也可直接发挥作用,从而减少了人体对肝、肾的负担[13].由于酯化型MK为无功效结构,因此,在本实验中,仅对MK的酸式构型及内酯构型进行检测.由图2可以看出,在MBR乙醇提取物中酸型及内酯型MK均可检测到,而MR乙醇提取物中未检测到酸型MK.因此,以糙米作为发酵基质更具优势.
在糙米和大米中,维生素、矿物质元素、蛋白质等营养物质种类和含量各不相同,支链淀粉及纤维含量的差别影响着发酵过程中培养基的溶氧量和持水性,会对红曲霉生长及代谢造成一定的影响,从而引起代谢产物的变化.
2.3 MBR和MR乙醇提取物对S180小鼠腹水瘤细胞的体外抑制作用
24,48,72 h时MK标准品、MBR及MR乙醇提取物对S180小鼠腹水瘤细胞的抑制率见图4(a)、(b)、(c).
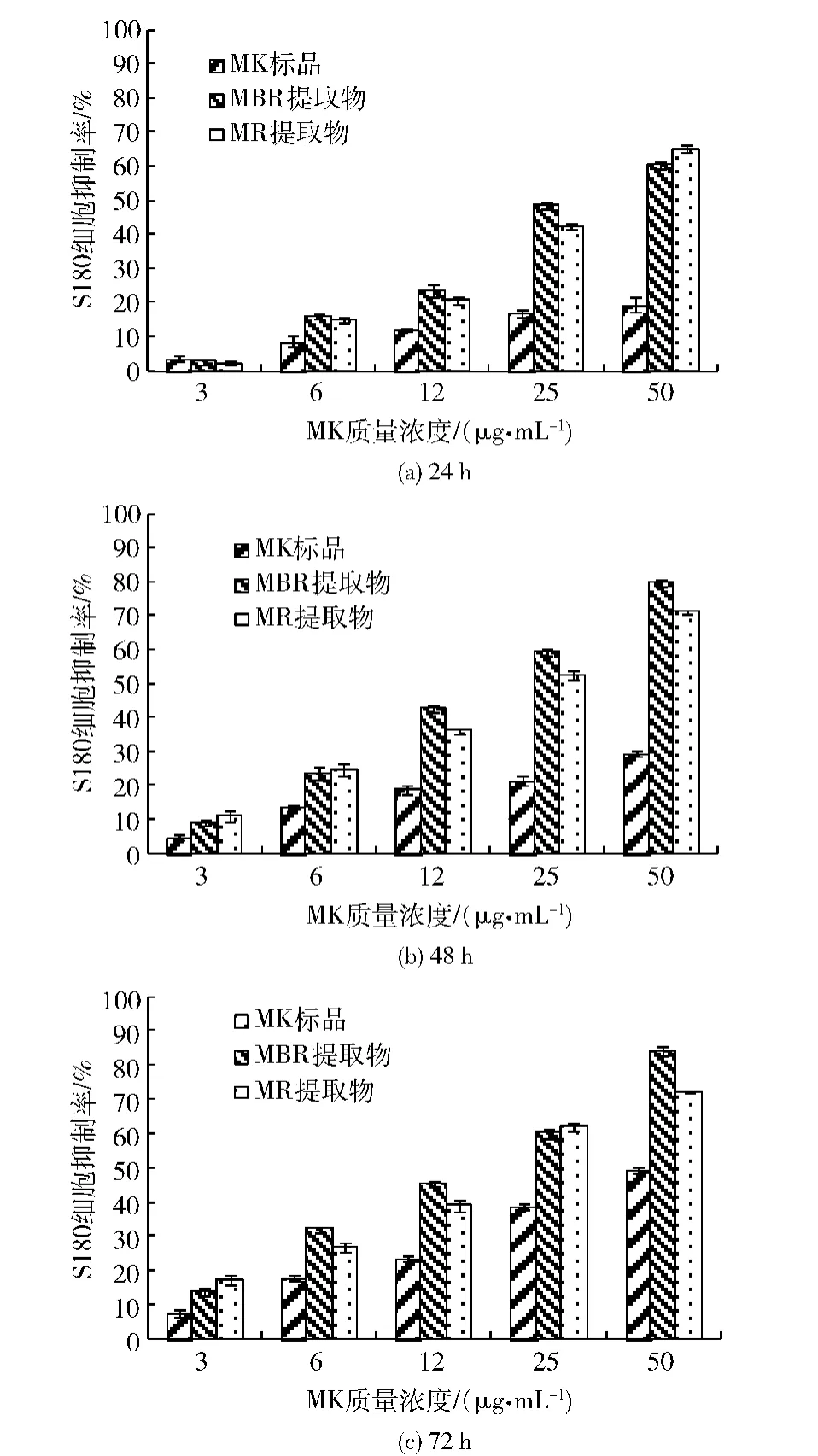
图4 24,48,72 h时MK及样品对S180小鼠腹水瘤细胞的抑制作用Fig.4 Growth inhibitory effect of MK and samples on S180 cell at 24,48 h and 72 h
由图4可以看出,作用时间相同并在一定 MK浓度范围内,MK标准品、MBR和MR乙醇提取物对S180小鼠腹水瘤细胞的抑制率随MK浓度的增大而增大;三者对S180小鼠腹水瘤细胞抑制作用强弱顺序为:MBR>MR>MK,且MBR和MR的抑制效果显著大于MK标准品(p<0.01).
24 h内,由于作用时间较短,3种样品对腹水瘤细胞的抑制效果不明显,24~48 h内抑制率增长较快,48~72 h内抑制作用变化不大.总之,MK标准品、MBR和MR乙醇提取物对S180小鼠腹水瘤细胞的抑制率随作用时间的延长而增大,呈一定的剂量依赖关系.48 h和72 h时,MK质量浓度为50 μg/mL的MBR抑制率达到最大,约为80%.
研究表明[14],胆固醇的产生是肿瘤细胞增殖的必要条件,HMG-CoA还原酶(HMGCR)对肿瘤细胞的增殖有促进作用.因此,包括lovastatin(结构与MK完全一致)在内的他汀类物质对肿瘤细胞增殖有抑制作用,可预防性地减少癌症的发病率[15-16].本实验结果显示,红曲霉M1发酵产物对S180小鼠腹水瘤细胞抑制作用强于MK标准品,这可能是由于红曲中除他汀类物质对肿瘤细胞有抑制作用外,红曲色素、酶类及红曲多糖等活性物质也有一定的抗炎调脂、调节免疫功能、抗氧化的作用,可多靶向地对肿瘤细胞起到预防及抑制作用.在MK浓度相同的条件下,MBR乙醇提取物对S180小鼠腹水瘤细胞抑制率高于MR乙醇提取物,可能是由于糙米中含有多种大米没有的功能性成分,如米糠脂多糖、胚芽中的肌醇六磷酸等,对肿瘤细胞产生一定的抑制作用,也可能是在糙米发酵过程中产生了新的活性物质,增强了其抑制肿瘤的能力.因此,当MK浓度相同时,红曲霉发酵产物中多种活性物质共同作用于S180小鼠腹水瘤细胞,使其具有比MK标准品更强的抑制肿瘤细胞增殖的能力,且MBR乙醇提取物对S180小鼠腹水瘤细胞的抑制作用强于MR乙醇提取物.
3 结 论
对红曲霉M1发酵糙米(MBR)与大米(MR)代谢产物组成及含量进行了研究,结果表明:在MBR提取物中,酸型和内酯型MK同时存在,总MK和GABA含量高于MR,红曲色素色价及桔霉素含量低于MR.两者相比,当以红曲霉为发酵剂,以大米作为发酵基质时,更适合于红曲色素的开发;以糙米作为发酵基质,活性物质的产量与安全性较高,更适用于功能红曲的生产.
由S180小鼠腹水瘤细胞体外抑制作用实验可知,MBR、MR乙醇提取物和MK标准品均对其具有一定的抑制作用,当三者MK含量相同时,作用强度依次减小.可见,MK并不是红曲霉M1发酵产物中唯一的抑癌因子,其对肿瘤细胞的抑制作用是多种活性物质共同作用的结果.
发酵基质的种类、状态及营养成分影响着红曲霉代谢产物的种类和组成,一些未知的生物活性物质也可赋予红曲产品新的功能.
本文研究了以糙米为发酵基质时,红曲功能活性物质组成和产量的变化,为红曲保健产品的开发奠定了基础.在今后的研究中,还可通过多种肿瘤细胞实验、动物实验对红曲霉代射产物的抗肿瘤作用进行进一步的验证,探究具有抑制作用的活性因子,并针对这些功能因子对红曲霉代谢产物进行深入研究.
[1] Ma Jiyuan,Li Yongguo,Ye Qing,et al.Constituents of red yeast rice,a traditional Chinese food and medicine[J].Journal of Agricultural and Food Chemistry,2000,48(11):5220-5225.
[2] Lin Y L,Wang T H,Lee M H,et al.Biologically active components and nutraceuticals in the Monascus-fermented rice a review[J].Applied Microbiology and Biotechnology,2008,77(5):965-973.
[3] 孙伟,刘爱英,梁宗琦.红曲中莫纳可林K(Monacolin K)的研究进展[J].西南农业学报,2003,16(3):112-116.
[4] 杨涛,林清录,周俊清.红曲生理活性物质及其开发应用的安全性评价[J].中国食物与营养,2005(1):28-30.
[5] 王春玲,戚飞,李颂.真菌毒素在食品工业中的危害与控制[J].北京工商大学学报:自然科学版,2012,30(4):12-14.
[6] Joan H Y,Yu H T,Yu L L,et al.Antioxidant properties of methanolic extracts from monascal rice[J].LWT,2006,39(7):740-747.
[7] Wu C L,Lee C L,Pan T M.Red mold dioscorea has a greater antihypertensive effect than traditional red mold rice in spontaneously hypertensive rats[J].J Agric Food Chem,2009,57(11):5035-5041.
[8] Cha J Y,Jeong J J,Park C S,et al.Antiobesity activity of fermented angelicae gigantis by high fat diet-induced obese rats[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2011,27(5):758.
[9] 王赫男,王静.糙米的综合利用[J].北京工商大学学报:自然科学版,2012,30(3):49-52.
[10] 郭顺堂.我国全谷物食品的开发及存在的问题[J].北京工商大学学报:自然科学版,2012,30(5):11-15.
[11] 江苏省卫生防疫站,轻工业部食品发酵工业科学研究所.GB/T 4926—1985 食品添加剂 红曲米[S].北京:中国标准出版社,1985.
[12] Li Yongguo,Liu Hong,Wang Zhengtao.A validated stability-indicating HPLC with photodiode array detector(PDA)method for the stress tests of Monascus purpureus-fermented rice,red yeast rice[J].Journal of Pharmaceutical and Biomedical Analysis,2005,39(1-2):82-90.
[13] 丘振宇,王亚琴,许喜林.红曲霉中Monacolin K的应用研究[J].中国酿造,2007(5):4-6.
[14] Notarnicola M,Messa C,Pricci M,et al.Up-regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase activity in left-sided human colon cancer[J].Anticancer Research,2004,24(6):3837-3842.
[15] Mee Y H,Navindra P,Seeram,et al.Anticancer effects of Chinese red yeast rice versus monacolin K alone on colon cancer cells[J].The Journal of Nutritional Biochemistry,2008,19(7):448-458.
[16] 邢旺兴,张梅,方琅,等.中药红曲的药理作用研究进展[J].药学实践杂志,2006,24(1):1-3.
