HPV分型及高危八型定量检测在宫颈病变中的意义
2013-07-08赵颖林敏潘美晨杨礼蔡应木
赵颖 林敏潘美晨 杨礼蔡应木★
HPV分型及高危八型定量检测在宫颈病变中的意义
赵颖1林敏2潘美晨1杨礼1蔡应木1★
目的分析宫颈病变中的人乳头瘤病毒的亚型分布及病毒载量的情况,以及其与宫颈疾病进展的关系。方法潮州中心医院就诊的220例液基细胞学检查异常的患者行阴道镜检查及组织病理学检查。收集宫颈脱落细胞标本,运用HybriMax导流杂交技术检测HPV的21个亚型,运用实时荧光PCR定量检测八个高危亚型的病毒载量。结果220例样本中,HPV感染率为87.3%,其中HPV16是最主要的基因型(50.91%),随着宫颈病变程度的增高,总HPV感染率和HPV16感染率逐渐升高。HPV58,HPV33,HPV52,HPV31和HPV18是仅次于HPV16的五种基因亚型,其检出率分别为22.73%,11.82%,11.36%,5.9%和4.54%。高危HPV亚型的病毒载量与宫颈病变的严重程度呈正相关(r=0.373,P<0.001)。结论尽管HPV52和HPV58是该地区HPV感染的主导亚型,但在宫颈病变患者中HPV感染以HPV16为主,而与宫颈癌最相关的是HPV16和HPV18。病毒载量是一个潜在的确定子宫颈癌及癌前病变的辅助指标。
高危型人乳头瘤病毒;宫颈上皮内瘤变;实时荧光定量PCR
宫颈癌是女性最常见的恶性肿瘤之一[1]。人类乳头状瘤病毒(Human papillomavirus,HPV)感染被证实是宫颈癌发生的必要原因,几乎100%的宫颈癌中能检测到HPV感染。然而大多数妇女的HPV感染呈自限性,经过1~2年,HPV感染能够被机体清除。因此,怎样识别持续性感染并评估其发展成为高度上皮内瘤变(cervical intraepithelial neoplasia,CIN)或宫颈癌的风险是宫颈癌预防和筛查的一个亟需解决的难题。
本研究通过对宫颈病变中不同阶段患者的宫颈脱落细胞进行HPV亚型检测和HPV高危八型定量测定,确定各级宫颈病变中HPV感染的亚型分布和病毒载量情况,探讨HPV亚型和HPV病毒载量在宫颈病变发展中的作用以及意义。
1 资料和方法
1.1 资料
在潮州中心医院就诊行液基细胞学检查(TCT)者,采用TBS分类法,结果异常的220位患者。年龄范围18至64岁,平均年龄40.6岁。
1.2 研究方法
220例患者均行电子阴道镜检查和宫颈活检及HPV亚型检测和高危八型的病毒载量测定。
1.2.1 阴道镜检查以及病理活检
严格按照操作说明进行电子阴道镜检查,对可疑部位活检或同时行宫颈管搔刮术;阴道镜活检标本病理学检查由潮州市中心医院病理科医师完成。
1.2.2 HPV-DNA分型测定
用宫颈脱落细胞采集器于宫颈口采集表皮脱落细胞,运用凯普提取试剂盒按说明书严格操作提取DNA,采用MY09/MY11 L1通用引物扩增40个循环,运用凯普HybriMax导流杂交和基因芯片进行HPV基因亚型检测。
1.2.3 高危HPV定量测定
经提取的DNA样本,应用中山大学达安基因股份有限公司的人乳头瘤病毒高危八型(16、18、31、33、45、52、56、58)引物在Roche-Lightcycler 480上对E6/E7片段进行扩增,通过环阈值的大小以及扩增效率计算样本的原始拷贝数。
1.3 数据统计
统计学处理采用SPSS13.0统计软件,以组织病理学检查结果作为金标准,将220个样本分为五个病理组。组间感染率比较采用卡方检验,组间的年龄均数比较采用方差分析。病毒载量与病理分级采用spearman相关性分析,经log转换后的病毒载量采用方差检验,年龄分组之间的病毒载量以及单纯感染和多重感染病毒载量以及病理分级的比较均采用Pearson相关性分析,P<0.05则认为有统计学意义。
2 结果
2.1 病理检查结果
220位患者中,经阴道镜活检病理结果为慢性宫颈炎的患者32例、CIN1的患者60例、CIN2的患者60例、CIN3的患者32例、宫颈癌的患者36例。各病理组中年龄、HPV16检出率、总的HPV检出率、高危八型检出率以及病毒载量的分布见表1。
2.2 HPV亚型检测
在220例样本中,HPV感染192例(87.3%),包括18种基因亚型,其中HPV16是检出率最高的亚型(50.91%,112/220),且随着宫颈病变程度的增加,检出率逐渐增高。HPV58、HPV33、HPV52是仅次于HPV16的三个亚型,检出率分别为22.73%、11.82%、11.36%,在不同宫颈病变中感染率没有太大变化(图1)。HPV18型与宫颈癌的相关性仅次于HPV16亚型,在我们的研究中检出率仅4.54%,排第六。其他高危亚型(high-risk human papillomavirus,HR-HPV)分布详见表2。

图1 HPV16、HPV58、HPV33和HPV52在各个病理组中检出率的分布Figure 1 The distribution of the detection rates of HPV16, HPV58, HPV33 and HPV52 in each pathological group
192例HPV感染者中,63例检出两个或者两个以上的亚型,占总HPV感染的32.81%,其中三种最常见的多重感染模式分别为HPV16和HPV58,HPV16和HPV33,HPV16和HPV52。
2.3 病毒载量
通过实时荧光定量PCR检测,220例检测对象中182个样本检测为阳性,其中最小病毒载量为1.13拷贝/mL,最大为5.09×106拷贝/mL,八个高危型HPV检出率与HPV分型的检出率基本一致(表1)。由于该PCR反应的线性范围为500~1×106拷贝/mL,我们将病毒载量小于500拷贝/mL的可疑阳性分为阴性组,并分阴性、低病毒载量和高病毒载量三个组与病理分级进行相关性分析。五个病理组间病毒载量具有显著差异,随着宫颈病变严重程度的增高,病毒载量逐渐升高(表3),但相邻病理组间存在重叠(图2)。经两两比较,宫颈癌组要显著高于慢性宫颈炎组和CIN1组(P<0.005)。
年龄分组中,年纪大于35岁的妇女的病毒载量要明显高于年龄小于35岁的妇女。而单纯感染和多重感染之间的病毒载量没有明显区别。
3 讨论
HPV是属于乳头瘤病毒科的一种微小双链DNA病毒,对皮肤和粘膜上皮均能造成感染,其感染具有种属特异性。已经证实HPV是宫颈癌发生的必要原因,几乎100%的宫颈癌中能够检出HPV感染[2]。
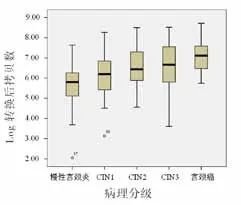
图2 log转换后的病毒载量在各个病理组中的分布Figure 2 The distribution of viral load after log conversion in various pathological groups

表1 年龄、HPV16检出率、HPV检出率、高危八型检出率和原始拷贝数在各病理组中的分布Table 1 The distribution of age, the HPV16 infection rates, the HPV infection rates, the HR-HPV infection rates and viral load in each pathological group

表2 各病理组HR-HPV基因型的分布 [n/(%)]Table 2 The distribution of HR-HPV genotypes in each pathological group [n/(%)]

表3 病毒载量与宫颈病变严重程度的相关性分析Table 3 Analysis of the association of viral load with the severity of cervical lesion
在本研究中,有87.3%(192/220)的人被检出HPV感染,随着病理程度的增加,HPV阳性率逐渐升高,在宫颈癌中最高,达94.44%,与之前的报道一致[3]。HPV16是宫颈癌中最常见的亚型,也被认为是宫颈癌和癌前病变相关的致癌性最强的亚型[4]。我们的研究中,HPV16共检出112例(50.91%),且随着病理程度加重,HPV16的检出率逐渐增高,在宫颈癌组最高(83.3%),而且无论是单纯感染还是多重感染,HPV16都是主导亚型。这与世界相关研究结果一致[5,6],表明HPV16在宫颈癌的发生和发展中起关键作用。
HPV52和HPV58是亚洲特有的两个基因亚型,在中国、日本等亚洲国家有较高的检出,而在世界其他地区很少或者没有检出。HPV58在全国范围内都有较高的检出,而HPV52在中国东南沿海地区譬如浙江、福建、台湾、香港以及广东一些地区的人群中具有较高的感染率[7,8,9]。之前在潮州进行的两项流行病学调查显示HPV52在该地区具有绝对优势[10,11],其检出率要高于HPV16和HPV58。而在我们的研究中,HPV52检出率仅11.36%,远低于此前对潮州的报道,这可能是由于目标人群的差异导致结果不同。之前还有研究显示HPV52在癌前病变的感染中高度流行,但很少在浸润性宫颈癌中检出[6]。我们的研究结果为,HPV52的整体检出率不低,但在宫颈癌中仅检出5.56%,远低于HPV16。体外实验证实,HPV52的E6和E7基因体外转换能力有限,在宫颈癌中很少能结合到宿主基因而导致无限增值[12]。这表明虽然HPV52在潮州地区人群中具有较高的流行优势,在癌前病变中的检出率不低,但是其致癌性相对较弱。
HPV58同样是潮州地区一个高流行的亚型,已有研究显示HPV58次于HPV52排第二位或者第三位[10,11]。我们的此项研究中,检出率达22.7%(50/220),排第二,仅次于HPV16,与相关研究一致。HPV18是宫颈癌相关的主要亚型之一,在世界范围内皆有较高的检出,本研究中HPV18检出率较低(4.54%),但是在宫颈癌中的检出仅次于HPV16,高于HPV52和HPV58。中国的大部分研究显示宫颈癌中HPV18的检出率仅次于HPV16。尽管HPV52和HPV58在潮州地区的HPV感染中占优势,但HPV16仍然是对宫颈癌的发生和发展最重要的亚型,而HPV18虽然检出率相对较低,但在宫颈癌中仅次于HPV16,因此HPV18同样是宫颈癌相关的最重要的亚型之一。同时,HPV58和HPV52作为该地区的优势,其在潮州地区HPV感染中具有显著优势,因此在潮州地区宫颈癌的防治以及癌前病变的筛查中仍然具有举足轻重的作用,如果第二代疫苗能覆盖HPV52和HPV58这两个特殊亚型,则能够显著提高该地区疫苗的覆盖率。
细胞学检查作为筛查手段已经使子宫颈癌的发病率大幅下降,而HPV亚型测定作为一个细胞学检查附属的筛查方法使宫颈病变的早期筛查更敏感更有效率。但无论是发达国家还是发展中国家,宫颈癌仍然是一个重大的经济负担,对于HPV感染的监测和管理依旧存有许多困惑。病毒载量作为衡量病毒感染严重程度一个指标,一直被认为是可以作为确认CIN的严重程度以及评估发展为子宫颈癌的风险的潜在指标。许多研究表明,高病毒载量与宫颈病变的严重程度正相关[13,14],在指导ASCUS阴道镜的运用方面具有重要的意义,能避免一些过度的侵入性检查,尤其是HPV16。部分研究认为HPV16的病毒载量可以评估妇女进展为宫颈癌的风险或者提示一个较为良好的预后[15,16]。但也有研究者认为病毒载量在识别妇女是否具有进展更高级别宫颈病变或者癌变趋势的作用有限,HPV感染过程中其他因素可能促进疾病的进展[17,18]。年龄和多重感染是与子宫颈癌和HPV感染相关的危险因素。本研究结果显示,随着年龄的增长,HPV感染率逐渐升高,而年龄超过35岁的妇女的病毒载量比35岁以下的妇女中的病毒载量高。随着年龄的增加HPV感染的清除率减低[19],这也许可以解释年龄较大的妇女中HPV感染率和病毒载量较高的原因。而多重感染在我们的研究中占所有HPV感染的32.81%,高于之前报道的24.01%以及中国整体的多重感染率28.98%[20]。
综合本研究表明,病毒载量与CIN以及子宫颈癌的严重程度呈正相关,随着宫颈病变严重程度的增加病毒载量逐渐升高。在病理组间,HR-HPV的病毒载量有交叉重叠,虽然无法直接表明宫颈病变的严重程度,但高病毒载量仍然提示HPV感染的妇女进展为宫颈癌的风险较高,因此高危八型病毒载量仍然是一个潜在的确定子宫颈癌及癌前病变的辅助指标。
[1] Parkin D M, Bray F, Ferlay J, et al. Global cancer statistics,2002[J]. CA Cancer J Clin, 2005, 55: 74-108.
[2] Feldman S. Making sense of the new cervical-cancer screening guidelines[J]. N Engl J Med, 2011, 365(23): 2145-2147.
[3] Liu J, Rose B, Huang X, et al. Comparative analysis of characteristics of women with cervical cancer in high-versus low-incidence regions[J]. Gynecol Oncol, 2004, 94(3): 803-810.
[4] Smith J S, Lindsay L, Hoots B, et al. Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions: a meta-analysis update[J]. Int J Cancer, 2007, 121(3): 621-632.
[5] Clifford G M, Smith J S, Plummer M, et al. Human papillomavirus types in invasive cervical cancer worldwide: a meta-analysis [J]. Br J Cancer, 2003, 88(1): 63-73.
[6] Wu Y, Chen Y, Li L, et al. Associations of high-risk HPV types and viral load with cervical cancer in China[J]. J Clin Virol, 2006, 35(3): 264-269.
[7] Lo K W, Wong Y F, Chan M K, et al. Prevalence of human papillomavirus in cervical cancer: a multicenter study in China[J]. Int J Cancer, 2002, 100(3): 327-331.
[8] Ye J, Cheng X, Chen X, et al. Prevalence and risk profile of cervical Human papillomavirus infection in Zhejiang Province, southeast China: a population-based study[J]. Virol J, 2010, 7: 66.
[9] Liu S S, Chan K Y, Leung R C, et al. Prevalence and risk factors of Human Papillomavirus (HPV) infection in southern Chinese women-a population-based study[J]. PLoS One, 2011, 6(5): e19244.
[10] Chen Q, Xie L X, Qing Z R, et al. Epidemiologic characterization of human papillomavirus infection in rural Chaozhou, eastern Guangdong Province of China[J]. PLoS One, 2012, 7: e32149.
[11] Lin M, Yang L Y, Li L J, et al. Genital human papillomavirus screening by gene chip in Chinese women of Guangdong province[J]. Aust N Z J Obstet Gynaecol, 2008, 48(2): 189-194.
[12] Ho C M, Chien T Y, Huang S H, et al. Integrated human papillomavirus types 52 and 58 are infrequently found in cervical cancer, and high viral loads predict risk of cervical cancer[J]. Gynecol Oncol, 2006, 102(1): 54-60.
[13] Huang Y, Huang M N, Li N, et al. Association between human papillomavirus DNA load and development of cervical intraepithelial neoplasia and cervical cancer[J]. Int J Gynecol Cancer, 2008, 18(4): 755-760.
[14] van Duin M, Snijders P J, Schrijnemakers H F, et al. Human papillomavirus 16 load in normal and abnormal cervical scrapes: an indicator of CIN II/III and viral clearance[J]. Int J Cancer, 2002, 98(4): 590-595.
[15] Saunier M, Monnier-Benoit S, Mauny F, et al. Analysis of human papillomavirus type 16 (HPV16) DNA load and physical state for identification of HPV16-infected women with high-grade lesions or cervical carcinoma[J]. J Clin Microbiol, 2008, 46(11): 3678-3685.
[16] Constandinou-Williams C, Collins S I, Roberts S, et al. Is human papillomavirus viral load a clinically useful predictive marker? A longitudinal study[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(3): 832-837.
[17] Carcopino X, Bolger N, Henry M, et al. Evaluation of typespecific HPV persistence and high-risk HPV viral load quantitation in HPV positive women under 30 with normal cervical cytology[J]. J Med Virol, 2011, 83(4): 637-643.
[18] Schlecht N F, Trevisan A, Duarte-Franco E, et al. Viral load as a predictor of the risk of cervical intraepithelial neoplasia[J]. Int J Cancer, 2003, 103(4): 519-524.
[19] Zhang W, Xiao J, Ma C. Clearance of high-risk HPV infection in Chinese women with normal cervical cytology[J]. Int J Gynaecol Obstet, 2012, 118(1): 74-75.
[20] Li N, Yang L, Zhang K, et al. Multiple human papillomavirus infections among Chinese women with and without cervical abnormalities: a population-based multi-center crosssectional study[J]. Front Oncol, 2011, 1: 38.
The detection of HPV genotyping and viral load of eight high risk human papillomavirus in cervical lesions
ZHAO Ying1, LIN Min2, PAN Meichen1, YANG Li1, CAI Yingmu1★
(1.Shantou University Medical College, Guangdong, Shantou 515041, China; 2.Central Laboratory, Chaozhou Central Hospital, Guangdong, Chaozhou 521021, China)
Objective The aim of this study is to determine the prevalence and distribution of HPV infection with cervical neoplasia in Chaozhou area and evaluate the association between the viral load of eight high risk human papillomavirus and risk of cervical intraepithelial neoplasia (CIN) and cervical cancer. Methods 220 cases of abnormal liquid-based cytology women from Chaozhou central hospital were examinated with colposcopy and histopathological. Cervical specimens were tested for 21 HPV types using a MY09/MY11 L1 consensus primer PCR method with specif i c dot blot hybridization and viral load of eight high risk genotypes were tested by real-time PCR. Results Overall HPV infection prevalence was 87.3%(192/220) and HPV16 was the most prevalent genotype with a detection rate of 50.9% in our study. The detection rates of HPV and HPV16 raised with increasing of severity of cervical disease (P<0.05). HPV58, HPV33, HPV52, HPV31 and HPV18 were the fi ve most popular genotypes just less than HPV16 with detection rates of 22.73%, 11.82%, 11.36%, 5.9% and 4.54%, respectively. The viral load of high risk HPV was positive correlate with the severity of CIN and cervical cancer(r=0.373, P<0.001). Conclusion Although HPV52 and HPV58 were the advantage genotypes of HPV infection in Chaozhou region, HPV16 was the main genotype of HPV infection in women with cervical lesion in this area, and the most related to cervical cancer were HPV16 and HPV18. The viral load of eight high risk human papillomavirus was a potential auxiliary indicators of cervical cancer and precancerous.
High-risk human papillomavirus (HR-HPV); Cervical intraepithelial neoplasia (CIN); Real-time fl uorescence quantitative PCR (RT-PCR).
广东省自然科学基金(s212010009081)
1.汕头大学医学院,广东,汕头 515041 2.潮州市中心医院中心实验室,广东,潮州 521021
★通讯作者:蔡应木,E-mail:yingmu_cai@yahoo.com
