重组人丝氨酸蛋白酶抑制因子HespintorKazal结构域的原核表达、纯化及活性鉴定
2013-06-30冯洁伦永志李越武会娟李宝明魏玲张小莉王雪蕾迟庆
冯洁,伦永志,李越,武会娟,李宝明,魏玲,张小莉,王雪蕾,迟庆
1 大连大学医学院辽宁省高校生物物理学重点实验室,辽宁大连 116622
2 大连大学生命科学与技术学院,辽宁大连 116622
3 北京市理化分析测试中心,北京 100094
癌症病变过程中最重要的步骤是肿瘤细胞的浸润和转移,其关键取决于肿瘤细胞的某种分泌物能够水解细胞外基质(Extra cellular matrix,ECM)和基底膜(Basement membranem,BM)。肿瘤细胞先分泌尿激酶型纤溶酶原激活物(Urokinase-type plasminogen activator,uPA),此激活物为一种丝氨酸蛋白酶,可激活纤溶酶原产生纤溶酶(Plasmin,PLM);PLM 继而降解ECM,同时还能激活前基质金属蛋白酶成为基质金属蛋白酶,后者参与细胞外基质蛋白的水解作用;最终ECM 与BM 被水解,肿瘤细胞得以扩散[1]。因此,干预uPA 水平或功能可以达到治疗肿瘤的目的,其中尤以Kazal 型丝氨酸蛋白酶抑制因子抑制uPA 活性最为直接也最具有临床应用前景[2-4]。
本实验室利用SSH 技术研究HBV RT/DNA聚合酶反式调节靶基因,从肝母细胞瘤细胞系HepG2中筛选得到一未知功能新基因,经RT-PCR 验证及生物信息学方法确定该基因属于一种新的Kazal 型Serpin,命名为Hespintor
(GenBank Accession No.DQ438947)。Hespintor cDNA 全长为285个核苷酸,编码94个氨基酸。蛋白质序列分析表明,Hespintor 编码的94个氨基酸可分为3部分:N 端1~23个氨基酸残基为信号肽;第35~94个氨基酸含一个典型的Kazal结构域;N 端信号肽与Kazal 结构域间的24~34位氨基酸残基构成了连接区[5]。
pET-40b(+)原核表达载体具有2个显著特点:一是含有T7启动子,可被宿主细胞提供T7 RNA聚合酶识别,T7 RNA 聚合酶的转录效率比大肠杆菌RNA 聚合酶高5倍,能够高效转录mRNA,并大量表达融合蛋白;二是载体上携带Dsbc·Tag、His·Tag 和S·Tag,诱导表达的35 kDa 标签蛋白对目的蛋白的结构及生物学活性影响很小,特别是分别位于目的蛋白前后的His·Tag 为进一步纯化重组融合蛋白提供了最佳亲和位点,而且两者之间有凝血酶(Thrombin)及肠激酶(Enterokinase)酶切位点,便于纯化后将标签蛋白切除。
本研究将从 HepG2细胞中克隆得到的Hespintor Kazal 型结构域编码区亚克隆至原核表达载体pET-40b(+)中,采用IPTG 诱导带有融合标签蛋白的Hespintor-Kazal 重组蛋白的大量表达。经诱导条件的优化筛选,获得Hespintor-Kazal 重组融合蛋白的高效表达,再经Ni2+柱及Q 柱两步纯化及柱上复性,最终得到具有特异性抑制胰蛋白酶水解活性的纯化重组蛋白,为下一步的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 质粒及菌株
pMD 20-T/Hespintor cDNA 克隆载体、大肠杆菌 DH5α为本实验室保存;大肠杆菌Rosetta(DE3)、原核表达载体pET-40b(+)引自北京市理化分析测试中心;pMD 19-T Simple Vector 购自宝生物工程(大连)公司。
1.1.2 引物
根据 Hespintor 基因序列(GenBank Accession No.DQ438947),设计序列特异性的含有限制性核酸内切酶(BamH Ⅰ/Hind Ⅲ)酶切位点的引物F (5′-GGATCCGCCTAAGCCCCG-3′)、R (5′-GCGCAAGCTTATCACATTTTCCAT ATTTTTC-3′),由宝生物工程(大连)公司合成。
1.1.3 主要试剂
Restriction Enzyme Starter BOX、Permix Ex Taq Version 2.0、λ-Hind Ⅲ digest 、DL2000 DNA Marker 购自宝生物工程(大连)公司;PageRuler Prestained Protein Ladder 购自美国Fermentas 公司;鼠抗人His·Tag 单克隆抗体(一抗)购自科百奥公司;羊抗鼠HRP-IgG (二抗)购自中杉金桥公司;牛血清白蛋白(BSA)、胰蛋白酶(活性≥250 NF U/mg)购自美国Amresco 公司;Na-苯甲酰-DL-精氨酸-对硝基酰胺盐酸盐(BAPNA)购自美国Sigma 公司;Ni2+柱(Ni2+-Histrap FF crude 5 mL)、Q 柱(Histrap Q FF column 1 mL)购自美国GE Healthcare 公司;考马斯亮蓝G250购自索莱宝公司。
1.2 方法
1.2.1 pET-40b(+)/Hespintor-Kazal 原核表达载体的构建和鉴定
以pMD 20-T/Hespintor cDNA 克隆质粒为模板,PCR 扩增Hespintor Kazal 型结构域编码序列,3%琼脂糖凝胶电泳后,切胶纯化回收。将纯化的目的基因片段与 pMD 19-T Simple Vector 室温连接过夜,转化DH5α感受态细胞,碱裂解法提取质粒后测序鉴定,证明目的基因片段已正确插入T载体中;再用BamH Ⅰ/Hind Ⅲ从T 载体上酶切目的基因片段,3%琼脂糖凝胶电泳纯化回收,与经过同样酶切的pET-40b(+)原核表达载体连接,转化大肠杆菌 Rosetta(DE3),碱裂解法提取质粒后酶切鉴定。
1.2.2 Hespintor-Kazal 重组融合蛋白的诱导表达及条件优化
转化有 pET-40b(+)/Hespintor 的 Rosetta(DE3)菌株接种至 LB 液体培养基(氯霉素34µg/mL、卡那霉素10µg/mL)中,37℃振荡培养过夜,按比例扩大培养,选择不同诱导条件进行优化,分别观察诱导时间、IPTG 终浓度、诱导温度对目的蛋白表达量的影响,每个条件做3组平行。离心收集菌体,15% SDS-PAGE进行分析,确定最适诱导条件。
1.2.3 Hespintor-Kazal 重组融合蛋白的纯化复性与鉴定
利用Western blotting 确定重组蛋白的表达。将最适条件诱导获得的菌体(上清保留备用)超声破碎,用8 mol/L 尿素溶液溶解沉淀(即包涵体),离心后收集上清。用A 液(8 mol/L 尿素,0.5 mol/L NaCl,20mmol/L 咪唑;pH 8.0)平衡Ni2+柱,上清抽滤脱气后上柱,A 液继续冲洗,用B 液(0.5 mol/L NaCl,20 mmol/L 咪唑;pH 8.0)进行蛋白复性,梯度洗脱程序由0% B 至100%B,复性时间为150 min。该过程中将融合蛋白液从8 mol/L 尿素缓慢降至0 mol/L 尿素,变性的融合蛋白重新折叠形成具有生物活性的空间结构,即柱上复性,整个过程在低温环境下进行。尿素去除完全后用C 液(0.5 mol/L NaCl,500 mmol/L 咪唑;pH 8.0)进行洗脱,收集洗脱峰,15% SDS-PAGE 分析。用D 液(20 mmol/L Tris-HCl;pH 8.0)平衡Q 柱,将Ni2+柱纯化后的样品用D 液稀释后上样,用E 液(20 mmol/L Tris-HCl,1 mol/L NaCl;pH 8.0)进行梯度洗脱,收集洗脱峰,15% SDS-PAGE 分析。Bradford法测定重组蛋白浓度。
1.2.4 Hespintor-Kazal 重组融合蛋白的活性鉴定
参照文献[6-7]和Sigma 公司活性测定方法,进行部分改进:取8只5 mL 离心管分别编号,其中7只各加入40µg/mL 胰蛋白酶200µL,依次加入0、20、40、80、120、160、200µL 重组蛋白纯化液;余下的1只离心管中加入20µL 1 mmol/L HCl 作为空白对照,用Tris-HCl 均补至2 mL,37℃水浴10 min,8只管各加入1 mL 1 mmol/L BAPNA,37℃水浴5 min,加入1 mL 60%醋酸终止反应。595 nm 处检测OD 值。根据下列公式计算Hespintor-Kazal 重组融合蛋白的抑制率,绘制抑制曲线。
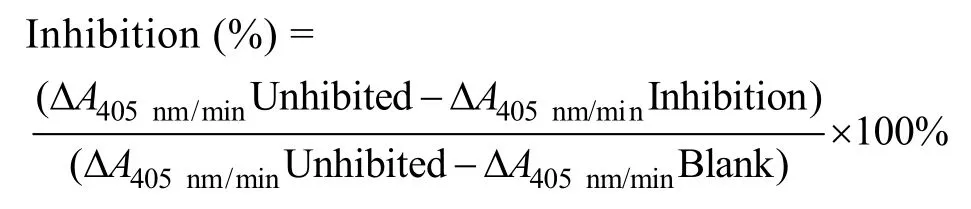
2 结果
2.1 Hespintor-Kazal 原核表达载体的构建
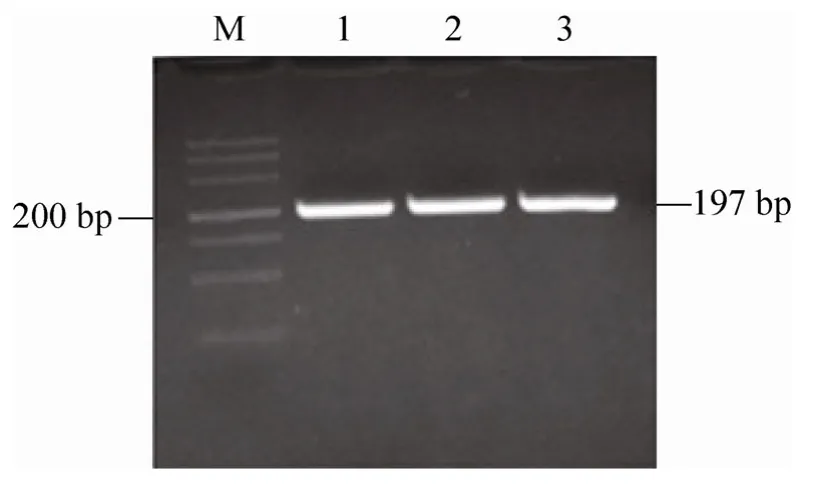
图1 Hespintor Kazal 结构域编码序列的PCR 产物Fig.1 PCR products of CDS of Hespintor Kazal domain.M:DL500 DNA marker;1–3:PCR products of Hespintor.
以pMD 20-T/Hespintor cDNA 克隆质粒为模板,利用PCR 方法扩增Hespintor Kazal 型结构域编码序列,产物经3%琼脂糖凝胶电泳检测,在197 bp 处附近可见扩增产物(图1),大小与预期相符。纯化后的PCR 产物与T 载体连接后经蓝白斑筛选和双酶切鉴定得到阳性重组子pMD 19-T Simple/Hespintor-Kazal,测序结果表明目的基因片段已正确插入至T 载体中。用BamH Ⅰ/Hind Ⅲ双酶切T 载体得到的目的基因片段连接至经过同样酶切的pET-40b(+),酶切鉴定结果表明重组原核表达载体 pET-40b(+)/Hespintor-Kazal 构建成功(图2)。
2.2 Hespintor-Kazal 重组融合蛋白表达条件的筛选
pET-40b(+)/Hespintor-Kazal 重组载体转化大肠杆菌Rosetta (DE3),经诱导表达后进行15%SDS-PAGE 分析,在相对分子量约42 kDa 处出现明显的蛋白条带,与预期相符。表达条件的筛选结果表明,诱导时间对Hespintor-Kazal 重组融合蛋白表达量无明显影响,但诱导5 h 的表达量相对较多;IPTG 浓度对重组蛋白表达量亦无明显影响,由于高浓度IPTG 对细菌有毒副作用,因此选择0.25 mmol/L 作为IPTG 诱导浓度;诱导温度只有在33℃时重组蛋白表达量较少,考虑到温度对菌体生长的影响,故选择30℃作为诱导温度(图3)。诱导产物离心后获得的上清和沉淀经15% SDS-PAGE 分析,结果证实Hespintor-Kazal 重组融合蛋白以包涵体形式存在于沉淀中(图4),约占菌体总蛋白量25.83%。进一步的Western blotting 检测表明,重组蛋白可与His 单克隆抗体发生特异性结合(图5)。
2.3 Hespintor-Kazal 重组融合蛋白的纯化复性与鉴定
将包涵体溶液进行组氨酸亲和层析,Hespintor-Kazal 重组融合蛋白经柱上复性后被洗脱,通过监控蛋白洗脱曲线,洗脱下来的目的蛋白出现明显的单一紫外吸收峰(图6A)。SDS-PAGE 结果显示经Ni2+柱纯化后的蛋白主要以两条条带迁移,尚有少量杂蛋白,故将亲和层析纯化产物再进行阴离子交换层析(图6B),经SDS-PAGE 检测,最终得到目的蛋白的单一特异性条带(图7)。经Bradford 法测定,纯化蛋白浓度为193.678µg/mL,即每升诱导表达菌液经超声破碎与Ni2+柱及Q 柱两步纯化后可获得0.77 mg Hespintor-Kazal 重组融合蛋白。
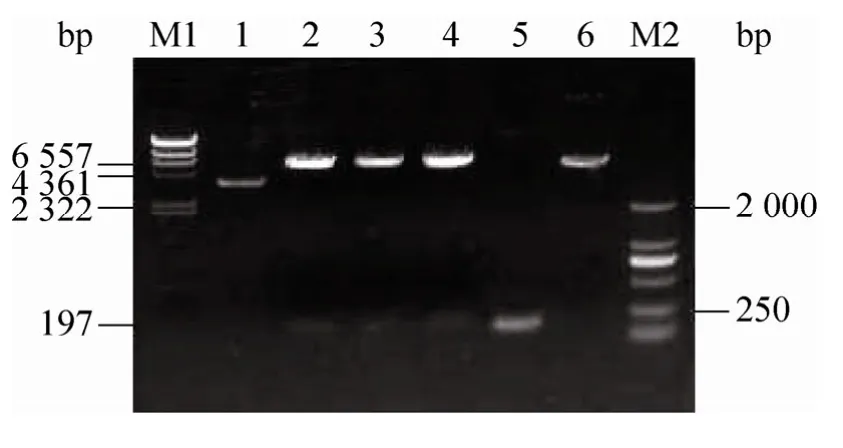
图2 重组原核表达载体 pET-40b(+)/Hespintor-Kazal 的酶切鉴定Fig.2 Identification of pET-40b(+)/Hespinto-Kazal by enzyme digestion.M1:λ-Hind Ⅲ digest;1:pET-40b(+)/Hespintor-Kazal;2–4:pET-40b(+)/Hespintor-Kazal digested with BamH Ⅰand Hind Ⅲ;5:PCR products of Hespintor-Kazal;6:pET-40b(+) digested with BamHⅠ and Hind Ⅲ;M2:DL2000 DNA marker.
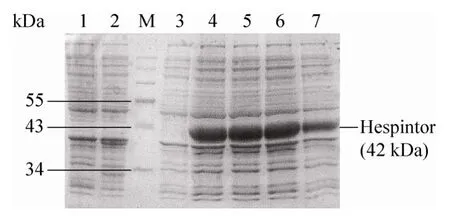
图3 诱导温度对Hespintor-Kazal 重组融合蛋白表达量的影响Fig.3 Effect of induced temperature on the expression of Hespintor recombinant protein.1:Rosetta (DE3)induced;2:Rosetta(DE3)/pET-40b(+) induced;M:PageRular prestained protein ladder;3:Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal non-induced;4–7:Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal induced with different temperature (24℃,27℃,30℃,33℃).

图4 诱导产物粗提取物的溶解性分析Fig.4 Solubility analysis of crude extracts from induced Rosetta(DE3).(A) M:PageRular prestained protein ladder;1:inclusion body of Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal;2:periplasm parts of Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal;3:supernatant of Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal.(B)1:Rosetta(DE3)/pET-40b(+)induced;2:Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal non-induced;3:inclusion body of Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal sloved in 8 mol/L urea;4:inclusion body of Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal.
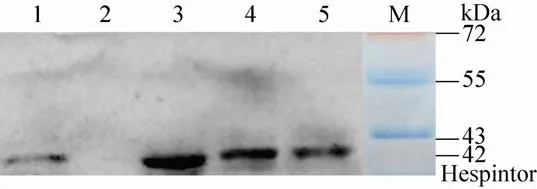
图5 Hespintor-Kazal 重组融合蛋白的 Western blotting 鉴定Fig.5 Identification of purified Hespintor recombinant protein by Western blotting.M:PageRular prestained protein ladder; 1:Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal non-induced; 2:Rosetta(DE3)/pET-40b(+) induced;3–5:Rosetta(DE3)/pET-40b(+)/Hespintor-Kazal induced with different IPTG concentration(0.25,0.50,0.75 mmol/L).
2.4 Hespintor-Kazal 重组融合蛋白的活性鉴定
胰蛋白酶(Trypsin)可水解BAPNA 生成无色的苯甲酰-L-精氨酸和淡茶色的对硝基苯胺,使溶液变成淡茶色。若在此系统中加入过量的胰蛋白酶抑制剂,抑制胰蛋白酶的水解活性,底物不能水解生成对硝基苯胺,溶液仍呈现无色。结果表明,随着蛋白浓度的上升,Hespintor-Kazal 重组融合蛋白对胰蛋白酶的抑制率也随之上升,当蛋白含量为38.74 mg/mL时,胰蛋白酶的抑制率达到91.57%。由此可见,Hespintor-Kazal 重组融合蛋白对胰蛋白酶具有较高的抑制作用,并且抑制曲线呈剂量依赖关系(图8)。
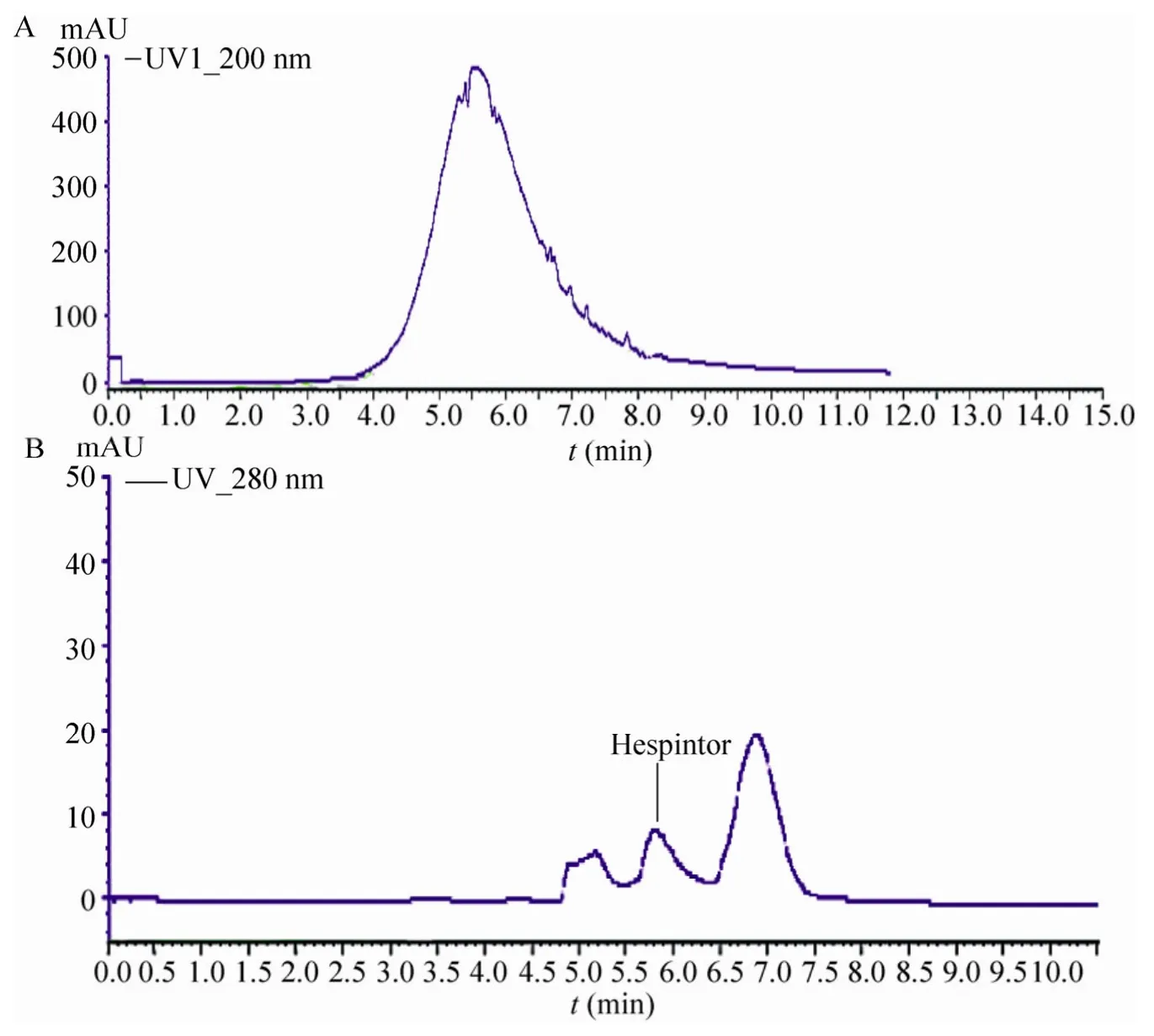
图6 Ni2+柱(A)和Q 柱(B)纯化Hespintor-Kazal 重组融合蛋白的洗脱曲线Fig.6 Elution curve of Hespintor recombinant protein from Ni2+ column(A) and Q column(B).
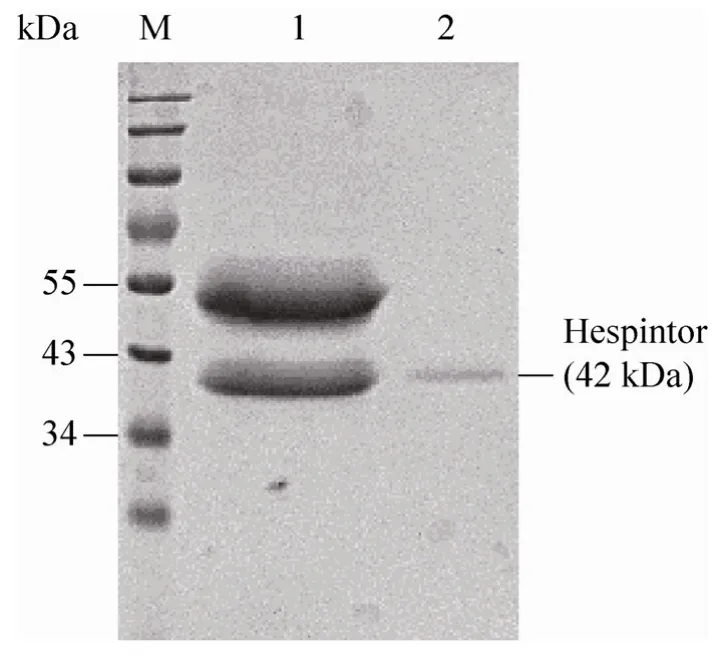
图7 Ni2+柱及Q 柱纯化Hespintor-Kazal 重组融合蛋白的SDS-PAGE 分析Fig.7 SDS-PAGE analysis of purified Hespintor recombinant protein from Ni2+ column and Q column.M:PageRuler prestained protein ladder;1:purified Hespintor recombinant protein from Ni2+ column;2:purified Hespintor recombinant protein from Q column.
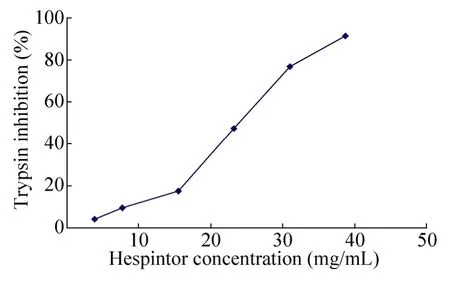
图8 纯化的Hespintor-Kazal 重组融合蛋白对胰蛋白酶活性的抑制作用Fig.8 Inhibitory activity of purified Hespintor recombinant protein on trypsin.
3 讨论
已有研究表明,肿瘤细胞产生的蛋白酶降解ECM 及基膜的能力与其侵袭、转移能力密切相关。蛋白酶的活性可由多个层次进行调控[8-10],但最直接的方法还是阻断蛋白酶活性。在此级联式反应中,uPA 发挥着关键性作用,被认为是肿瘤局部浸润和/或形成远处转移的限速步骤。尽管可在多个层次上调控蛋白酶活性,但最直接的方法还是阻断蛋白酶活性[9,11]。因此,干预uPA 水平或功能可成为治疗肿瘤的一种有效方法。
SERPIN (Serine proteinase inhibitor)是一类丝氨酸蛋白酶活性调节因子,根据它们的序列特征和三维结构,目前归类为18个非同源蛋白质家族,其中以Kazal 型SERPIN 抑制uPA活性最为直接也最具有临床应用前景[12-14]。Kazal 型SERPIN 属于较为保守的家族之一,其成员多为小分子多肽,其中某些成员具有抑制肿瘤细胞增殖和侵袭的活性,从而成为肿瘤治疗的新靶点[15-19]。蛋白质序列分析表明,Hespintor 具有与食管癌相关基因2(Esophageal cancer related gene 2,ECRG2)高度同源的serpin 基本结构。由于ECRG2具有抑制肿瘤细胞的增殖、侵袭及转移等作用,因此提示Hespintor 可能具有同样的抗肿瘤能力[11,20-22]。
本研究将Hespintor 连接至原核表达载体pET-40b(+)中,采用IPTG 诱导Hespintor-Kazal融合标签蛋白的大量表达。pET-40b(+)原核表达载体具有两个显著特点:一是含有T7启动子,可被宿主细胞提供T7 RNA 聚合酶识别,T7 RNA 聚合酶的转录效率比大肠杆菌RNA 聚合酶高5倍,能够高效转录mRNA,并大量表达融合蛋白;二是载体上携带Dsbc·Tag、His·Tag和S·Tag,诱导表达的35 kDa 标签蛋白对目的蛋白的结构及生物学活性影响很小,特别是分别位于目的蛋白前后的His·Tag 为进一步纯化蛋白提供了最佳亲和位点,而且两者之间有凝血酶(Thrombin)及肠激酶(Enterokinase)酶切位点,便于纯化后将标签蛋白切除[23–24]。诱导条件是影响外源蛋白表达的重要因素,诱导温度、诱导时间和IPTG 浓度是其中不可缺少的,由于三者之间有相互作用,应采用正交试验来进行优化。结果表明,诱导条件的变化对重组蛋白的表达量无太明显影响。本研究预实验发现,即使将IPTG 浓度降至0.1 mmol/L,进行16℃低温诱导,仍未有效增强重组蛋白的可溶性或提高其表达量。由于单因素实验结果差异甚微,因此仅采用最佳单因素条件进行重组蛋白的诱导表达。
在蛋白纯化复性过程中,首先采用Ni2+柱进行亲和层析,获得的洗脱曲线为单一峰;之后的SDS-PAGE 分析出现两条蛋白条带,重组蛋白为42 kDa 的蛋白条带,另一蛋白条带分子量约为50 kDa,在纯化前的电泳检测时并未出现。分析认为,该杂蛋白分子量与重组蛋白分子量不成倍数关系,并非重组蛋白的二聚体或多聚体,有可能是进行重组蛋白复性时重新折叠聚集的速度有时过快,导致某些蛋白碎片通过二硫键而随机聚集形成。SDS-PAGE 分析结果表明,Ni2+柱的上样流穿液中仍含有部分重组蛋白,说明Ni2+柱对重组蛋白His 标签的亲和力未达到饱和,或是重组蛋白本身结构限制了Ni2+柱对His 标签的亲和力[25-26]。根据上述分析,选择500 mmol/L 咪唑直接洗脱Ni2+柱而非梯度洗脱,以便于后继的蛋白纯化。由于预测重组蛋白的理论等电点pI 为7.12,所用缓冲液pH 8.0,故选择Q 柱进行阴离子交换层析,最终获得产物为单一条带的重组蛋白。
本文成功构建了Hespintor-Kazal 原核表达体系,并获得纯化的重组融合蛋白,之后初步证明其具有预期的生物学活性。下一步将重点围绕Hespintor-Kazal 重组融合蛋白的纯化复性工艺及其体内外抗肿瘤活性开展研究。
[1]Lun YZ,Feng J,Li XY,et al.Gene cloning and sequence analysis of human serine protease inhibitor Hespintor.Biotechnology,2013,23(1):1–4(in Chinese).伦永志,冯洁,李欣悦,等.人丝氨酸蛋白酶抑制因子Hespintor 的基因克隆与序列分析.生物技术,2013,23(1):1–4.
[2]Huang G,Hu Z,Li M,et al.ECRG2 inhibits cancer cell migration,invasion and metastasis through the down-regulation of uPA/plasmin activity.Carcinogenesis,2007,28(11):2274–2281.
[3]Bekes EM,Deryugina EI,Kupriyanova TA,et al.Activation of pro-uPA is critical for initial escape from the primary tumor and hematogenous dissemination of human carcinoma cells.Neoplasia,2011,13(9):806–821.
[4]Legrand C,Polette M,Tournier JM,et al.uPA/plasmin system-mediated MMP-9 activation is implicated in bronchial epithelial cell migration.Exp Cell Res,2001,264(2):326–336.
[5]Chi Q,Lun YZ.Kazal type human serine protease inhibitor research status.Chin J Clin:Electr Ed,2010,4(8):1331–1333(in Chinese).迟庆,伦永志.Kazal 型人类丝氨酸蛋白酶抑制抑制研究现状.中华临床医师杂志:电子版,2010,4(8):1331–1333.
[6]Quyang J,Wang JW,Yang XM,et al.Expression,purification and primary activity analysis of recombinant serine protease inhibitor rEa.J Chin Biot,2002,23(3):67–71(in Chinese).欧阳晶,王健伟,杨晓梅,等.丝氨酸蛋白酶抑制剂Ea 的表达纯化与活性分析.中国生物工程杂志,2002,23(3):67–71.
[7]Zhang SG,Zhang ZW,Zhang LF,et al.Cloning and prokaryotic expression of the serine protease inhibitor RCSPI2 from the skin of Chinese brown frogs,Rana chensinensis.Acta Hydro Sin,2010,34(3):629–633(in Chinese).张曙光,张哲文,张丽芳,等.中国林蛙皮肤丝氨酸蛋白酶抑制剂RCSPI2的基因克隆和原核表达.水生生物学报,2010,34(3):629–633.
[8]Aureli L,Gioia M,Cerbara I,et al.Structural bases for substrate and inhibitor recognition by matrix metalloproteinases.Curr Med Chem,2008,15(22):2192–2222.
[9]Fisher JF,Mobashery S.Mechanism-based profiling of MMPs.Methods Mol Biol,2010,622:471–487.
[10]Steverding D,Caffrey CR,Sajid M.Cysteine proteinase inhibitors as therapy for parasitic diseases:advances in inhibitor design.Mini Rev Med Chem,2006,6(9):1025–1032.
[11]Cheng XL,Lu SX,Gui YP.ECRG2 regulates ECM degradation and uPAR/FPRL1 pathway contributing cell invasion/migration.Cancer Lett,2010,290(1):87–95.
[12]Olson ST,Gettins PG.Regulation of proteases by protein inhibitors of the serpin superfamily.Prog Mol Biol Transl Sci,2011,99(1):185–240.
[13]Olson ST,Gettins PG.Regulation of proteases by protein inhibitors of the serpin superfamily.Prog Mol Biol Transl Sci,2011,99:185–240.
[14]Potempa J,Korzus E,Travis J.The serpin superfamily of proteinase inhibitors:structure,function,and regulation.J Biol Chem,1994,269(23):15957–15960.
[15]Pantoja-Uceda D,Arolas JL,Aviles FX,et al.Deciphering the structural basis that guides the oxidative folding of leech-derived tryptase inhibitor.J Biol Chem,2009,284(51):35612–35620.
[16]Wendy WeiJia Soon,Lance David Miller,Michael A Black,et al.Combined genomic and phenotype screening reveals secretory factor SPINK1 as an invasion and survival factor associated with patient prognosis in breast cancer.EMBO Mol Med,2011,3(8):451–464.
[17]Shigemasa K,Gu LJ,Tanimoto H,et al.Human kallikrein gene 11(klk11) mRNA overexpression is associated with poor prognosis in patients with epithelial ovarian cancer.Clin Cancer Res,2004,10(8):2766–2700.
[18]Horiguchi A,Sumitomo M,Asakuma J,et al.C 3-hydroxy-3-methylglutaryl coenzyme a reductase inhibitor,fluvastatin,as a novel agent for prophylaxis of renal cancer metastasis.Clin Cancer Res,2004,10(24):8648–8655.
[19]Cao D,Zhang Q,Wu LS,et al.Prognostic significance of maspin in pancreatic ductal adenocarcinoma:tissue microarray analysis of 223 surgically resected cases.Mod Pathol,2007,20(5):570–578.
[20]Cui Y,Bi M,Su T,et al.Molecular cloning and characterization of a novel esophageal cancer related gene.Int J Oncol,2010,37(6):1521–1528.
[21]Cheng X,Shen Z,Yin L,et al.ECRG2 regulates cell migration/invasion through urokinase-type plasmin activator receptor (uPAR)/beta1 integrin pathway.J Biol Chem,2009,284(45):30897–30906.
[22]Song H,Song C,Wang H,et al.Suppression of hepatocarcinoma model in vitro and in vivo by ECRG2 delivery using adenoviral vector.Cancer Gene Ther,2012,19(12):875–879.
[23]Liu ZQ,Yang PC.Construction of pET-32a(+)vector for protein expression and purification.N Am J Med Sci,2012,4(12):651–655.
[24]Meng E,Cai TF,Li WY,et al.Functional expression of spider neurotoxic peptide huwentoxin-I in E.coli.PLoS ONE,2011,6(6):e21608.
[25]Jin Q,Yang LX,Jiao HM,et al.Purification,gene cloning and expression of an acidic phospholipase A2 from Agkistrodon shedaoensis Zhao.Acta Biochim Biophys Sin,2004,36(1):27–32.
[26]Li J,Wu R,Chen H,et al.The Cloning and Characterization of the Enolase2 gene of Gekko japonicus and its polyclonal antibody preparation.Int J Mol Sci,2013,14(5):8787–8800.
