真菌诱导子在发酵工业中的应用现状及展望
2013-06-30古绍彬龚慧杨彬卜美玲
古绍彬,龚慧,杨彬,卜美玲
河南科技大学食品与生物工程学院,河南洛阳 471023
1968年,Cruickshank 等对真菌诱导子进行了首次报道,他们从丛梗孢菌中分离得到了第一种真菌诱导子Monilicolin A,并发现其可诱导菜豆内果皮形成和菜豆素积累[1]。随后,真菌诱导子在植物与真菌相互作用的病理学机制的研究受到了广泛关注。近年来利用真菌诱导子在提高药用植物培养物中天然产物的产率,促进微生物次级代谢产物的积累等方面研究取得了可喜的进展。
1 真菌诱导子在植物细胞次生代谢产物中的应用
采用植物细胞培养技术生产次生代谢产物,是保护濒危药用植物资源,解决药用植物资源日益短缺最有效的途径。在植物细胞培养中,通过添加诱导子可显著促进细胞生长、大量促使次生代谢产物,尤其是在萜类、生物碱类、皂苷类、黄酮类、多酚类等化合物的生物合成。表1给出了近年来各种真菌诱导子在植物细胞生产次级代谢产物中的应用情况。
1.1 在萜类化合物生物合成中的应用
紫杉醇(Taxol)是一类重要萜类化合物,能有效地治疗晚期卵巢癌、乳腺癌及非小细胞肺癌等。张长平等[2]在南方红豆杉细胞悬浮培养中,加入尖孢镰刀菌Fusarium oxysporum 诱导子,短期内激发细胞的防御性反应,培养基发生碱化,苯丙氨酸酶(PAL)活力显著提高,紫杉醇合成明显加强。Li 等[3]利用美丽镰刀菌 Fusarium mairei 浓缩培养液(去菌丝)处理东北红豆杉悬浮细胞,同样观察到培养基碱化、PAL 激活现象,紫杉醇含量达到了25.63 mg/L。而Khosroushahi等[4]却发现采用分阶段培养和混合诱导的方式可大幅度提高紫杉醇的含量,在红豆杉悬浮细胞生长阶段结束后向培养基中加入茉莉酸、水杨酸及根霉Rhizopus stolonifer 诱导子,可使产量达到了39.5 mg/L。Xu 等[5]发现,由桔青霉Penicillium citrinum 细胞壁制备的诱导子可诱导红豆杉悬浮细胞通过NOS 产生NO,NO 作为信号分子活化PAL 并触发紫杉醇生物合成。
1.2 在生物碱生物合成中的应用
喜树碱和长春碱是一类重要植物抗癌药物,通常从天然植物中获取,但含量极低,近年来利用诱导子诱导生物碱的合成备受关注。潘学武等[6]发现由米根霉Rhizopus oryzae 制备的诱导子,可显著提高喜树碱的生物合能力,当诱导子浓度达到30 mg/L 时,喜树碱总产量最高达到14.1 mg/L。Eilert 等[7]利用瓜果腐霉Pythium apbanidermatum 和深红酵母Rhodotorula rubs 菌体匀浆液处理长春花悬浮细胞,发现诱导子加入12 h 后生物碱含量急剧增加,其中瓜果腐霉诱导子可显著提高色氨酸脱羧酶和异胡豆苷合成酶的活性;5%瓜果腐霉诱导子处理18 h,异胡豆苷内酰胺、阿马碱和长春碱产量分别达到27、10和13μg/g。Namdeo 等[8]在长春花细胞悬浮培养中,加入黑曲霉 Aspergillus niger、镰刀霉Fusarium moniliforme 和绿色木霉Trichoderma viride 细胞壁水解物,发现阿玛碱的量提高了3倍。张向飞等[9]利用镰刀菌Fusarium solani 和黑曲霉Aspergillus niger 的匀浆液对长春花愈伤组织进行诱导处理,结果显示两种真菌诱导子对吲哚总碱及阿玛碱和长春碱的积累均有明显的正向调节作用,其中黑曲霉诱导子使阿玛碱含量增加了1.6倍,镰刀菌诱导子使长春碱含量提高了近3倍。Zhao 等[10]分别用12种真菌菌体
匀浆液刺激长春花细胞,发现不同来源的诱导子可引起长春花细胞内不同类型吲哚生物碱的积累。Tang 等[11]最近报道利用长春花内生真菌尖孢镰刀菌Fusarium oxysporum 菌体制备的诱导子使悬浮培养的长春花细胞总生物碱含量达到了693.76μg/g 的最高水平。
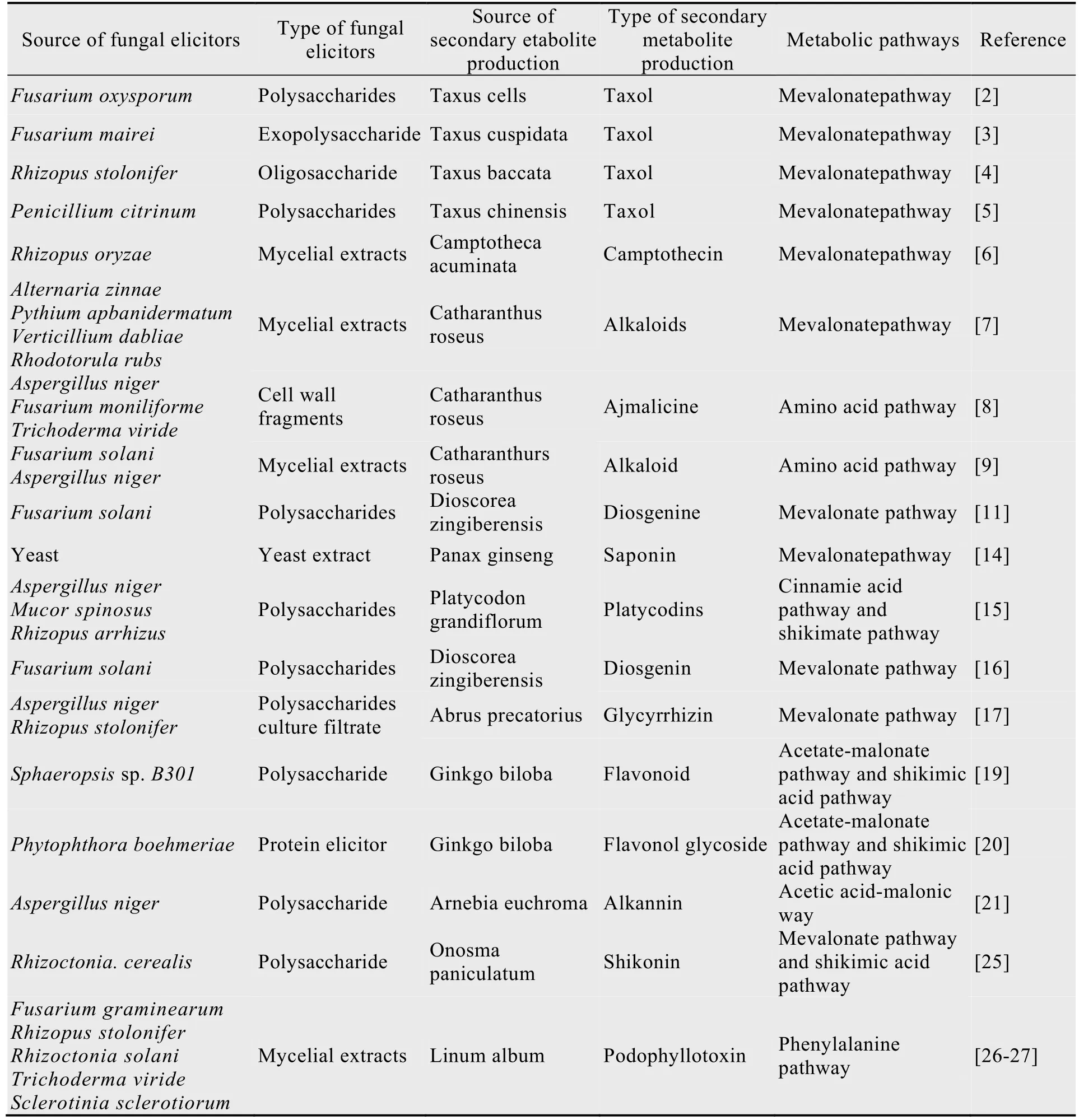
表1 近年真菌诱导子在植物细胞生产次级代谢产物生物合成中的应用Table 1 Application of fungal elicitors in secondary metabolites produced by plant cells in recent years
1.3 在三苷皂甙、甾体皂苷生物合成中的应用
三萜皂甙、甾体皂苷(Saponin)是苷元为三萜或螺旋甾烷类化合物的一类糖苷,具有抗菌、解热、镇静、抗癌等功效,利用悬浮细胞培养技术生产皂甙的研究已有不少报道。早在1992年,方绮民等[12]就利用7种真菌菌丝体匀浆作为诱导子,添加到悬浮培养的西洋参中,发现除烟曲霉诱导子外其他6种真菌诱导子均能促进西洋参细胞皂甙的合成,且尤以葡枝根霉菌最明显,该诱导子作用下皂甙含量增加了2倍。刘长军等[13]利用刺盘抱菌Colletotrichum nicoltianae 菌丝体诱导子处理西洋参细胞后总皂甙增加到679 mg/L,且85%的皂甙排到培养液中。Lu等[14]将酵母提取物添加到西洋参悬浮细胞中,当添加浓度达到3 g/L 时,皂甙总含量提高了20倍。赵俊云等[15]用刺囊毛霉Mucor spinosus 菌丝体制备的诱导子处理桔梗悬浮细胞,发现胞内总皂甙含量提高了1.5倍。刘娟等[16]将镰刀菌Fusarium solani 菌体制备的诱导子添加到盾叶薯蓣培养物中,结果薯蓣皂素的含量提高了2倍。而Karwasara[17]等分别将黑曲霉Aspergillus niger 和根霉Rhizopus stolonifer 的培养液(除菌体)加入到相思子Abrus precatorius 培养物中,结果甘草皂苷含量分别提高了4.9倍和3.8倍,而用菌丝体制备的诱导子却对皂苷的含量几乎没有影响。
1.4 在黄酮类化合物生物合成中的应用
黄酮类化合物(Flavonoids)是一类含有2-苯基色原酮结构的化合物,具有抗氧化、抗衰老、抗癌、调节内分泌系统、调节心血管、抗炎、抗过敏、抗病毒等多种生物活性。Park 等[18]发现在野葛Pueraria lobata 悬浮细胞培养中用酵母提取物处理时,在24 h 内能观察到异黄酮类化合物含量的显著升高。Hao 等[19]用真菌Sphaeropsis sp.B301制备的诱导子处理悬浮培养的银杏细胞,发现胞内ABA 含量和PAL 活性显著增加,银杏黄酮的含量成倍提高。Xu 等[20]发现真菌诱导子还可通过茉莉酸(JA)介导的植物防疫系统来促进银杏细胞黄酮类化合物的积累。杨世海等[21]在甘草愈伤组织中加入适量的黑曲霉诱导子,使黄酮类化合物含量达到了149.58μg/g,而0.1%的酵母提取物可使培养物中甘草查尔酮含量提高7.5倍。
1.5 在紫草素及衍生物生物合成中的应用
紫草素及其衍生物是来源于紫草,具有抗炎、抗病毒、抗肿瘤等功效的一类化合物。宁文等[22]将一种曲霉属真菌诱导子加入到悬浮培养的滇紫草Onosma paniculatum 中,发现紫草素含量增加了2倍。刘长军等[23]分别用刺盘孢菌Colletotrichum nicotianae、尖孢镰刀菌Fusarium oxysporum、黑曲霉 Aspergillus niger、米曲霉Aspergillus oxyzae 菌体制备的诱导子处理新疆紫草Arnebia euchroma 细胞,发现4种诱导子均能提高紫草素含量,其中黑曲霉诱导子效果最为明显,加入该诱导子6 h 后,紫草细胞内PAL活性明显增强,培养液中紫草素含量也随之增加,48 h 后达到84.8 mg/L;Yazaki 等研究发现PAL 活性与紫草素积累呈正相关。而傅旭庆等[24]同时用黑曲霉 Aspergillus niger 和米根霉Rhizopus oryzae 菌粉制备的诱导子处理新疆紫草悬浮细胞时,紫草素的产量达到了245.68 mg/L。Wu 等[25]研究发现真菌诱导子可影响紫草胞内NO 分子的合成,后者进一步上调紫草素生物合成途径中的PAL、PGT 和HMGR 的表达,从而促进紫草素的大量积累。
1.6 在鬼臼毒素生物合成中的应用
鬼臼毒素是从小蘖科鬼臼属植物中提取的一种复杂的多酚类抗肿瘤成分。Esmaeilzadeh等[26]分别用禾谷镰刀菌Fusarium graminearum、匍茎根霉菌 Rhizopus stolonifer、立枯丝核菌Rhizoctonia solani、绿色木霉Trichoderma viride、核盘菌Sclerotinia sclerotiorum 菌丝体制备的真菌诱导子处理短柄野芝麻Lamium album 细胞,结果发现5种真菌诱导子均能促进胞内鬼臼毒素的合成,其中禾谷镰刀菌诱导子使鬼臼毒素产量提高了7倍还多,产量达到140μg/g 细胞干重。进一步研究发现真菌诱导子可能通过上调与木酚素生物合成途径相关的基因,如落叶松树脂醇还原酶(PLR),肉桂酰辅酶A 还原酶(CCR),肉桂醇脱氢酶(CAD)和PAL 等的表达促进鬼臼毒素的大量合成[27]。
2 真菌诱导子在微生物发酵生产次级代谢产物中的应用
目前利用真菌诱导子处理植物细胞培养物,大量合成次级代谢产物的报道较多,而利用其诱导微生物积累次生代谢方面的研究却相对较少。随着细菌和真菌基因组研究的深入,人们发现通过某些小分子的刺激可激活胞内一些沉默途径(Silent pathways),尤其是一些次级代谢产物合成的基因簇,从而获得比传统发酵更多的代谢产物[28]。因此,近年来有研究者在利用真菌诱导子诱导微生物生产次级代谢产物方面进行了大胆尝试,并在类胡萝卜素、海洋生物碱、灵芝多糖和灵芝酸、Monacolin K 和DMA 等方面取得了许多可喜成果。
2.1 在色素生物合成中的应用
类胡萝卜素是一类重要的天然色素,具有良好的抗突变、抗癌、防衰老、防辐射等功效。2002年,Han 等[29]研究了6种真菌诱导子对青霉PT95(Penicillium sp.PT95)菌核生物量和类胡萝卜素产率的影响,发现它们均能使菌核生物量、类胡萝卜素含量大幅增加,其中深红酵母诱导子使每100 g 玉米粉中菌核产量达到了15.90 g,紫红曲霉诱导子使PT95类胡萝卜素和β-胡萝卜素产量分别提高了2.76和2.72倍。Wang 等[30]报道了6种不同真菌诱导子对法夫酵母Xanthophyllomyces dendrorhous 产类胡萝卜素和虾青素的影响,发现30 mg/L 的高大毛霉Mucor mucedo 诱导子可使胞内总类胡萝卜素含量提高78.87%,30 mg/L 粘红酵母Rhodotorula glutinis诱导子可使虾青素含量提高90.60%;而相同浓度的深红酵母Rhodotorula rubra 诱导子却可同时使胡萝卜素和虾青素分别提高42.24%和69.02%。2008年,汪文俊等[31]报道了贝壳状革耳菌 Panus conchatus、杂色云芝 Coriolus versicolor 制备的诱导子对红法夫酵母 Phaffia rhodozyma 菌体生长、总类胡萝卜素合成有显著促进作用,当添加诱导子浓度分别为30 mg/L 和10 mg/L 时,总类胡萝卜素产量分别比对照提高了47.3%和26.2%;进一步研究中发现在添加诱导子后胞内活性氧(ROS)含量显著增加,而ROS可能进一步激活了虾青素生物合成途径中相关酶或基因表达。
核丛青霉素是由 Michael 等从菌核青霉Penicillium sclerotiorum 分离获得的一种新真菌色素,具有内皮素受体结合能力,真菌类厚壁孢子细胞诱导活性,胆固醇酯转运蛋白活性抑制作用,以及对脂肪酶和磷脂酶A2等具有抑制作用。Raina 等[32]将培养48 h 的菌核青霉IMI104602培养液乙酸提取物加入到该菌发酵液中,168 h时核丛青霉素产量达到8.5 mg/L。而将该提取物加入到另一株菌核青霉IMI040574时,核丛青霉素含量提高6.4倍。进一步研究发现该提取物中multicolic acid 通过作用于菌体的群体感应系统,并引起相关基因表达,从而刺激了次级代谢产物核丛青霉素的大量积累。为此,Raina 提出了利用微生物与自身间,或与其他微生物间和环境间的通讯实现对生物活性成分的大量积累以提高发酵水平的一种新策略[33]。
2.2 在灵芝三萜和灵芝多糖合成中的应用
灵芝三萜具有解毒、抑肿瘤等活性,是一种难以人工合成的活性物质。Zhu 等[34]以尖孢镰刀菌 Fusarium oxysporum、黑曲霉 Aspergillus niger 、桔青霉Penicillium citrinum 和酿酒酵母菌Saccharomyces cerevisiae 四种真菌菌丝体为材料,制备了含蛋白、脂类和多糖,含蛋白和多糖,以及只含多糖的诱导子,然后用其处理深层培养的灵芝,发现由夏块菌制备的含蛋白、多糖和脂类,以及只含多糖的诱导子可显著提高灵芝胞外多糖产量;由中国块菌制备的同时含多糖和蛋白的诱导子可极大提高灵芝胞内多糖含量,且使产量达到了(1.94±0.18) g/L;而黑孢块菌制备的含蛋白和多糖的诱导子可促进灵芝三萜合成,但由该菌制备的仅含多糖的诱导子却抑制该产物的产生;不过从桔青霉中分离出来的多糖却能明显促进灵芝三萜的大量积累,且最高产量可达(315.5±12.4) mg/L。高兴喜等[35]研究木素木霉Trichoderma viride、蘑菇轮枝孢 Verticillium psalliotae 和顶头孢霉Acrrmonium strictum 诱导子对灵芝多糖和三萜类物质积累的影响,发现诱导子种类、浓度和添加时间对灵芝多糖和三萜类物质的产量均有影响,当发酵初期或中期加入120μg/mL 顶头孢诱导子时,灵芝多糖和三萜类物质的积累最高。
2.3 在Monacolin K 和DMA 合成中的应用
Monacolin K,也称洛伐他汀,是红曲中的重要活性物质,具有健脾消食、活血化淤等功效。Sun 等[36]将花溪掷孢酵母 Sporobolomyces huaxiensis 培养液(除菌体)加入处于对数期的紫红曲霉发酵液中,结果在诱导加入第4天获得最高Monacolin K 的产量,达446.92 mg/mL。刘爱英等[37]将一种担子菌的无性型液体发酵物Hxa加入到紫色红曲霉Monascus purpureus ZZ 固态发酵及液态培养基中,结果使该菌Monacolin K含量分别达到了达34.99 mg/g 和1330.4μg/mL。邹晓等[38]利用白黑粉菌Ustilago esculenta Henn与紫红曲霉Monascus perpureuss Went 共同培养,在培养到第8天洛伐他汀产量提高了203%。
D M A ,也称去乙酰真菌环氧乙酯(Deacetylmycoepoxydiene),是由黄耀坚教授课题组在红树林内生真菌拟茎点霉Phomopsis sp.A123中分离出的一种新的次级代谢产物,具有较好的抗肿瘤活性。该课题组研究了枯草芽胞杆菌Bacillus subtilis CMCC(B)63501、白色假丝酵母菌Candida albicans AS2.538、黑曲霉Aspergillus niger 和糖单胞菌Saccharomonspora sp.细胞壁提取物对DMA合成的影响,结果发现白色假丝酵母提取物能显著提高去乙酰真菌环氧乙酯的产量,推测该诱导子作为异己成分被139菌膜上的受体识别,激发了菌株的自我防御机制,导致代谢物DAM 增加[39]。
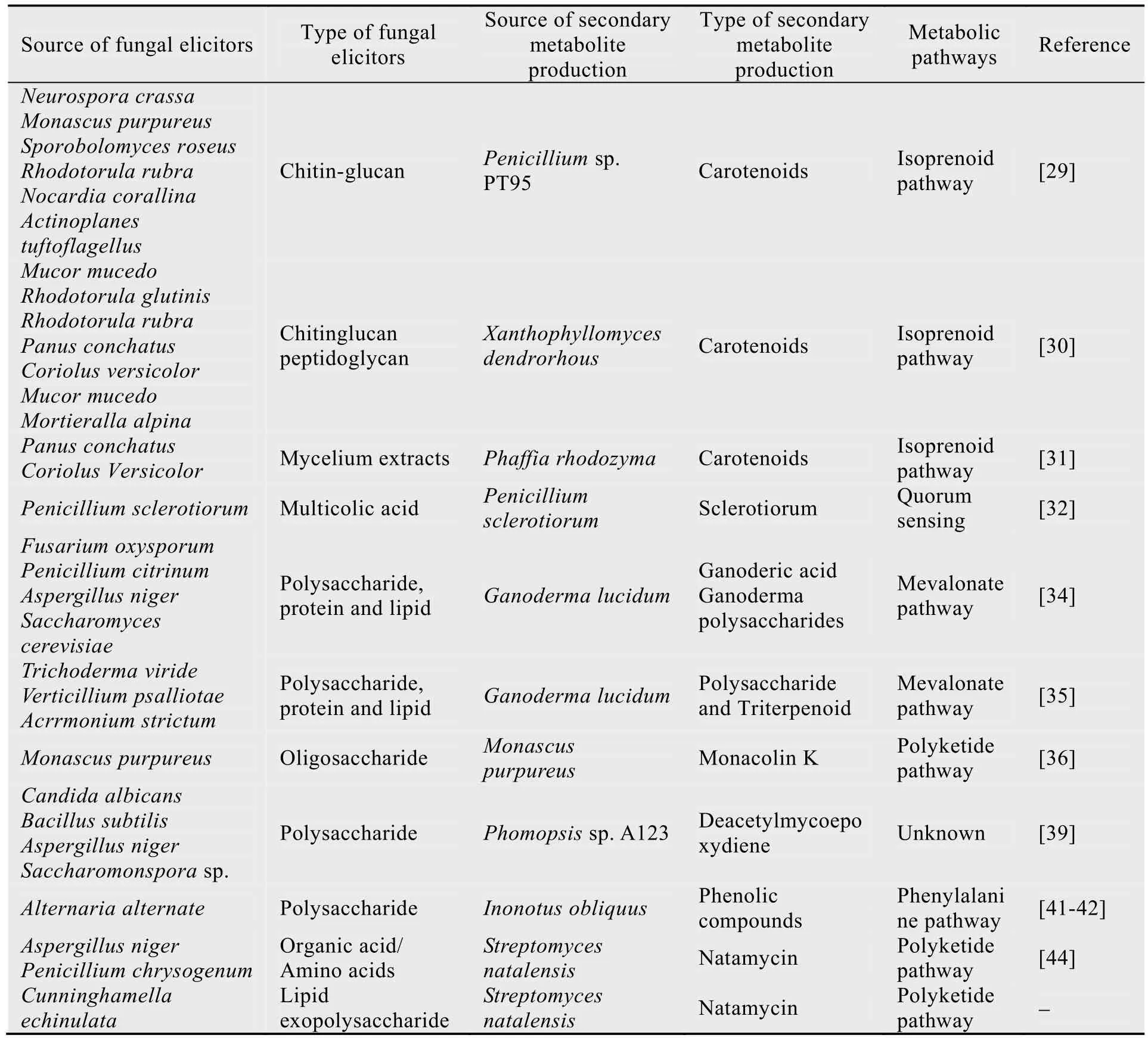
表2 近年真菌诱导子在微生物发酵生产次级代谢产物中的应用Table 2 Application of fungal elicitors in secondary metabolites produced by microbial fermentation in recent years
2.4 在桦褐孔菌多酚中的应用
桦褐孔菌是一种能够治疗多种疾病的药用真菌,其中酚类化合物被认为是治疗和预防氧化胁迫诱导的糖尿病、高血压、癌症及老年痴呆症的有效成分。郑维发等[40]利用斑孔木层孔菌Phellinus punctatus 与桦褐孔菌Inonotus obliquus共培养,结果发现在菌体生物量下降的情况下多酚复合物的积累却明显增加。赵艳霞等[41-42]用链孢霉Alternaria alternate (Fr.) Keissler 制备的真菌多糖对深层培养的桦褐孔菌进行处理,发现真菌诱导子可显著提高桦褐孔菌菌丝体多酚含量,当诱导子添加量为45μg/mL 时,桦褐孔菌菌丝体多酚的积累量达到46.5 mg/g。进一步研究证实该真菌诱导子可能通过作用于NO 信号分子而影响桦褐孔菌多酚的形成,而NO 分子在介导桦褐孔菌多酚生物合成途径中发挥着重要作用[43]。
2.5 在纳他霉素中的应用
纳他霉素(Natamycin)是一种高效、广谱的大环内酯类抗真菌抗生素。江南大学史强[44]研究发现黑曲霉 Aspergillus niger 和产黄青霉Penicillium chrysogenum 的培养液(除菌体)能显著促进纳塔尔链霉菌Streptomyces natalensis 产生纳他霉素,并初步确定该诱导子可能为有机酸或氨基酸类小分子化合物。本实验室也发现产黄青霉诱导子能显著提高纳他霉素产量,在纳他霉素发酵的第24 h 时加入,产量可提高近2倍。此外还观察到产γ-亚麻酸的刺孢小克银汉霉Cunninghamella echinulata 发酵液能诱导纳他霉素的合成,使Natamycin 产量比对照提高了近1倍,推测刺孢小克银汉霉发酵液的短链脂肪酸、乙酰辅酶A 等,可能参与了纳他霉素合成的代谢调控,从而缩短了生物合成周期,提高了产量。
3 真菌诱导子诱导植物和微生物细胞合成次生代谢产物的作用机理
3.1 诱导子对植物细胞培养中次生代谢物合成的调控机制
现有研究证实,诱导子在植物细胞培养中首先被细胞膜表面受体识别,然后通过信号传导途径完成信号的跨膜传递,并引起基因表达发生变化,从而调节植物次生代谢产物合成途径中相关酶活性,促进特定次生代谢产物的生成和积累。
3.1.1 信号识别
通常情况下,真菌诱导子首先与植物细胞质膜上特定的受体结合,然后再专一、快速地诱导特定基因表达,从而促进次生代谢产物合成。目前人们对β-葡聚糖的结合蛋白研究较为深入,1983年Yoshkawa[45]首先证实了大豆原生质膜上有诱导子受体的存在,随后Schmidt 等[46]发现3H标记的来自大豆疫霉菌的β-葡聚糖与大豆细胞膜制备物具有不同程度的亲合力,这种亲合力具有饱和性和可逆性,诱导子活性较高的3H 葡聚糖与膜的亲合力也大。目前,人们已经发现了多种存在于植物细胞膜上的真菌诱导子的亲和受体蛋白,如在烟草和番茄的细胞膜上存在的受体蛋白,它们能与真菌诱导子结合并诱导木聚糖酶的活性,欧芹Petroselinum crispum Mill1细胞质膜上也存在大豆疫霉菌诱导子活性成分的结合位点。此外诱导子本身的结构形式也影响受体的识别,Vargas 等[47]发现蛋白类真菌诱导子Sm1和Ep11的寡聚体可以被玉米细胞表面受体识别,但它们的二聚体却不能被细胞识别并激发后续的防御反应。
3.1.2 信号跨膜传递
诱导子与细胞膜上的受体蛋白识别结合后,可引起离子通道的开启或关闭,蛋白磷酸化,或G-蛋白偶联等,并进一步激活第二信使系统实现信号的跨膜传递。
众多研究证实,Ca2+和H+的内流以及Cl-和K+外流是诱导子作用下植物细胞共有的现象。Salzer 等[48]报道黑挪威云杉Picea abies L 悬浮细胞经真菌诱导子处理后,会快速引起Cl-和K+外流,以及Ca2+内流和培养基碱化等。张长平等[2]用尖孢镰刀菌诱导子对红豆杉细胞进行诱导,也发现细胞膜上的Ca2+、H+内流和Cl-、K+外流现象。Blume 等[49]用大雄疫霉糖蛋白处理欧芹细胞,观察到胞质Ca2+释放和大量Ca2+内流。Zhao 等[10]用真菌诱导子处理长春花细胞时,观察到钙的释放,以及由此而引起ROS 的产生。
有研究表明蛋白质磷酸化过程也参与了诱导子与植物细胞间的信号传递,Menke 等[50]发现酵母诱导子处理长春花细胞时,诱导子可促进茉莉酸的合成和色氨酸脱羧酶和异胡豆苷合成酶基因(tdc 和str)的表达,而蛋白激酶抑制剂K-252a 可完全阻断由诱导子引起的起茉莉酸的合成和 tdc 和 str 的表达。Suruki 等[51]利用P.infestan 细胞壁制成的诱导子处理烟草细胞,发现诱导子可快速激活MBP 激酶并进一步引起MBP 蛋白的磷酸化。Peck 等[52]采用双向电泳技术和质谱分析技术发现真菌诱导子处理拟南芥细胞数分钟后就能观察到细胞中的磷酸化过程。Dietrich 等[53]在利用大豆疫霉 Phytophthora megasperma f.sp.glycinea 诱导子处理欧芹时,发现仅处理1 min 后就能在细胞质和微粒体中检测到45 kDa 的蛋白质的磷酸化。
植物细胞内的GTP 结合蛋白在负责将质膜表面受体和质膜内侧的效应器偶联中发挥着重要的作用。Zhao 等[54]在柏木Cupressus lusitanica细胞培养中加入酵母诱导子,发现Ca2+和G 蛋白介导了酵母诱导子的信号途径,G 蛋白所有的抑制剂对诱导子诱导的脂氧化酶的活性起抑制作用,而G 蛋白激活剂则可增强脂氧化酶的活性,最终使植物抗毒素扁柏醇的产量提高。另外,植物小G 蛋白可能也是植物防御途径中重要的一员,结合在膜上的小G 蛋白首先活化磷酸脂酶,并进一步引起ROS 的释放,ROS 可通过脂氧合酶途径合成茉莉酸等小分子进而激活和调控下游相关防御基因的表达,促进次生代谢产物合成。
此外,NO 也可能参与了刺激信号从细胞表面传递到核内,诱发细胞产生相应生理生化效应并促进次级代谢产物生成。Xu 等[4]研究发现NO是参与红豆杉细胞次生代谢产物合成调控的一种新的信号分子,它可依赖JA、ROS 等信号途径触发植物细胞次生代谢产物的合成,且NO 和JA 信号分子之间存在着特殊的自催化协同放大效应。Wu 等[25]也证 NO 在介导禾谷丝核菌Rhizoctonia cerealis 诱导子诱导实滇紫草Onosma paniculatum 合成紫草素中发挥着重要作用,NO 淬灭剂L-NNA 可有效抑制真菌诱导子对NO 迸发的诱发作用,还可阻断诱导子对滇紫草细胞中紫草素合成的促进作用。
3.1.3 跨膜信号介导的胞内应答
诱导子的刺激信号,经跨膜传递并产生了包括Ca2+、ROS 和植物激素等在内的胞内第二信使,在这些信号作用下,通过调节细胞次生代谢产物合成途径中相关酶的基因表达,改变酶活性,从而提高次生代谢产物的产量。Zhao 等[55]发现酵母诱导子通过第二信使IP3,促使Ca2+通道的打开,使磷脂酶C 的活性增强,从而激活多聚磷酸肌糖的生物合成途径,提高鼠尾草抗毒素的产量。Menke 等[50]则发现酵母诱导子通过蛋白激酶的影响控制JA 合成,而后者又调控着tdc 和str 的表达,从而影响长春花细胞生物碱的合成;而Zhao 等[56]证实黑曲霉诱导子通过作用于长春花细胞钙离子的内流和钙依赖的信号传递途径,影响植物细胞的氧化猝发,而氧化猝发和H2O2的产生与吲哚生物碱的合成密切相关。Szabo 等[57]利用腐病菌诱导子处理彩叶草细胞时发现,诱导子通过作用于JA 合成途径来提高4-香豆酸:辅酶A 连接酶(4CL)、PAL、肉桂酸-4-羟化酶(C4H)的活性,从而使迷迭香酸产量提高了大约3倍。Xu 等[4]则发现,桔青霉诱导子可诱导红豆杉悬浮细胞产生NO,NO 作为信号分子活化PAL 并触发紫杉醇生物合成。
3.2 诱导子在微生物细胞培养中次生代谢物合成的调控机制
真菌诱导子与微生物细胞间相互作用的研究相对滞后,在2001年Liu 等[58]才初次报道海藻酸钠(Alginate,(C6H7NaO6) n)可通过某种调节蛋白介导的信号传递途径作用于pcbAB、pcbC和penDE 基因的转录水平,从而诱导产黄青霉菌Penicillium chrysogenum 合成青霉素。为能理解诱导子与微生物细胞间的相互作用过程,Radman 等[59]基于植物防御反应过程,以及人们对酵母和真菌质膜上的受体、G-蛋白偶联受体、胞内钙调蛋白、cAMP 和 Ca2+等第二信使和MAPK、PKC 等途径的研究的结果,构建了诱导子与微生物细胞间的作用模型(图1)。Radman认为当诱导子结合上微生物细胞表面受体时,首先会快速引起细胞膜的去极化,并导致离子通道的开启,使Cl-和K+外流,钙和H+内流,胞内环境的异常变化促使ROS 的生成,后者作为第二信使调控下游相关基因的表达,促进次生代谢产物合成。其次,诱导子与受体相互作用时,可引起G-蛋白介导的磷酸二酯酶(Phophodiesterase)的活化,并导致三磷酸肌醇(IP3)和二酯酰甘油(DAG)的释放,随后IP3将使细胞膜、内质网和液泡上Ca2+通道开启,使Ca2+浓度升高,进而促使PKC 转位到质膜内表面并被膜上DAG 活化后启动PKC-MPKA 信号途径;同时Ca2+还可与钙调蛋白结合激活钙调蛋白激酶,并影响核基因转录等。第三,诱导子还可引起G-蛋白介导腺苷酸环化酶活化,使得胞内cAMP 变化并激活PKA 信号途径。
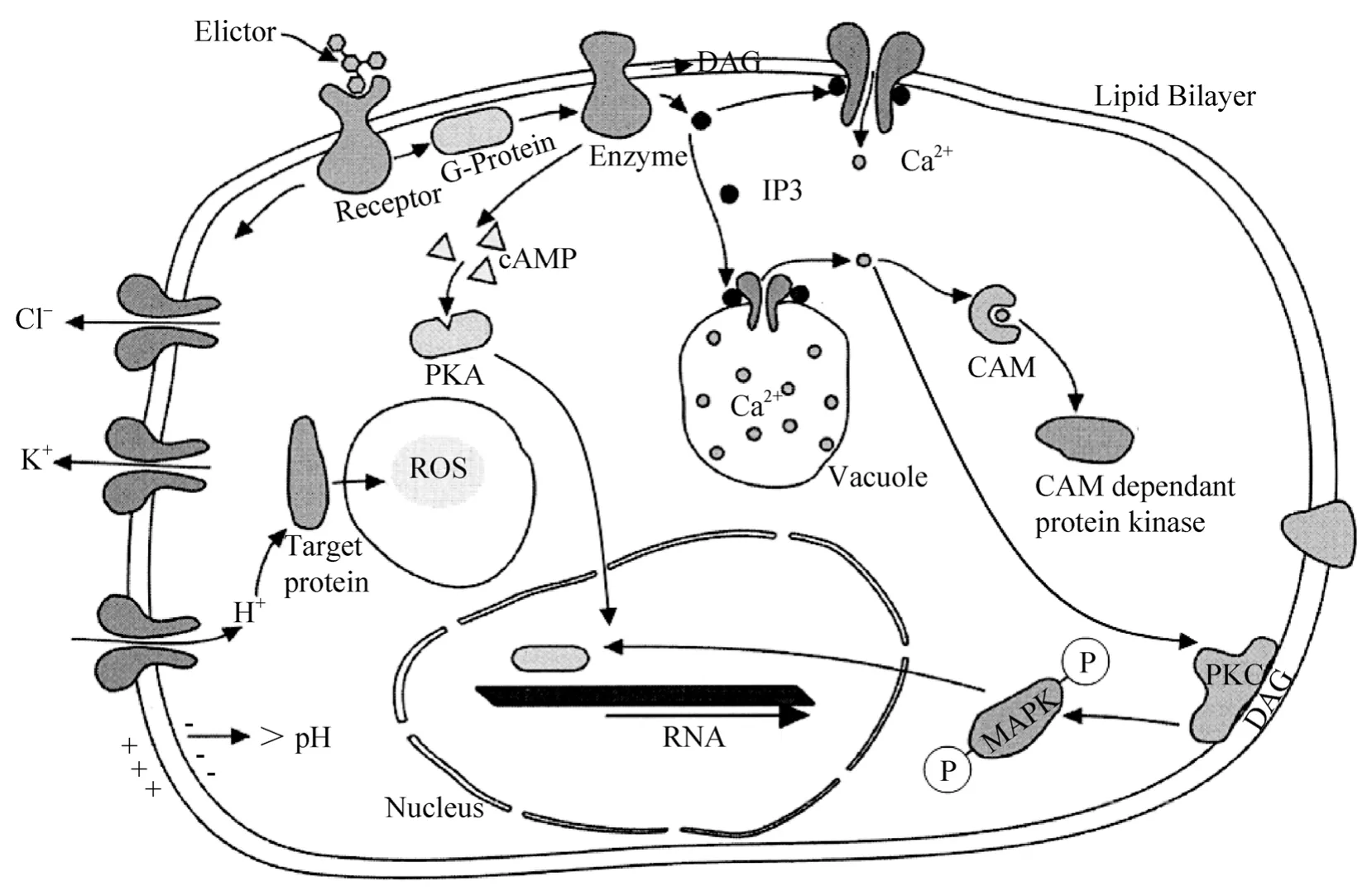
图1 诱导子在微生物细胞中的作用机制模型[50]Fig.1 Hypothetical mechanism of action of elicitors in microbial cell systems[50].
此外,Raina 等[32]还发现诱导子可作用于菌体的群体感应系统,并引起相关基因的表达,从而刺激了次级代谢产物的大量积累。Raina以此为基础,最近提出了利用微生物与自身间,与其他微生物间和环境间的通讯实现对生物活性成分的大量积累作为提高发酵水平的一种新策略[33]。Zheng 等[60]发现来源于烟草赤星病菌Alternaria alternata 的诱导子可通过诱导NO 的产生而促进菌丝酚类化合物的积累,但NO 绝非通过类似于植物细胞中的oxylipins 或JA 信号途径,其真正的作用机制有待进一步深入研究。
4 结论和展望
真菌诱导子主要是糖类、蛋白质和脂类等物质,它们通过与细胞膜表面受体结合,然后通过信号传导途径完成信号的跨膜传递,引起细胞基因表达发生变化,从而调节次生代谢产物生物合成途径中相关酶的活性,最终刺激细胞发生防御反应,诱导特定次生代谢产物的生成和积累。在植物细胞培养中,特别是药用植物中,人们通过不同真菌诱导子实现了对萜类、生物碱类、皂苷类、黄酮类等多种化合物的诱导合成,并取得了良好的经济和社会效益。另一方面,人们成功尝试在微生物发酵中引入真菌诱导子的培养方法,实现对类胡萝卜素、Sclerotiorin、灵芝多糖、灵芝三萜、Monacolin K、DMA 和natamycin 诱导合成。这些工作的开展为发酵工业开启又一个重要的研究领域,更重要的是对于一些难以培养的植物细胞而言,利用诱导子策略在微生物细胞中大量合成植物细胞的一些重要次级代谢产物,将可能成为获得重要药用植物次级代谢产物的又一条有效途径。
同时,我们也注意到在真菌诱导子诱导细胞次生代谢产物合成方面还有许多值得深入研究的问题。第一,目前研究的真菌诱导子时,多以一类或多类物质组成的混合物进行研究,因此不同类诱导子间,甚至同类诱导子间是否存在相互影响或相互作用尚不清楚。因此还应开展诱导子组分中的功能性成分分离、纯化和鉴定工作,这对特异性诱导子的筛选,以及诱导子与受体间作用机制的研究都尤为重要。第二,诱导子来源及诱导子结构形式研究,尤其是蛋白类诱导子,是否进行糖基化和糖基化程度,以及它所处的高级结构状态,如寡聚体和多聚体等对诱导子与受体的结合有什么影响?第三,目的细胞表面诱导子受体情况,目前对寡糖类诱导子受体研究较多,其他类型诱导子受体的种类及分布情况如何,这些受体蛋白的表达受哪些因素的调控,诱导子与受体间的结合与哪些因素有关等都有待进一步研究。第四,在诱导子制备过程中,产诱导子菌体的培养条件、收获时间及提取工艺对诱导子活性有什么影响?第五,在诱导子的添加过程中,诱导子的使用时间、使用条件等与目的细胞的状态有何关系?因此,深入研究真菌诱导子与目的细胞相互作用,尤其是与微生物细胞相互作用时,对实现高效、特异诱导目的产物的生产,推动生物诱导子在发酵工业中的应用都将具有重要的科学意义和应用价值。
[1]Cruickshan IAM,Perrin DR.The isolation and partial characterization of monilicolin A , a polypeptide with phaseollim inducing activity from Monilinia fructicola.Life Sci,1968,7:449–458.
[2]Zhang CP,Li C,Yuan YJ,et al.Effects of fungal elicitor on cell status and taxol production in cells suspension cultures of Taxus chinesis var.mairei.Chin J Biotech,2001,17(4):436–440(in Chinese).张长平,李春,元英进,等.真菌诱导子对悬浮培养南方红豆杉细胞态势及紫杉醇合成的影响.生物工程学报,2001,17(4):436–440.
[3]Li YC,Tiao WY.Effects of paclitaxel-producing fungal endophytes on growth and paclitaxel formatation of Taxus cuspidata cells.Plant Growth Regul,2009,58(1):97–105.
[4]Khosroushahi AY,Valizadeh M,Ghasempour A,et al.Improved taxol production by combination of inducing factors in suspension cell culture of Taxus baccata.Cell Biol Int,2006,30(3):262–269.
[5]Xu MJ,Dong JF.Nitric oxide mediates the fungal elicitor-induced taxol biosynthesis of Taxus chinensis suspension cells through the reactive oxygen species-dependent and -independent signal pathways.Chin Sci Bull,2006,51(16):1967–1975.
[6]Pan XW,Dong YL,Shi YY.Effects of fungal elicitors and anti-browning agents on cell growth and camptothecin biosynthesis with suspension cultures of Camptotheca acuminata decaisne.Chin Agric Sci Bull,2010,26(20):21–26(in Chinese).潘学武,董妍玲,石亚亚.真菌诱导子和抗褐变剂对喜树悬浮细胞生长及喜树碱生物合成的影响.中国农学通报,2010,26(20):21–26.
[7]Eilert U,ConsLable F,Kurz WGW.Elicitor stimulation of monoterpene indole alkaloid formation in suspention culture of Catharanthus roseus.J Plant Physiol,1986,126:11–12.
[8]Namdeo A,Patil S,Fulzele DP.Influence of fungal elicitors on production of ajmalicine by cell cultures of Catharanthus roseus.Biotechnol Prog,2002,18(1):159–162.
[9]Zhang XF,Zhang RT,Wang NN,et al.Effects of fungal elicitors on accumulation of indole alkaloids in Catharanthus roseus calli.Chin Tradit Herbal Drugs,2004,35(2):201–204(in Chinese).张向飞,张荣涛,王宁宁,等.真菌诱导子对长春花愈伤组织中吲哚生物碱积累的影响.中草药,2004,35(2):201–204.
[10]Zhao J,Zhu W,Hu Q.Selection of fungal elicitors to increase indole alkaloid accumulation in Catharanthus roseus suspension cell culture.Enzyme Microb Technol,2001,28(7/8):666–672.
[11]Tang ZH,Rao LQ,Peng GP,et al.Effects of endophytic fungus and its elicitors on cell status and alkaloid synthesis in cell suspension cultures of Catharanthus roseus.J Med Plants Res,2011,5(11):2192–2200.
[12]Fang QM,Zheng GZ,Zhou LG.Metabolic regulation of saponin biosynthesis on suspension culture of Pannax quinquefolum cells.Chin J Biotech,1992,8(3):261–265(in Chinese).方绮民,郑光植,周立刚.西洋参细胞悬浮培养中皂甙生物合成的代谢调节.生物工程学报,1992,8(3):261–265.
[13]Liu CJ,Hou SS,Li XM,et al.The physiological effects of fungal elicitors on the Panax quinquefolum cells in suspension culture.Plant Sci J,1996,14(3):240–246(in Chinese).刘长军,侯嵩生,李新明,等.真菌诱导子对悬浮培养西洋参细胞的生理效应.植物科学学报,1996,14(3):240–246.
[14]Lu M,Wong H,Teng W.Effects of elicitation on the production of saponin in cell culture of Panax ginseng.Plant Cell Rep,2001,20(7):674–677.
[15]Zhao JY.Study on induction of phytoalexins in cotton and saponins in Platycodon grandiflorum[D].Wuhan:Huazhong Normal University,2002(in Chinese).赵俊云.棉花植保素与桔梗皂苷的诱导生成研究[D].武汉:华中师范大学,2002.
[16]Liu J,Chen L,Mao QX,et al.Effect of Fusarium solani elicitors on diosgenin formation of in vitro cultures of Dioscorea zingiberensis.Amino Acids Biotic Resour,2008,30(2):1–4(in Chinese).刘娟,陈路,毛群星,等.镰刀菌诱导子对盾叶薯蓣离体培养物中薯蓣皂素合成的影响.氨基酸和生物资源,2008,30(2):1–4.
[17]Karwasara VS,Jain R,Tomar P,et al.Elicitation as yield enhancement strategy for glycyrrhizin production by cell cultures of Abrus precatorius Linn.In Vitro Cell Dev Biol Plant,2010,46(4):354–362.
[18]Park HH,Takamatsuka T,Sankawa U,et al.Rapid metabolism of islfavonoids in elicitor treated cell supension cultures of Pueraria lobata.Phytochemisty,1995,38(2):373–380.
[19]Hao GP,Du XH,Zhao FX,et al.Fungal endophytes-induced abscisic acid is required for flavonoid accumulation in suspension cells of Ginkgo biloba.Biotechnol Lett,2010,32(2):305–314.
[20]Xu MJ,Dong JF,Wang HZ,et al.Complementary action of jasmonic acid on salicylic acid in mediating fungal elicitor-induced flavonol glycoside accumulation of Ginkgo biloba cells.Plant Cell Environ,2009,32(8):960–967.
[21]Yang SH,Liu XF,Guo DA,et al.Effects of different additives on accumulation of flavonoids in Glycyrrhiza uralensis callus.Chin Pharmac J,2006,41(2):96–99(in Chinese).杨世海,刘晓峰,果德安,等.不同附加物对甘草愈伤组织培养中黄酮类化合物形成的影响.中国药学杂志,2006,41(2):96–99.
[22]Ning W,Xu H,Cao RQ.Effect of fungal elicitor on shikonin formation in Onosma paniculatum cell cultures.Plant Physiol Comm,1994,30(5):348–350(in Chinese).宁文,徐红,曹日强.真菌诱导物对滇紫草细胞色素形成的影响.植物生理学通讯,1994,30(5):348–350.
[23]Liu CJ,Hou SS.Efects of fungal elicitors on the cell growth and the shikonin biosynthesis in Arnebia euchroma cell in suspension culture.Acta Phytophysiol Sin,1998,24(1):6–10(in Chinese).刘长军,侯嵩生.真菌诱导子对新疆紫草悬浮培养细胞的生长和紫草素合成的影响.植物生理学报,1998,24(1):6–10.
[24]Fu XQ,Lu DW.Effects of Rhizopus oryzae elicitor on shikonin secretion in suspension culture of Arnebia euchroma.Acta Phytophysiol Sin,1998,24(4):380–384(in Chinese).傅旭庆,吕德伟.米根霉诱导因子对紫草细胞培养中紫草宁色素分泌的影响.植物生理学报,1998,24(4):380–384.
[25]Wu SJ,Qi JL,Zhang WJ,et al.Nitric oxide regulates shikonin formation in suspension-cultured Onosma paniculatum cells.Plant Cell Physiol,2009,50(1):118–128.
[26]Esmaeilzadeh Bahabadi S,Sharifi M,Safaie N,et al.Increased lignan biosynthesis in the suspension cultures of Linum album by fungal extracts.Plant Biotechnol Rep,2011,5(4):367–373.
[27]Esmaeilzadeh Bahabadi S,Sharifi M,Behmanesh M,et al.Time-course changes in fungal elicitor-induced lignan synthesis and expression of the relevant genes in cell cultures of Linum album.J Plant Physiol,2012,169(5):487–491.
[28]Pettit RK.Small molecule elicitation of microbial secondary metabolites.Microb Biotechnol,2011,4(4):471–478.
[29]Han JR,Gao PP.Effect of several elicitors on sclerotia biomass and carotenoid yield of Penicillium sp.PT95 during solid-state fermentation of corn meal.World J Microb Biot,2002,18(4):371–375.
[30]Wang WJ,Yu LJ,Zhou PP.Effects of different fungal elicitors on growth,total carotenoids and astaxanthin formation by Xanthophyllomyces dendrorhous.Bioresource Technol,2006,97(1):26–31.
[31]Wang WJ,Song FJ,Sun YF.Effects of fungal and chemical elicitors on growth and carotenoid formation of Phaffia rhodozyma.J South-central Univ:Nat Sci Ed,2008,27(2):14–17(in Chinese).汪文俊,宋发军,孙雅芳.生化诱导子对红法夫酵母生长和类胡萝卜素合成的影响.中南民族大学学报:自然科学版,2008,27(2):14–17.
[32]Raina S,Odell M,Keshavarz T.Quorum sensing as a method for improving sclerotiorin production in Penicillium sclerotiorum.J Biotechnol,2010,148(2/3):91–98.
[33]Raina S,Murphy T,De Vizio D,et al.Novel strategies for overproduction of microbial products.Chem Eng Transact,2011,24:847–852.
[34]Zhu LW,Zhong JJ,Tang YJ.Significance of fungal elicitors on the production of ganoderic acid and Ganoderma polysaccharides by the submerged culture of medicinal mushroom Ganoderma lucidum.Process Biochem,2008,43(12):1359–1370.
[35]Gao XX,Yao Q,Wang L,et al.Effect of different fungal elicitors on production of polysaccharide and triterpenoid in liquid fermentation of Ganoderma lucidum.Food Sci,2009,30(23):309–313(in Chinese).高兴喜,姚强,王磊,等.真菌激发子对灵芝液体发酵生产多糖和三萜类物质的影响.食品科学,2009,30(23):309–313.
[36]Sun JL,Zou X,Liu AY,et al.Elevated yield of Monacolin K in Monascus purpureus by fungal elicitor and mutagenesis of UV and LiCl.Biol Res,2011,44(4):377–382.
[37]Liu AY,Sun JL,Zou X,et al.Study on improving content of Monacolin K in Monascus purpureus.Guizhou Agric Sci,2007,35(6):5–7(in Chinese).刘爱英,孙嘉龙,邹晓,等.提高红曲霉发酵产品 Monacolin K 含量的研究.贵州农业科学,2007,35(6):5–7.
[38]Zou X,Sun JL,Zhao JH,et al.The effect of ustilago esculenta henn on part metabolic products of Monascus purpureous Went.Guizhou Agric Sci,2007,35(6):60–61(in Chinese).邹晓,孙嘉龙,赵杰宏,等.茭白黑粉菌对紫红曲霉部分代谢产物的影响.贵州农业科学,2007,35(6):60–61.
[39]Yuan LF,Huang YJ,Zheng ZH,et al.Effect of elicitors on deacetylmycoepoxydiene metabolite produced by Phomopsis sp.139.J Xiamen Univ:Nat Sci,2011,50(1):101–104(in Chinese).袁丽峰,黄耀坚,郑忠辉,等.诱导子对拟茎点霉139产去乙酰真菌环氧乙酯的调节作用.厦门大学学报:自然科学版,2011,50(1):101–104.
[40]Zheng W,Zhao Y,Zheng X,et al.Production of antioxidant and antitumor metabolites by submerged cultures of Inonotus obliquus cocultured with Phellinus punctatus.Appl Microbiol Biotechnol,2011,89(1):157–167.
[41]Zhao YX,Liao KJ,Wei ZW,et al.Study of effects of fungal polysaccharide elicitor on production of phenolic compounds by Phaeoporus obliquus.Chin Tradit Herbal Drugs,2010,41(12):2079–2082(in Chinese).赵艳霞,缪康杰,魏志文,等.真菌多糖激发子对桦褐孔菌多酚积累影响的研究.中草药,2010,41(12):2079–2082.
[42]Zhao YX,Liao KJ,Zhang MM,et al.Effects of fungal elicitor on production of phenolic compounds by Phaeoporus obliquus.Mycosystema,2010,29(3):437–441(in Chinese).赵艳霞,缪康杰,张梅梅,等.真菌激发子对桦褐孔菌多酚积累的影响.菌物学报,2010,29(3):437–441.
[43]Zheng W,Liu Y,Pan S,et al.Involvements of S-nitrosylation and denitrosylation in the production of phenolic compounds by Inonotus obliquus.Appl Microbiol Biotechnol,2011,90(5):1763–1772.
[44]Shi Q.Elicitors in fungal metabolites on improvement of natamycin by Streptomyces natalensis [D].Wuxi:Jiangnan University,2010(in Chinese).史强.真菌代谢产物中促进纳他霉素合成的诱导子的研究[D].无锡:江南大学,2010.
[45]Yoshikawa M.Macromolecules,recognition and the triggering of resistance//Callow JA Ed.Biochem Plant Pathol.New York:John Wiley,1983:267–298.
[46]Schmidt WE,Ebel J.Specific binding of a fungal glucan phytoalexin elicitor to membrane fractions from soybean Glycine max.Proc Natl Acad Sci USA,1987,84(12):4117–4121.
[47]Vargas WA,Djonović S,Sukno SA,et al.Dimerization controls the activity of fungal elicitors that trigger systemic resistance in plants.J Biol Chem,2008,283(28):19804–19815.
[48]Salzer P,Reith A,Zitterellhaid B,et al.Rapid reactions of spruce cells to elicitors released from the ectomycorrhizal fungus Hebeloma crustuliniforme,and inactivation of these elicitors by extracellular spruce cell enzymes.Planta,1996,198(1):118–126.
[49]Blume B,Nürnberger T,Nass N,et al.Receptor-mediated increase in cytoplasmic free calcium required for activation of pathogen defense in parsley.Plant Cell,2000,12(8):1425–1440.
[50]Menke FL,Parchmann S,Mueller MJ,et al.Involvement of the octadecanoid pathway and protein phosphorylation in fungal elicitor-induced expression of terpenoid indole alkaloid biosynthetic genes in Catharanthus roseus.Plant Physiol,1999,119(4):1289–1296.
[51]Suzuki K,Shinshi H.Transient activation and tyrosine phosphorylation of a protein kinase in Tobacco cells treated with a fungal elicitor.Plant Cell,1995,7(5):639–647.
[52]Peck SC,Nühse TS,Hess D,et al.Directed proteomics identifies a plant-specific protein rapidly phosphorylated in response to bacterial and fungal elicitors.Plant Cell,2001,13(6):1467–1475.
[53]Dietrich A,Mayer JE,Hahlbrock K.Fungalelicitor triggers rapid,transient,and specific protein phosphorylation in parsley cell suspension cultures.J Biol Chem,1990,265(11):6360–6368.
[54]Zhao J,Sakai K.Multiple signalling pathways mediate fungal elicitor-induced beta-thujaplicin biosynthesis in Cupressus lusitanica cell cultures.J Exp Bot,2003,54(383):647–656.
[55]Zhao J,Guo YQ,Kosaihira A,et al.Rapid accumulation and metabolism of polyphosphoinositol and its possible role in phytoalexin biosynthesis in yeast elicitor-treated Cupressus lusitanica cell cultures.Planta,2004,219(1):121–131.
[56]Zhao J,Hu Q,Guo YQ,et al.Elicitor-induced indole alkaloid biosynthesis in Catharanthus roseus cell cultures is related to Ca2+influx and the oxidative burst.Plant Sci,2001,161(3):423–431.
[57]Szabo E,Thelen A,Petersen M.Fungal elicitor preparations and methyl jasmonate enhance rosmadnic acid accumulation in suspension cultures of Coleus blumei.Plant Cell Rep,1999,18(6):485–489.
[58]Liu G,Casqueiro J,Gutierrez S,et al.Elicitation of penicillin biosynthesis by alginate in Penicillium chrysogenum is exerted on the pcbAB,pcbC and penDE genes at the transcriptional level.J Microbiol Biotechnol,2001,11(5):812–815.
[59]Radman R,Saez T,Bucke C,et al.Elicitation of plants and microbial cell systems.Biotechnol Appl Biochem,2003,37(1):91–102.
[60]Zheng WF,Miao KJ,Zhang YX,et al.Nitric oxide mediates the fungal-elicitor-enhanced biosynthesis of antioxidant polyphenols in submerged cultures of Inonotus obliquus.Microbiology,2009,155(10):3440–3448.
