肌注和口服药饵麻保沙星在日本对虾体内的药代动力学比较
2013-06-26梁俊平
李 晖,李 健,孙 铭,梁俊平
(1.山东科技职业学院,山东 潍坊261053;2.中国水产科学研究院 黄海水产研究所,山东 青岛 266071)
日本对虾(Marsupenaeus japonicus)自20世纪80年代开始引进我国以来,经过近20年的迅速推广与研究,现已成为养殖区遍及沿海各省的中国主要四大养殖对虾之一。然而随着日本对虾养殖业的迅猛发展以及集约化程度的不断提高,导致养殖环境不断恶化,养殖病害也逐渐增多。药物防治以其效果直接、操作简单方便等优点而成为水产动物疾病防治的有效措施。但由于缺乏相关的科学合理用药指导,在实际生产中为了加强疗效,往往存在过量用药,滥用药物的现象,从而造成药物残留超标,部分病原微生物甚至产生了耐药性。因此加强渔药代谢研究,制订科学合理的用药方案意义重大。
麻保沙星(marbofloxacin)是一种动物专用的新型氟喹诺酮类抗菌药,由瑞士罗氏公司研制,1995年由Vetoquinol公司首次在英国上市[1]。它对革兰氏阴性菌、革兰氏阳性菌、厌氧菌及支原体都有很强的抗菌作用,已广泛应用于畜禽类的疾病防治,但在水产上却较少使用。国外关于麻保沙星的研究较深入,已报道了其在马、牛、羊、狗、猫和欧洲鲫鱼(Carassius auratus)[2-7]等体内的药代动力学研究;国内仅见其在鸡、猪和中国对虾(Fenneropenaeus chinensis)[8-10]体内的药代动力学研究。研究结果表明,该药具有组织渗透力强,消除半衰期长,生物利用度高, 与其他抗菌药无交叉耐药性等特点。目前麻保沙星已获批准在犬、猫、猪和牛上使用,但其在水产动物体内的代谢情况仅见在中国对虾上的报道,关于麻保沙星在日本对虾体内的药代动力学研究尚未见报道。本实验首次以日本对虾为研究对象,比较肌注和口服药饵给药方式下麻保沙星在日本对虾体内的药代动力学差异,并将药动学参数与抗菌后效应(PAE)和最小抑菌浓度(MIC)相结合来制订给药方案,以期为生产中合理用药提供指导。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
健康日本对虾,平均体长 7.89 cm,平均体质量5.66 g,购自于青岛市宝荣水产科技发展有限公司,暂养2周。实验前检测无药物残留,实验期间每天换水 1次,连续充气,水温为(25±0.6)℃,投饲不含任何药物的配合饲料。
1.1.2 试验药品与试剂
麻保沙星标准品,纯度≥99.5%,中国兽药监察所生产;麻保沙星原粉,纯度≥98.5%,杭州久恒生物化学科技有限公司生产,批号2060725。乙腈为色谱纯,二氯甲烷、正己烷、85%磷酸、三乙胺为分析纯。
1.1.3 试验仪器
Agilent1100型高效液相色谱仪(HPLC),数据处理系统为WindowsNT4.0 HP工作站,KL512型恒温水浴氮吹仪,XHF-1型高速分散器,Eppendorf高速离心机。
1.2 试验方法
1.2.1 给药与采样
将试验日本对虾随机分成3组,第一组: 一次性血窦注射麻保沙星水溶液,给药剂量为10 mg/kg虾体重,注射部位为腹部血窦;第二组: 一次性肌肉注射麻保沙星水溶液,给药剂量为10 mg/kg虾体重,注射部位为腹部第2、3体节间。分别于给药后0.083、0.167、0.25、0.5、1、1.5、2、3、4、6、8、10、12、24、48、96 h采集血淋巴、肌肉、肝胰腺样品。第三组: 一次性投喂自制麻保沙星药饵,给药剂量为30 mg/kg虾体重,按照日本对虾每千克体重摄食量20 g计算来配制麻保沙星药饵。分别于给药后0.5、1、2、3、4、6、8、10、12、16、24、36、48、72、96 h采集血淋巴、肌肉、肝胰腺样品。另设空白对照组。每一时间点各采 8尾虾,全部样品于–80℃冰箱保存。
血淋巴取样: 先将取样虾用纱布擦干头胸甲,然后将预先涂有 1%肝素钠的注射器缓慢插入围心窦,抽取血淋巴,再转移到离心管中,在震荡器上震荡1 min,于5 000 r/min转速下离心5 min,取出上层液置于–80℃低温冰箱中保存。
1.2.2 样品前处理
样品解冻,准确称取1 g肌肉,0.3 g的肝胰腺或吸取0.5 mL血淋巴,加入2 mL乙腈16 000 r/min匀浆20 s;再用2 mL乙腈清洗刀头,合并两次液体漩涡振荡10 s,静置2 h,5 000 r/min离心10 min,取上清液,在40℃恒温水浴下氮气吹干,残渣用1 mL流动相溶解,加入 2 mL正己烷去脂肪,下层液用 0.2 μm滤膜过滤后进行高效液相色谱测定。
1.2.3 标准曲线与最低检测限
准确称取麻保沙星 0.01 g,用适量冰醋酸助溶,然后用流动相定容至100 mL,配成100 mg/L的母液,再依次用流动相稀释成 5.00、2.00、1.00、0.50、0.20、0.10、0.05、0.02、0.01 mg/L的标准溶液用HPLC进行检测,以峰面积为纵坐标,浓度为横坐标作标准曲线,分别求出回归方程和相关系数。最低检测限参照梁俊平等[11]的方法确定。
1.2.4 色谱条件
色谱柱: Agilent Tc-C18(250 mm×4.6 mm,5 µm);流动相: 乙腈:磷酸(0.01 mol/L,用三乙胺调至pH=3.42)=20:80(V:V);紫外检测器,波长 295 nm;柱温 30℃;流速1.0 mL/min,进样量 20 μL。
1.2.5 回收率和精密度的测定
取浓度为 0.10、0.50、1.00、5.00 mg/L的标准溶液加入到0.5 g空白组织或0.5 mL空白血浆中,然后按“样品前处理”方法处理后测定,每个浓度设3个重复,测得各样品峰面积按标准曲线方程计算浓度,然后与理论浓度相比较。

将上述样品于1 d内分别重复进样5次和分5 d测定,计算各浓度水平响应值峰面积的变异系数(C·V%),以此衡量检测方法的精密度。
1.2.6 数据处理
药代动力学模型拟合采用DAS2.0软件处理,并用一、二和三室模型分别以权重1、1/C、1/CC 3种情况进行拟合,根据AIC和R2值来判断最适合的房室模型,并计算药动学参数。
1.2.7 麻保沙星的口服给药方案
设定4MIC为期望达到的稳态血药浓度,给药剂量的确定可根据徐叔云等[12]提出的公式计算:

式中,D: 每日给药剂量;C: 期望达到的稳态血药浓度;Vd: 表观分布率;K: 一级消除速率常数;τ: 给药时间间隔;F: 口服生物利用度
2 结果
2.1 线性范围与最低检测限
麻保沙星标准液在0.01~5.00 mg/L浓度范围内有良好的相关性,线性回归方程为: Y = 118.38X +1.5071,相关系数R2= 1。
2.2 回收率与精密度
麻保沙星在血淋巴和各组织中的回收率在80.25%~93.84%,如表 1所示;日内变异系数为2.35%~3.27%,日间变异系数为 3.26%~4.53%,如表2所示。
回收率和变异系数是决定测定方法准确性和可靠性的重要依据,回收率不应低于 70%,日内和日间变异系数应控制在10%以内。本试验回收率高,变异系数小,均符合生物测定方法要求。

表1 麻保沙星在三种组织中的回收率Tab.1 Recovery rate of marbofloxacin in three tissues
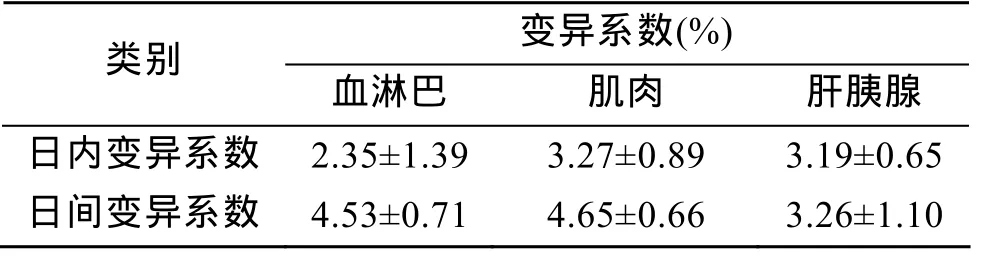
表2 麻保沙星在3种组织中的变异系数Tab.2 Variation coefficient of marbofloxacin in three tissues
2.3 麻保沙星在日本对虾体内的药代动学特征
2.3.1 房室模型及药代动力学参数
采用DAS2.0软件对3种给药方式下麻保沙星在日本对虾血淋巴中的浓度进行分析。结果显示,血窦注射给药后,麻保沙星在日本对虾体内药物动力学最佳模型为无级吸收二室开放模型,表达方程为: C= Ae–αt+Be–βt;肌注和口服药饵给药后,麻保沙星在健康日本对虾体内的药物动力学最佳模型为一级吸收二室开放模型,表达方程为: C = Ae–αt+Be–βt-(A+B)e–Kat。药代动力学参数见表3。
其药代动力学方程分别为:

3种给药方式下,消除相半衰期与分布相半衰期具有正相关性。血窦注射时,药物在血浆中分布和消除最快,其分布相半衰期(t1/2α)为 0.496 h,消除相半衰期(t1/2β)为11.212 h;肌肉注射下,药物在血浆中分布和消除速率次之,其分布相半衰期(t1/2α)为0.601 h,消除相半衰期(t1/2β)为11.769 h;口服药饵时,药物在血浆中分布和消除最慢,其分布相半衰期(t1/2α)为2.103 h,消除相半衰期(t1/2β)为 13.535 h。
日本对虾投喂麻保沙星药饵1.5 h后,吸出残饵,烘干称量,计算得出实际口服的剂量为13.60 mg/kg,生物利用度(F)用以下公式计算:

血窦注射下,生物利用度最高,为 100%;肌肉注射下,生物利用度次之,为 99.56%;口服药饵下,生物利用度最低,为69.68%。
2.3.2 麻保沙星在日本对虾体内的吸收与分布
本部分详细比较了肌注和口服药饵 2种给药方式下,麻保沙星在日本对虾体内的吸收与分布规律,其血淋巴、肌肉和肝脏中的药-时曲线分别见图 1、图2和图3。
从图中可看出,麻保沙星在血淋巴和组织中的分布较广泛,肌肉注射下血淋巴中药物浓度较口服药饵下血淋巴中药物浓度高;但是肌肉注射下肝胰腺和肌肉中药物浓度较口服药饵下肝胰腺和肌肉中药物浓度低。2种给药方式下,血淋巴中的药物浓度均在0.25 h达到峰值,肌肉中药物浓度均在0.167 h达到峰值;口服药饵下,肝胰腺中的药物浓度在0.167 h达到峰值,肌肉注射下,肝胰腺中药物达峰时间较口服药饵下达峰时间晚,为0.25 h。
2.3.3 药动参数与抗菌后效应(PAE)及最小抑菌浓度(MIC)结合给药方案
根据前期研究[13]可知麻保沙星具有明显的PAE,且呈浓度依赖型。可将血药浓度高于MIC的时间与PAE的时间之和作为给药间隔时间。测得麻保沙星对 3种常见海洋致病性弧菌溶藻弧菌、哈维氏弧菌和灿烂弧菌的MIC在1~4 mg/L之间,以1、2、4倍MIC的麻保沙星药物浓度诱导产生的 PAE在0.49~1.25 h之间。以10 mg/kg剂量肌注麻保沙星在12 h内血药浓度仍高于该药物的 MIC,以 13.60 mg/kg剂量口服药饵麻保沙星在10 h内血药浓度仍高于该药物的MIC。根据药物浓度与PAE的关系,以麻保沙星在日本对虾体内的最高浓度为诱导浓度,肌注方式下的 PAE大于 1.6 h,口服药饵方式下的PAE大于1.8 h。因此给药间隔时间为: 肌注13.6 h,口服药饵11.8 h。
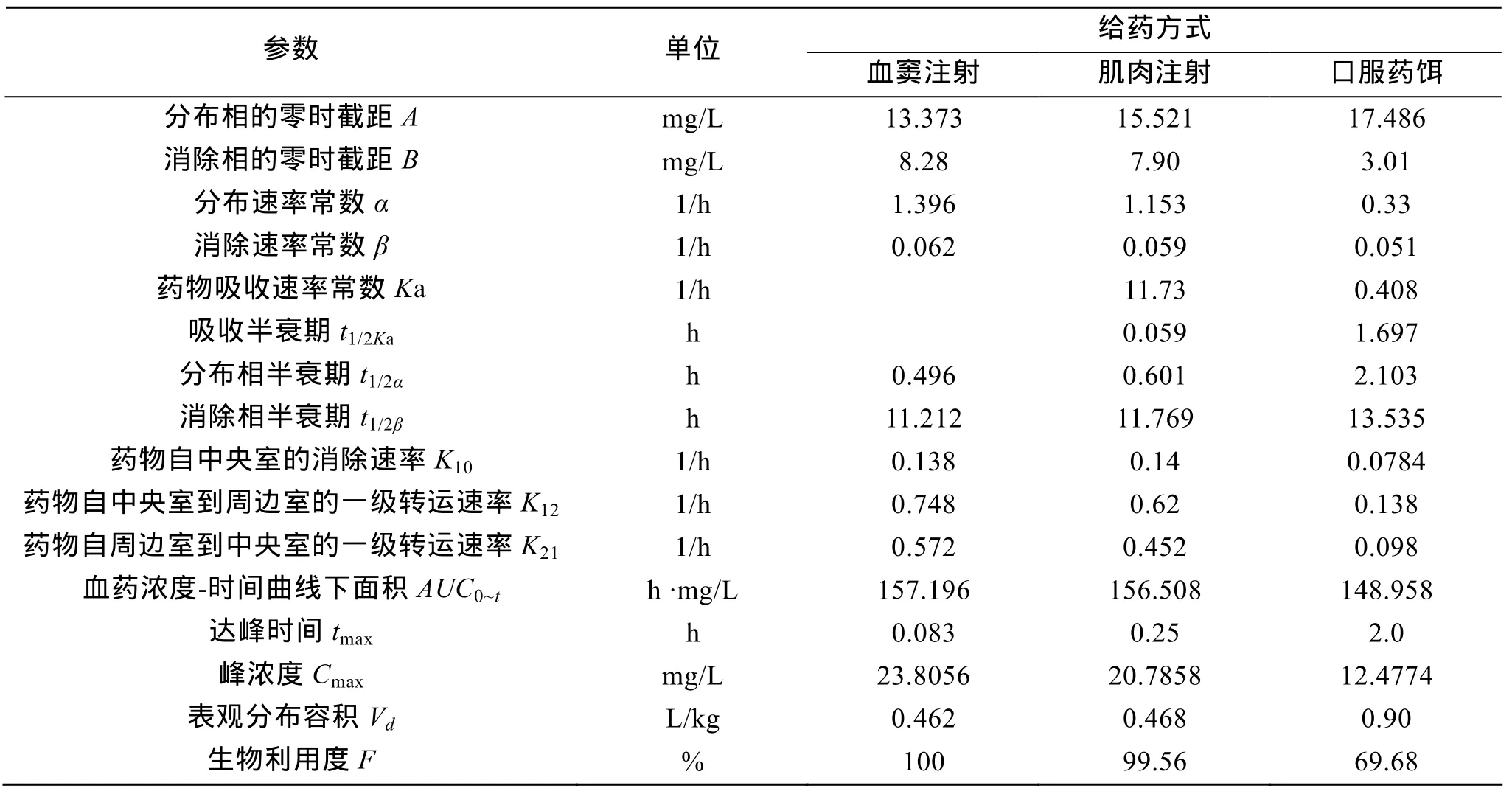
表3 日本对虾血窦注射、肌肉注射和口服药饵麻保沙星的药代动力学参数Tab.3 Pharmacokinetic parameters of marbofloxacin given by intravenous (10 mg/kg b.w.),intramuscular (10 mg/kg b.w.)or oral administration (30 mg/kg b.w.)to Marsupenaeus japonicus
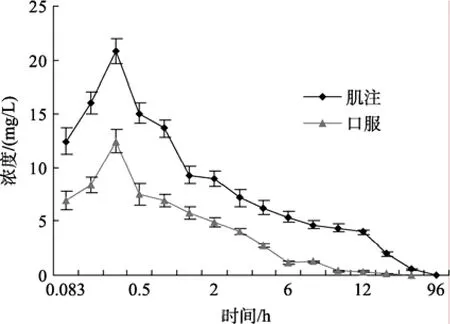
图1 麻保沙星在日本对虾血淋巴中的药-时曲线Fig.1 Mean marbofloxacin concentration-time curve in plasma of Marsupenaeus japonicus after intramuscular and oral administration
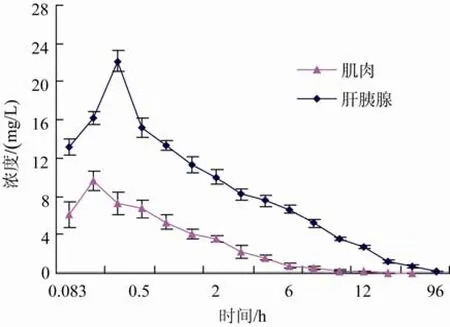
图2 日本对虾肌注麻保沙星后各组织中的的药-时曲线Fig.2 Mean marbofloxacin concentration-time curve in tissues of Marsupenaeus japonicus after intramuscular administration
根据 D=C×Vd× K×τ /F 公式计算,肌注和口服药饵两种给药方式下分别以14.30 mg/kg和19.17 mg/kg给药剂量,即可获得16 mg/L的稳态血药浓度。
3 讨论
3.1 肌注和口服药饵麻保沙星在日本对虾体内的吸收特征

图3 日本对虾口服药饵麻保沙星后各组织中的药-时曲线Fig.3 Mean marbofloxacin concentration-time curve in tissues of Marsupenaeus japonicus after oral administration
由表 3可知,日本对虾一次性肌注麻保沙星(10 mg/kg)后血药达峰时间为 0.25 h,显著快于马(0.95 h)、鸡(1.57 h)、猪(0.91 h)[2,8-9],与中国对虾(0.147 h)[10]相近;口服麻保沙星后血药达峰时间为2.0 h,快于猪(3.75 h)和海龟15 h)[9,14],慢于鸡(1.35 h)[8],与猫(1.94 h)和欧洲鲫鱼(1.74 h)[6-7]相似。根据杨先乐等[15]报道中华绒螯蟹肌注环丙沙星后,血药浓度立即达到峰值,房文红等[16]研究肌注诺氟沙星在斑节对虾体内的代谢中报道血药浓度于给药后1~2 min内达到峰值。房文红等[17]研究南美白对虾肌注诺氟沙星后,血药浓度于给药后 2 min达到峰值,甲壳动物血药浓度到达峰值之快类似于血窦内[18]或静脉注射给药。这可能与其特殊的水生环境和开放式循环系统有关。
本实验测得肌注麻保沙星在日本对虾体内的吸收半衰期 t1/2Ka为 0.059 h,明显快于鸡(0.54 h)和猪(0.27 h)[8,9],与中国对虾(0.028 h)[10]较接近;口服药饵时其吸收半衰期t1/2Ka为1.697 h,慢于猪(1.16 h)和鸡(0.42 h)[8-9]。结果表明,肌注麻保沙星的吸收速率明显大于口服药饵。给药途径不同主要影响生物利用度和药效出现的快慢。注射给药后,药物直接通过血液循环进入体内各组织进行分布。而口服给药后,药物在经过消化道时,会受到食物吸收的影响及各种酶的降解,已有研究证实参与药物代谢中细胞色素P450酶最为重要[19];药饵口服给药后还可能存在药物在动物体内的首过作用,即首先经过胃肠道和肝脏吸收,而后进入血液循环;另外,饲料和水中的钙、铁、镁、铝等离子能与氟喹诺酮类发生螯合,影响内服药物的吸收,降低生物利用度和血液浓度[20]。
日本对虾肌注麻保沙星后,其生物利用度F(99.56%),高于口服药饵(69.68%)。猪[9]肌注和口服药饵麻保沙星后的 F为 107.86%和97.41%,高于本实验结果;马和鸡[2,8]肌注麻保沙星后的 F分别为87.94%、94.45%,略低于本实验结果。可见麻保沙星在日本对虾体内的生物利用度较高,吸收较充分,利用率较高。
3.2 肌注和口服药饵麻保沙星在日本对虾体内的分布特征
麻保沙星经肌肉注射后通过毛细血管进入血液循环向各组织器官迅速分布。本实验中肌注麻保沙星在日本对虾体内的分布半衰期 t1/2α远远小于鸡(2.33 h)和猪(2.87 h)[8-9],与中国对虾(0.893 h)[10]相近;日本对虾口服药饵麻保沙星后的分布半衰期也小于鸡(2.31 h)猪(4.94 h)[8-9],大于欧洲鲫鱼(0.87 h)[7]。可见,麻保沙星在日本对虾体内的分布较快。肌注麻保沙星与其他药物在甲壳类体内分布情况相比,其分布半衰期大于氟苯尼考(0.27 h)和磺胺甲基异唑(0.41 h)[21-22],小于恩诺沙星(0.97 h)和诺氟沙星(1.66 h)[23-24]。这说明麻保沙星作为新一代氟喹诺酮类药物具有潜在的优越性。
药物在体内分布的广泛程度由表观分布容积 Vd来体现。本研究中口服药饵10 mg/kg麻保沙星在日本对虾体内的 Vd为 0.90 L/kg,大于海龟(0.16 L/kg)[14]与对欧洲鲫鱼(0.87 L/kg)和猫(0.99 L/kg)[6-7]的研究结果相近。与其他动物相比,麻保沙星在日本对虾体内的分布较为广泛。
3.3 肌注和口服药饵麻保沙星在日本对虾体内的消除特征
日本对虾肌注麻保沙星后的消除半衰期长于马(5.47 h)、山羊(6.77 h)、鸡(6.27 h)、鸵鸟(1.96 h)和犊牛(4.33 h)[2,4,8,25-26],短于猪(17.38 h)[9],与中国对虾(9.866 h)[10]相近;日本对虾口服药饵麻保沙星后的消除半衰期长于猫(7.15 h)和鸡(6.48 h)[6,8],短于欧洲鲫鱼(25.05 h)和猪(22.98 h)[7,9],与海龟(13.33 h)[14]相近。由此可见,麻保沙星在日本对虾体内的消除半衰期慢于大部分的畜禽类,与部分水产动物相接近,消除较慢。这可能与对虾属于终生生活在水中的变温动物有关,除受种属及本身遗传因素之外,体内药物代谢受水温的影响更为显著[27]。
日本对虾口服药饵麻保沙星后的消除半衰期大于肌注,该结果与黄显会[8]李云峰[9]等的研究相一致,有关学者在研究其他药物时也得出了相似的结论[19,21,28-29]。这可能是由于口服给药后,药物要先经过胃肠道而后进入血淋巴,再通过血液循环进行分布消除。从而致使口服给药消除半衰期长于肌注。
肌注麻保沙星与其他药物在甲壳类体内消除情况相比,其消除半衰期大于氟苯尼考(6.494 h)、恩诺沙星(7.03 h)、诺氟沙星(1.69 h)和磺胺甲基异唑(10.87 h)[21-24];口服药饵麻保沙星时,其消除半衰期大于氟苯尼考(7.903 h)和诺氟沙星(4.24 h)[17,30]。可见,麻保沙星与其他药物相比具有消除缓慢的特点,表现出其作为水产抗菌药物的优势。
3.4 药动参数与抗菌后效应(PAE)及最小抑菌浓度(MIC)结合给药方案探讨
按传统的观念,抗生素的给药方案设计主要依赖于血药动力学参数和最小抑菌浓度(MIC),并且要保证多次给药的药物浓度谷值不低于感染菌的MIC,方能发挥疗效。为此,半衰期较短的药物每日用药达3~4次之多。由于PAE反映了抗生素在消除后或浓度大大低于 MIC时仍可使细菌受到一定时间的抑制[31],不仅使一些药物在分布浓度低的组织得到治疗的可能,并且在保证疗效的前提下,可根据对PAE时间的长短结合MIC、MBC及药动学参数来确定给药剂量、间隔时间和给药次数,较传统方案提高单次给药剂量,减少给药次数,既方便临床用药,又能保持甚至提高疗效。
4 小结
麻保沙星的药代动力学研究表明: 麻保沙星在日本对虾体内具有吸收迅速,分布广泛,消除缓慢,生物利用度高等特点。同时,两种给药方式下,麻保沙星在日本对虾体内的吸收、分布和消除,肌注均快于口服药饵给药。实际生产中麻保沙星多以口服药饵给药,由于口服药饵给药的生物利用度和肌注给药相近且都很高,所以建议肌注 14.30 mg/kg,给药间隔为 13.6 h;口服药饵19.17 mg/kg,给药间隔为11.8 h。
[1]邱银生,吴佳.动物专用氟喹诺酮类药物研究进展简介[J].中国兽药杂志,1998,32 (3): 46-48.
[2]Carretero M,Rodriguez C,Sanandres M I,et al.Pharmacokinetics of marbofloxacin in mature horses after single intravenous and intramuscular administration [J].Equine Veterinary Journal,2002,34 (4): 360-365.
[3]Schneider M,Valle M,Woehrle F.Pharmacokinetics of marbofloxacin in lactating cows after repeated intramuscular administrations and pharmacodynamics against mastitis isolated strains [J].Journal of Dairy Science,2004,87(1): 202-211.
[4]Waxman S,Rodríguez C,González F,et al.Pharmacokinetic behavior of marbofloxacin after intravenous and intramuscular administrations in adult goats [J].Journal of Veterinary Pharmacology and Therapeutics,2002,24(6): 375-378.
[5]Boothe H W,Jones S A,Wilkie W S,et al.Evaluation of the concentration of marbofloxacin in alveolar macrophages and pul-monary epithelial lining fluid after administration in dogs [J].American Journal of Veterinary Research,2005,66(10): 1770-1774.
[6]Albarellos G A,Montoya L,Landoni M F.Pharmacokinetics of marbofloxacin after single intravenous and repeat oral administration to cats [J].The Veterinary Journal,2005,170: 222-229.
[7]Zhu Yanlei,Tan Yeping,Wang Chunmei,et al.Pharmacokinetics and tissue residues of marbofloxacin in crucian carp (Carassius auratus)after oral administration[J].Aquaculture Research,2009,40: 696-709.
[8]黄显会,陈杖榴,张淑婷,等.麻保沙星在鸡体内的生物利用度及药物动力学[J].中国兽医学报,2002,22(3): 279-281.
[9]李云峰,曾振灵,陈杖榴,等.麻保沙星(marbofloxacin)在猪体内的药物动力学[J].中国兽医学报,2004,24(2): 177- 180.
[10]张海珍,李健,王群,等.麻保沙星在中国对虾体内药代动力学及残留研究[J].中国农业科技导报,2008,10(2): 88-93.
[11]梁俊平,李健,喆张,等.肌注和口服恩诺沙星在大菱鲆体内的药代动力学比较 [J].水生生物学报,2010,34(6): 1122-1128.
[12]徐叔云,卞如濂,陈修.药理实验方法学(第 3版)[M].北京: 人民卫生出版社,2002.
[13]李晖,李健,喆张,等.麻保沙星对主要海洋致病性弧菌的体外抗菌活性及抗菌后效应[J].中国水产科学,2010,17(1): 97-102.
[14]Marín O R P,Lai P,Laricchiuta G,et al.Pharmacokinetics of marbofloxacin after a single oral dose to loggerhead sea turtles (Caretta caretta)[J].Research in Veterinary Science,2009,87: 284-286.
[15]杨先乐,刘至治,横山雅仁.盐酸环丙沙星在中华绒螯蟹体内药物代谢动力学研究[J].水生生物学报,2003,27(1): 18-22.
[16]房文红,邵锦华,施兆鸿,等.斑节对虾血淋巴中诺氟沙星含量测定及药代动力学[J].水生生物学报,2003,27(1): 13-17.
[17]房文红,郑国兴.肌注和药饵给药下诺氟沙星在南美白对虾血淋巴中药代动力学[J].水生生物学报,2006,30(5): 541-546.
[18]Park E D,Lightner D V,Milner N,et al.Exploratory bioavailability and pharmacokinetic studies of sulphadimethoxine and ormetoprim in the penaeid shrimp,Penaeus vannamei [J].Aquaculture,1995,130(2-3): 113-128.
[19]王广基.药物代谢动力学.北京: 化学工业出版社,2005: 51-63.
[20]郭海燕,张其中.诺氟沙星在水产动物体内的药物动力学及残留研究[J].水产养殖,2007,28(1): 1-3.
[21]李静云,王群,李健,等.氟苯尼考在中国对虾组织内的代谢动力学及残留消除规律[J].水产学报,2004,28(12): 63-68.
[22]范克俭,王群,李健,等.磺胺甲基异唑在中国明对虾体内的药代动力学研究[J].齐鲁渔业,2005,22(8): 1-5.
[23]吴光红,张静波,孟勇,等.不同水温下恩诺沙星在中华绒螯蟹体内药物代谢动力学[J].南京农业大学学报,2008,31(2): 105-110.
[24]何平,尹文林,沈锦玉.诺氟沙星在淡水青虾体内药物代谢动力学研究[J].浙江海洋学院学报,2008,27(2): 135-139.
[25]Jose’ Julio de Lucas,Casilda Rodrı’guez,Samanta Waxman,Pharmacokinetics of marbofloxacin after intravenous and intramuscular administration to ostriches[J].The Veterinary Journal,2005,170: 364-368.
[26]王志强,陈杖榴.动物专用氟喹诺酮为抗菌新药—麻保沙星[J].中国兽医药杂志,2001,22(4): 38-41.
[27]梁俊平,李健,常志强,等.达氟沙星在健康大菱鲆体内的药代动力学研究[J].渔业科学进展,2011,32(2): 44-50.
[28]Bailey T A,Sheen R S,Silvanose C,et al.Pharmacokinetics of enrofloxacin after intravenous and oral administration in Houbara Bustard (Chlamydotis undulate macqueenii)[J].J.VET.Pharmacol.Therap,1998,21: 288-297.
[29]Stoffregen D A,Wooster G A,Bustos P S,et al.Multiple route and dose pharmacokinetics of enrofloxacin in juvenile Atlantic Salmon [J].J Vet Pharmacol Ther,1997,20(2): 111-123.
[30]陈文银,印春华.诺氟沙星在中华鳖体内的药代动力学研究[J].水产学报,1997,21(4): 434-437.
[31]刘芳萍,佟恒敏,李昌文.单诺沙星对大肠杆菌和金葡球菌的体外抗菌后效应[J].黑龙江畜牧兽医,2002,7(2): 7-8.
