酶解蓝圆鲹蛋白制备降血压肽的工艺研究
2013-06-26孙建华伍善广赵钟兴廖丹葵
舒 冰,孙建华,伍善广,赵钟兴,廖丹葵
(广西大学 化学化工学院,广西 南宁 530004)
血管紧张素转化酶(angiotension converting enzyme,ACE)在人体血压调节过程中起重要的生理作用,它可以催化血管紧张素I转化为具有最强血管收缩作用的血管紧张素Ⅱ并使肾素失去催化活性使血压升高,而高血压是引发心血管疾病造成动脉硬化及心肌梗塞的主要危害因素之一[1],因此治疗和预防高血压病是当今社会十分重要的课题。而血管紧张素转化酶抑制剂具有抑制ACE活性的作用,因此ACE被认为是控制高血压的最有效的方法之一。
自1977年开发设计了化学合成的ACE抑制剂卡托普利以来,人工合成的ACE抑制剂已得到医学界的普遍认可。然而,人工合成ACE抑制剂在临床应用过程中往往会产生如咳嗽等副作用[1]。因此,寻找天然、安全的食物来源的ACE抑制剂来预防和治疗高血压引起了广大科学工作者的极大关注,食物蛋白源 ACE抑制肽即是这样一类降血压功能因子,由于酶解法具有生产安全性高、能在温和的条件下进行定位水解分裂产生大量的短肽,生产时间短,水解过程易控制,价廉易于推广的优点,因此该法应用较为普遍。研究表明,很多源于食物源蛋白如酪蛋白[2]、乳清蛋白[3]、大豆蛋白[4]、谷物蛋白[5]及鱼蛋白[6]等水解物中已经陆续分离得到很多天然的ACE抑制剂。
蓝圆 鲹作为一种低值海洋鱼类,其形体小、产量大、营养丰富,有很大的开发价值。但由于缺少有效的加工方法而大都被加工成饲料、鱼糜和休闲食品等,导致产品附加值低,蛋白质资源没有充分利用[7,8]。
本文以蓝圆 鲹(Decapterus maruadsi)鱼肉蛋白为原料,选用 6种蛋白酶在各自适宜的条件下酶解制备蓝圆 鲹降血压肽,并采用超滤技术对酶解产物中活性组分进行初步分离富集,为开发新的生物活性肽,提高蓝圆 鲹 蛋白质的利用率以及为蓝圆 鲹的深加工提供理论依据。
1 材料与方法
1.1 材料与仪器
马尿酰组氨酰亮氨酸(HHL)及血管紧张素转化酶(ACE)购自Sigma公司等。碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶、胃蛋白酶、中性蛋白酶、胰蛋白酶由南宁庞博生物技术公司提供;其他化学试剂为国产色谱纯或分析纯;鲹蓝圆 购于广西北海鱼市批发市场。
A-88型组织捣碎匀浆机,江苏金坛市医疗仪器厂;4K15型低温高速离心机,Sigma公司;Aglient 1100高效液相色谱仪,美国安捷伦科技有限公司;Labscale 小型切向流仪,美国Millipore公司。
1.2 实验方法
1.2.1 酶解工艺
将冷冻的蓝圆 鲹解冻后去头尾、骨架后匀浆,将匀浆液于75℃条件下干燥后,再将其粉碎,过20目筛后测定鱼粉蛋白质含量。取含一定质量蛋白质的鱼粉,按料水比混合后煮沸 15 min,冷却至酶解温度并调至酶解 pH,加入一定量的酶启动反应。在恒温下不断加入碱或酸溶液以维持体系pH恒定,酶解结束后调pH至中性,煮沸10 min将酶灭活,将酶解产物在4 ℃、6 000 r/min的条件下离心10 min,取上清液备用。
1.2.2 水解度(DH)的测定
水解度的测定,采用pH-stat滴定法[9]。
1.2.3 活性反应液的制备与检测
参考Cushman等的检测原理,采用HPLC法检测样品的体外抑制活性[10]。
1.2.4 酶解条件优化
以木瓜蛋白酶和蓝圆 鲹蛋白为原料进行酶解,分别考察酶用量、酶解温度、pH值及底物浓度对水解度和抑制率的影响。
1.2.5 降血压肽的初步分离
选用10 kDa和5 kDa的超滤膜对酶解液进行初步分离,测定分离后不同组分对ACE的抑制活性及各滤液蛋白回收率。
2 实验结果与分析
2.1 不同酶解产物的活性
选用6 种蛋白酶对蓝圆 鲹蛋白进行酶解,相同质量酶解产物对ACE的抑制效果如图1所示。
由图1可知各种蛋白酶的酶解产物对ACE均有抑制作用,其中木瓜蛋白酶酶解产物对ACE的抑制效果较理想,碱性蛋白酶的酶解产物对ACE的抑制效果最小,这在酶解其他蛋白质制备降血压肽的研究中也有类似结果[11-12],说明蓝圆 鲹蛋白经上述 6种蛋白酶酶解后均可产生具有抑制ACE活性的片段,但由于酶的专一性不同,使得产生的肽片段种类和数量存在差异,导致酶解产物对ACE的抑制效果相差较大,因此选用木瓜蛋白酶为制备蓝圆 鲹降血压肽的酶解用酶。
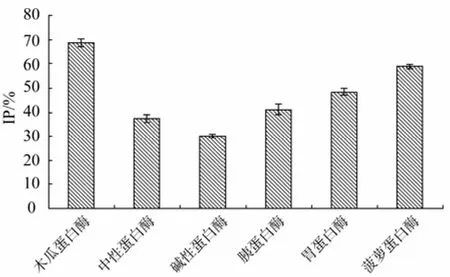
图1 6种蛋白酶酶解产物的抑制活性Fig.1 The ACE inhibitory activity of six kinds of hydrolysates
2.2 木瓜蛋白酶酶解蓝圆 鲹蛋白工艺优化
2.2.1 水解度(DH)与抑制率(IP)的关系
蓝圆 鲹蛋白在不同水解度下的酶解产物对 ACE抑制效果如图2所示。
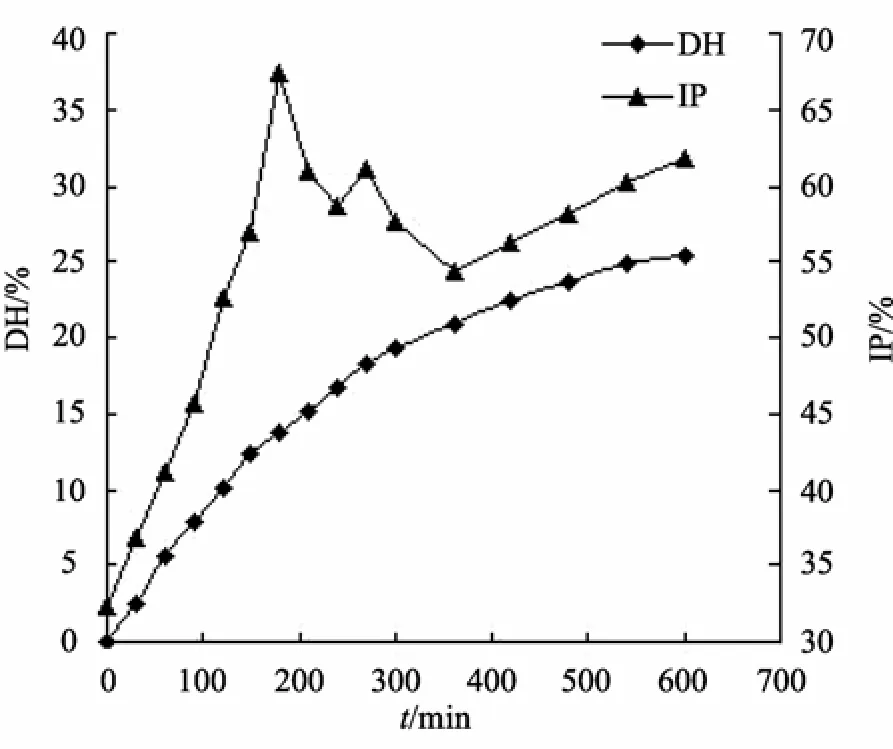
图2 水解度与抑制率的关系Fig.2 The diversification for DH and ACE inhibitory ratio
由图 2知,随着蓝圆鲹蛋白酶解时间的延长,水解度逐渐增大,酶解产物对ACE的抑制率随水解度的增加而增大,在水解度为13.7%时达到最大,随后水解产物对ACE的抑制率呈降低趋势,可能是由于水解初始阶段生成的具有ACE抑制活性的肽增加,表现为随水解度的增大,酶解产物对 ACE的抑制活性增强,随着水解的继续进行,具有ACE抑制活性的肽被进一步水解成无活性或活性较小的短肽或氨基酸,从而表现出总体对ACE的抑制活性降低[13],并且蛋白肽的水解度与其对ACE抑制率没有严格的相关性,即水解度高抑制活性不一定高[14]。为确保酶解产物具有较好的ACE抑制活性,确定本实验的水解度应控制在13.0%~16.0%之间,酶解时间不超过240 min。
2.2.2 初始酶用量对水解度的影响
在初始底物浓度为20 g/L,温度为55 ℃,pH为7.0,水解时间为 4 h的条件下,改变初始酶加入量,水解度随酶用量的变化如图3所示。
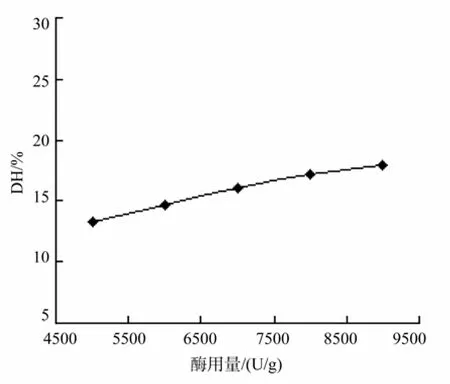
图3 酶用量对水解度的影响Fig.3 Effect of different initial enzyme concentrations on DH
由图3可知,在酶用量较低时,DH随着酶用量的增加而增大,这是因为在底物浓度一定时增加酶用量,能有更多的酶活性位点与底物结合,反应速率增加,当酶用量增加到7 000 U/g时水解度增加的速度变缓慢,此时底物与酶的结合几乎已经达到饱和状态,部分酶不能与底物结合,因此,酶解工艺中初始酶用量选择为7 000 U/g。
2.2.3 初始底物浓度对水解度的影响
在初始酶用量为7 000 U/g,温度为55 ℃,pH为7.0,水解时间为4 h条件下,考察初始底物浓度对水解度的影响,结果如图4所示。
由图4知,DH随底物浓度增大而减小,是由于在酶用量一定时,底物浓度增加溶液黏度增大,使得酶的扩散和传质受到影响, 而当底物浓度增大到30 g/L时,在固定时间内达不到高抑制率要求的水解度范围,因此选择初始底物浓度为25 g/L。
2.2.4 温度对水解度的影响
在初始酶用量为7 000 U/g,底物浓度为25 g/L,pH为7.0,水解时间为4 h条件下,不同酶解温度对水解度的影响如图5所示。
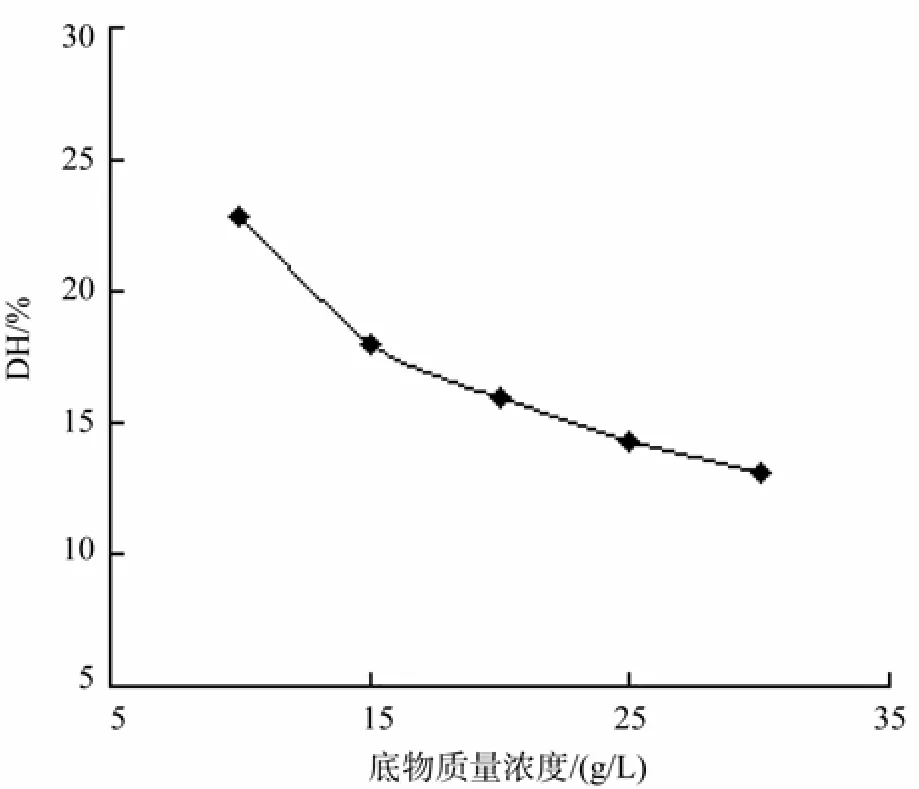
图4 底物浓度对水解度的影响Fig.4 Effect of different initial substrate concentrations on DH
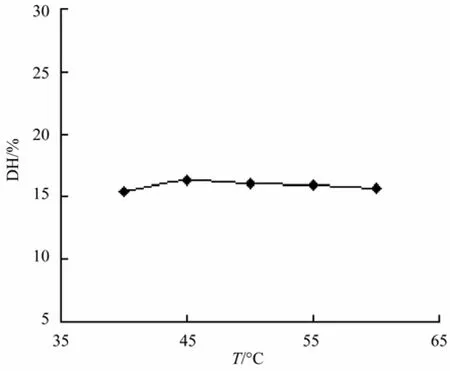
图5 温度对水解度的影响Fig.5 Effect of different temperatures on DH
温度对酶促反应速度的影响是温度上升时,反应速度加快,随着温度的升高,酶活性开始受到抑制,催化速度开始下降[15]。由图5知,酶在45℃水解度较其他温度的水解度高,为使酶作用保持高效率则选择45℃为酶解温度。
2.2.5 pH对水解度的影响
在酶用量为7 000 U/g,底物浓度为25 g/L,温度为45 ℃的条件下,考察pH对水解度的影响。结果如图6所示。
不同pH值不仅可以改变酶的空间构象,使酶发生可逆或不可逆失活,亦可改变底物的解离状态,影响酶分子活性部位上有关基团的解离,从而影响底物与酶的结合,同时,pH可决定维持酶空间结构的有关基团的解离,影响酶活性部位的构象,进而影响酶活性[15]。图6显示,在pH偏酸性时酶的水解度较大,随着 pH的增大,水解度降低,为方便后续工艺中的除盐步骤,所以选择酶解pH为7.0。
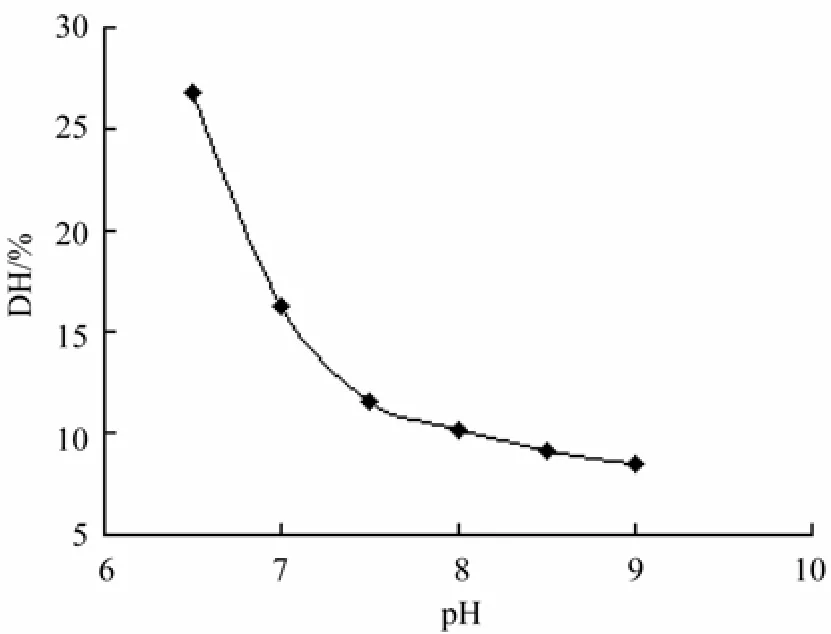
图6 pH对水解度的影响Fig.6 Effect of different pH values on DH
2.3 超滤前后多肽回收率及抑制活性
取蛋白质浓度为 22.4 mg/L的酶解液 500 mL,在 pH为 7.0的室温条件下,分别选用 10 kDa 和 5 kDa的超滤膜超滤至截流液不大于50 mL,测定超滤前后各部分滤液的 ACE抑制活性及蛋白质回收率,结果如表1所示。
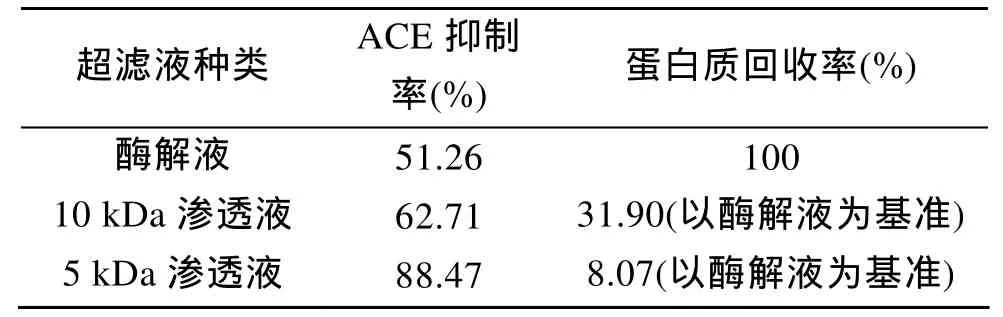
表1 超滤后不同部分滤液的ACE抑制活性Tab.1 ACE Inhibitory activity of different ultrafiltrating solutions
由表1可知,酶解液经10 kDa和5 kDa滤膜超滤后均可实现对酶解产物中活性组分的分离富集。其中,5 kDa渗透液中活性成分对ACE的抑制率可高达88.47%,较酶解液活性提高了1.72倍,而已有研究表明,大多数ACE抑制肽由 2~12个氨基酸组成,个别由 15个氨基酸组成[16],其分子质量范围约3kDa以下,故用 5 kDa的超滤膜分离是合适的,且该结果与目前很多超滤能够有效富集降血压肽活性部分的研究结论相似[17,18]。由此可见,活性组分主要由分子质量小于 5 kDa的肽组成,可通过超滤将酶解液中活性较高的部分进行有效富集。
3 结论
(1)比较了 6 种蛋白酶酶解蓝圆 鲹鱼肉蛋白的酶解产物对ACE的抑制活性,其中木瓜蛋白酶酶解产物对ACE的抑制活性最大。考察了木瓜蛋白酶酶解蓝圆 鲹鱼肉蛋白水解度与抑制率的关系,确定水解度在13.0%~16.0%之间酶解产物具有较好的ACE抑制活性,当水解度为 13.7%时酶解产物的 ACE抑制活性最高为67.4%。
(2)考察了初始酶用量、初始底物浓度、酶解温度以及pH值对水解度的影响,确定了适宜的水解条件为: 初始酶用量为7 000 U/g,初始底物浓度为25 g/L,酶解温度为 45℃,pH为 7.0,酶解时间为 240 min,此时水解度为16.0%,酶解产物对ACE具有较好的抑制活性。
(3)利用超滤对酶解产物中活性组分进行初步分离和富集,表明产物中高活性组分主要富集于 10 kDa和5 kDa的渗透液中,而5 kDa渗透液中活性成分对ACE的抑制率最高可达88.47%,说明酶解液中活性组分主要由分子量小于5 kDa的肽组成。
[1]Sang-Hoon Lee,Zhong-Ji Qian,Se-Kwon Kim.A novel angiotensin I converting enzyme inhibitory peptide from tuna frame protein hydrolysate and its antihypertensive effect in spontaneously hypertensive rats[J].Food Chemistry,2010,118: 96-112.
[2]Marta Miguel,María A Manso,Mercedes Salaices,et al.Vascular effects and antihypertensive properties of kappa-casein macropeptide[J].International Dairy Journal,2007,17(12): 1473-1477.
[3]Vanessa Vermeirssen,John Van Camp,Willy Verstraete.Fractionation of angiotensin I converting enzyme inhibitory activity from pea and whey protein in vitro gastrointestinal digests [J].Journal of the Science of Food and Agriculture,2005,85(3): 399-405.
[4]Wu Jianping,Ding Xiaolin.Hypertensive and physiological effect of angiotensin converting enzyme inhibitory peptides derived from soy protein on spontaneously hypertensive rats[J].Journal of Agricultural and Food Chemistry,2001.49(1): 501-506.
[5]Rotimi E Aluko,Erasmus D Monu.Functional and bioactive properties of quinoa seed protein hydrolysates[J].Journal of Food Science,2003,68(4):1254-1258.
[6]Ali Bougatef,Naima Nedjar-Arroume,Ahmed Barkia,et al.Angiotensin I-converting enzyme (ACE)inhibitory activities of sardinelle(Sardinella aurita)by-products protein hydrolysates obtained by treatment with microbial and visceral fish serine proteases[J].Food Chemistry,2008,111(2): 350-356.
[7]崔春,赵谋明,林伟峰,等. 鲹蓝圆 快速自溶机理研究[J].食品工业科技,2005,26(2): 85-87.
[8]闫发青.低值水产品的综合开发利用[J].中国水产,2010(06): 67-68.
[9]Marquez M C,Vazquez M A.Modeling of enzymatic protein hydrolysis[J].Process Biochemistry,1999,35:111-117.
[10]张政委,刘旭辉,廖丹葵,等.酶解马氏珠母贝肉制备降血压肽工艺条件优化[J].海洋科学,2008,32(8):25-29.
[11]韩飞,于婷婷,周孟良.大豆降压肽的生产工艺研究[J].食品科学,2008,29 (11): 369-374.
[12]张瑞东,迟玉杰,阮长青.酶解蛋清蛋白制备ACE抑制肽的工艺研究[J].食品科学,2010,31(14): 1-4.
[13]管骁,姚惠源.燕麦麸蛋白 ACE抑制肽的制备及性质研究[J].中国粮油学报,2007,22 (6): 58-63.
[14]Chiang W D,Tsou M J,C hu Y H.Angiotensin I converting enzyme inhibitor derived from soy protein hydrolysate and produced by us ing m em brane reactor[J].Food Chem,2006,98: 725-732.
[15]王镜岩.生物化学[M].北京: 高等教育出版社,2002,378-379.
[16]Robert M C,R azaname A,M utter M,et al.Identification of angiotensin-I-converting enzyme inhibitory peptides derived from sodium caseina te hydro lysates produced by Lactobacillus he lveticus N CC 2765[J].J Agr Food Chem,2004,52(23): 6923-6931.
[17]张艳萍,戴志远,张虹.紫贻贝酶解物中降血压肽的超滤分离[J].食品与发酵工业,2010,36(9): 46-51.
[18]张绵松,孟秀梅,袁文鹏,等.海蜇血管紧张素转化酶抑制肽的超滤分离[J].食品与药品,2010,12(1):20-23.
